Punjab State Board PSEB 10th Class Science Important Questions Chapter 1 ਰਸਾਇਣਿਕ ਕਿਰਿਆਵਾਂ ਅਤੇ ਸਮੀਕਰਣਾਂ Important Questions and Answers.
PSEB 10th Class Science Important Questions Chapter 1 ਰਸਾਇਣਿਕ ਕਿਰਿਆਵਾਂ ਅਤੇ ਸਮੀਕਰਣਾਂ
ਵੱਡੇ ਉੱਚਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ (Long Answer Type Questions)
ਪ੍ਰਸ਼ਨ 1.
ਸੰਤੁਲਿਤ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਨੂੰ ਕਿਸ ਪ੍ਰਕਾਰ ਲਿਖਿਆ ਜਾਂਦਾ ਹੈ ? ਇਸਦੇ ਵੱਖ-ਵੱਖ ਚਰਨਾਂ ਦਾ ਵਰਣਨ ਕਰੋ ।
ਉੱਤਰ-
ਸੰਤੁਲਿਤ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਨੂੰ ਲਿਖਣ ਦੇ ਤਰੀਕੇ ਬਾਰੇ ਜਾਣਨ ਲਈ ਇਕ ਉਦਾਹਰਣ ਲੈਂਦੇ ਹਾਂ ।
ਜ਼ਿੰਕ + ਸਲਫਿਊਰਿਕ ਐਸਿਡ → ਜ਼ਿੰਕ ਸਲਫੇਟ + ਹਾਈਡਰੋਜਨ ।
ਇਸ ਸਮੀਕਰਣ ਨੂੰ ਹੇਠ ਲਿਖੇ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਨਾਲ ਦਰਸਾਇਆ ਜਾ ਸਕਦਾ ਹੈ ।
Zn + H2SO4 → ZnSO4 + H2
ਤੀਰ ਦੇ ਨਿਸ਼ਾਨ ਦੇ ਦੋਵੇਂ ਪਾਸੇ ਤੱਤਾਂ ਦੇ ਪਰਮਾਣੂਆਂ ਦੀ ਗਿਣਤੀ ਦੀ ਜਾਂਚ ਕਰਦੇ ਹਾਂ ।
| ਤੱਤ | ਅਭਿਕਾਰਕਾਂ ਦੇ ਪਰਮਾਣੂਆਂ ਦੀ ਗਿਣਤੀ (LHS) | ਉਤਪਾਦਾਂ ਵਿੱਚ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ (RHS) |
| Zn | 1 | 1 |
| H | 2 | 2 |
| S | 1 | 1 |
| O | 4 | 4 |
ਸਮੀਕਰਣ ਵਿੱਚ ਤੀਰ ਦੇ ਨਿਸ਼ਾਨ ਦੇ ਦੋਨੋਂ ਪਾਸੇ ਹਰ ਤੱਤ ਦੇ ਪਰਮਾਣੂਆਂ ਦੀ ਗਿਣਤੀ ਬਰਾਬਰ ਹੈ । ਇਸ ਲਈ ਇਹ ਇੱਕ ਸੰਤੁਲਿਤ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਹੈ ।
ਹੁਣ ਹੇਠ ਲਿਖੇ ਸਮੀਕਰਣ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਦੀ ਕੋਸ਼ਿਸ਼ ਕਰਦੇ ਹਾਂ-
Fe + H2O → Fe3O4 + H2
![]()
ਚਰਨ 1.
ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਲਈ ਸਭ ਤੋਂ ਪਹਿਲਾਂ ਹਰ ਸੂਤਰ ਦੇ ਚਾਰੋਂ ਪਾਸੇ ਇਕ ਬਾਕਸ ਬਣਾ ਲਉ । ਸਮੀਕਰਣ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਦੇ ਸਮੇਂ ਬਾਕਸ ਅੰਦਰ ਕੁਝ ਵੀ ਬਦਲਾਅ ਨਹੀਂ ਕਰਨਾ ਚਾਹੀਦਾ ਹੈ ।

ਚਰਨ 2.
ਅਸੰਤੁਲਿਤ ਸਮੀਕਰਣ ਵਿੱਚ ਮੌਜੂਦ ਵੱਖ-ਵੱਖ ਤੱਤਾਂ ਦੇ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ ਦੀ ਸੂਚੀ ਬਣਾਉ ।
| ਤੱਤ | ਅਭਿਕਾਰਕਾਂ ਦੇ ਪਰਮਾਣੂਆਂ ਦੀ ਗਿਣਤੀ (LHS) | ਉਤਪਾਦਾਂ ਵਿੱਚ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ (RHS) |
| Fe | 1 | 3 |
| H | 2 | 2 |
| 0 | 1 | 4 |
ਚਰਨ 3.
ਸਭ ਤੋਂ ਵੱਧ ਪਰਮਾਣੂ ਵਾਲੇ ਯੌਗਿਕ ਨੂੰ ਪਹਿਲਾਂ ਸੰਤੁਲਿਤ ਕਰੋ ਬੇਸ਼ੱਕ ਉਹ ਅਭਿਕਾਰਕ ਹੋਵੇ ਜਾਂ ਉਤਪਾਦ ॥ ਉਸ ਯੋਗਿਕ ਵਿੱਚ ਸਭ ਤੋਂ ਵੱਧ ਪਰਮਾਣੂ ਵਾਲੇ ਤੱਤ ਨੂੰ ਚੁਣ ਲਉ । ਇਸ ਆਧਾਰ ਤੇ ਅਸੀਂ Fe੦, ਅਤੇ ਉਸਦੇ ਆਕਸੀਜਨ ਤੱਤ ਨੂੰ ਚੁਣ ਲੈਂਦੇ ਹਾਂ । ਸੱਜੇ ਪਾਸੇ ਆਕਸੀਜਨ ਦੇ ਚਾਰ ਪਰਮਾਣੂ ਹਨ ਅਤੇ ਖੱਬੇ ਪਾਸੇ ਸਿਰਫ਼ ਇੱਕ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਲਈ-
| ਆਕਸੀਜਨ ਦੇ ਪਰਮਾਣੂ | ਅਭਿਕਾਰਕਾਂ ਵਿੱਚ | ਉਤਪਾਦ ਵਿੱਚ |
| (i) ਸ਼ੁਰੂ ਵਿੱਚ | 1 (H2O ਵਿੱਚ) | 4 (Fe3O4 ਵਿੱਚ) |
| (ii) ਸੰਤੁਲਨ ਤੋਂ ਬਾਅਦ | 1 × 4 | 4 |
ਪਰਮਾਣੂਆਂ ਦੀ ਗਿਣਤੀ ਨੂੰ ਬਰਾਬਰ ਕਰਨ ਲਈ ਅਸੀਂ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਸ਼ਾਮਿਲ ਤੱਤਾਂ ਅਤੇ ਯੌਗਿਕਾਂ ਦੇ ਸੂਤਰਾਂ ਨੂੰ ਨਹੀਂ ਬਦਲ ਸਕਦੇ , ਜਿਵੇਂ ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਲਈ ਅਸੀਂ 4 ਗੁਣਾਂਕ ਲਗਾ ਕੇ 4H2O ਲਿਖ ਸਕਦੇ ਹਾਂ, ਪਰ H2O4 ਜਾਂ (H2O)2 ਜਾਂ (H2O)4 ਨਹੀਂ ਕਰ ਸਕਦੇ ! ਅੰਸ਼ਿਕ ਰੂਪ ਵਿੱਚ ਸੰਤੁਲਿਤ ਸਮੀਕਰਣ ਹੁਣ ਇਸ ਤਰ੍ਹਾਂ ਲੱਗੇਗਾ ।
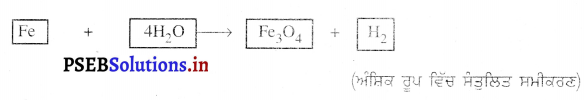
ਚਰਨ 4.
Fe ਅਤੇ ਸ ਪਰਮਾਣੂ ਅਜੇ ਵੀ ਅਸੰਤੁਲਿਤ ਹਨ । ਇਨ੍ਹਾਂ ਵਿੱਚ ਕਿਸੇ ਇਕ ਤੱਤ ਨੂੰ ਚੁਣ ਕੇ ਅੱਗੇ ਵਧਿਆ ਜਾਂਦਾ ਹੈ । ਹਾਈਡਰੋਜਨ ਪਰਮਾਣੁ ਨੂੰ ਬਰਾਬਰ ਕਰਨ ਲਈ ਸੱਜੇ ਪਾਸੇ ਹਾਈਡਰੋਜਨ ਅਣੁ ਦੀ ਗਿਣਤੀ ਨੂੰ ‘4’ ਕਰ ਦਿੰਦੇ ਹਾਂ ।
| ਹਾਈਡਰੋਜਨ ਦੇ ਪਰਮਾਣੂ | ਅਭਿਕਾਰਕਾਂ ਵਿੱਚ | ਉਤਪਾਦਾਂ ਵਿੱਚ |
| (i) ਸ਼ੁਰੂ ਵਿੱਚ | 8 (4H2O) ਵਿੱਚ | 2 (H2 ਵਿੱਚ) |
| (ii) ਸੰਤੁਲਿਤ ਕਰਨ ਲਈ | 8 | 2 × 4 |
ਹੁਣ ਸਮੀਕਰਣ ਇਸ ਤਰ੍ਹਾਂ ਲੱਗੇਗਾ
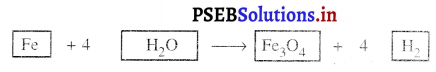
ਚਰਨ 5.
ਉੱਪਰ ਦਿੱਤੇ ਸਮੀਕਰਣ ਦੀ ਜਾਂਚ ਕਰੋ ਅਤੇ ਤੀਸਰਾ ਤੱਤ ਚੁਣ ਲਉ ਜੋ ਅਜੇ ਤਕ ਅਸੰਤੁਲਿਤ ਹੈ । ਤੁਸੀਂ ਦੇਖੋਗੇ ਕਿ ਸਿਰਫ਼ ਲੋਹਾ ਹੀ ਇੱਕ ਤੱਤ ਹੈ ਜੋ ਸੰਤੁਲਿਤ ਕਰਨਾ ਬਾਕੀ ਹੈ ।
| ਲੋਹਾ ਪਰਮਾਣੂ | ਅਭਿਕਾਰਕਾਂ ਵਿੱਚ | ਉਤਪਾਦਾਂ ਵਿੱਚ |
| (i) ਸ਼ੁਰੂ ਵਿੱਚ | 1 (Fe ਵਿੱਚ) | 3 (Fe3O4 ਵਿੱਚ) |
| (ii) ਸੰਤੁਲਨ ਲਈ | 1 × 3 | 3 |
Fe ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਲਈ ਸੱਜੇ ਪਾਸੇ ਅਸੀਂ Fe ਦੇ 3 ਪਰਮਾਣੂ ਲੈਂਦੇ ਹਾਂ ।

ਚਰਨ 6.
ਅੰਤ ਵਿੱਚ, ਇਸ ਸੰਤੁਲਿਤ ਸਮੀਕਰਣ ਦੀ ਜਾਂਚ ਦੇ ਲਈ ਸਮੀਕਰਣ ਦੇ ਦੋਵੇਂ ਪਾਸੇ ਤੱਤਾਂ ਦੇ ਪ੍ਰਮਾਣੂਆਂ ਦੀ ਗਿਣਤੀ ਕਰਨ ਤੇ
3Fe +4H2O → Fe3O4 + 4H2
(ਸੰਤੁਲਿਤ ਸਮੀਕਰਣ)
ਸਮੀਕਰਣ ਵਿੱਚ ਦੋਵੇਂ ਪਾਸੇ ਤੱਤਾਂ ਦੇ ਪਰਮਾਣੂਆਂ ਦੀ ਗਿਣਤੀ ਬਰਾਬਰ ਹੈ । ਇਸ ਲਈ ਇਹ ਸਮੀਕਰਣ ਹੁਣ ਸੰਤੁਲਿਤ ਹੈ । ਰਸਾਇਣਿਕ ਸਮੀਕਰਣਾਂ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਦੀ ਇਸ ਵਿਧੀ ਨੂੰ ਹਿਟ ਐਂਡ ਟਾਇਲ ਵਿਧੀ ਕਹਿੰਦੇ ਹਨ, ਕਿਉਂਕਿ ਸਭ ਤੋਂ ਛੋਟੀ ਪੂਰਨ ਅੰਕ ਸੰਖਿਆ ਦੇ ਗੁਣਾਂ ਦੀ ਵਰਤੋਂ ਕਰਕੇ ਸਮੀਕਰਣ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰਨ ਦੀ ਕੋਸ਼ਿਸ਼ ਕਰਦੇ ਹਾਂ ।
ਚਰਨ 7.
ਭੌਤਿਕ ਅਵਸਥਾ ਦੇ ਸੰਕੇਤ ਲਿਖਣਾ – ਉੱਪਰ ਲਿਖੇ ਸੰਤੁਲਿਤ ਸਮੀਕਰਣ ਵਿੱਚ ਭੌਤਿਕ ਅਵਸਥਾ ਦੀ ਕੋਈ ਜਾਣਕਾਰੀ ਨਹੀਂ ਹੈ ।
ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਨੂੰ ਵਧੇਰੇ ਜਾਣਕਾਰੀ ਵਾਲਾ ਬਣਾਉਣ ਲਈ ਅਭਿਕਾਰਕਾਂ ਅਤੇ ਉਤਪਾਦਾਂ ਦੇ ਰਸਾਇਣਿਕ ਸੂਤਰਾਂ ਦੇ ਨਾਲ ਉਨ੍ਹਾਂ ਦੀ ਭੌਤਿਕ ਅਵਸਥਾ ਨੂੰ ਵੀ ਦਰਸਾਇਆ ਜਾਂਦਾ ਹੈ । ਅਭਿਕਾਰਕ ਅਤੇ ਉਤਪਾਦਾਂ ਦੇ ਠੋਸ, ਗੈਸ ਅਤੇ ਤਰਲ ਤੇ ਜਲੀ ਅਵਸਥਾ ਨੂੰ ਵਾਰੀ-ਵਾਰੀ (s), (g), (1) ਅਤੇ (aq) ਨਾਲ ਦਰਸਾਇਆ ਜਾਂਦਾ ਹੈ | ਅਭਿਕਾਰਕ ਜਾਂ ਉਤਪਾਦ ਜਦੋਂ ਪਾਣੀ ਵਿੱਚ ਘੋਲ ਦੇ ਰੂਪ ਵਿੱਚ ਮੌਜੂਦ ਰਹਿੰਦੇ ਹਨ ਤਾਂ (aq) ਲਿਖਦੇ ਹਨ । ਇਸ ਲਈ ਸੰਤੁਲਿਤ ਸਮੀਕਰਣ ਇਸ ਪ੍ਰਕਾਰ ਹੋਵੇਗਾ-
3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g)
ਪ੍ਰਸ਼ਨ 2.
ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆਵਾਂ ਦੀਆਂ ਕਿਸਮਾਂ ਉਦਾਹਰਨਾਂ ਸਹਿਤ ਲਿਖੋ ।
ਉੱਤਰ-
ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਦੌਰਾਨ ਕਿਸੇ ਇਕ ਤੱਤ ਦਾ ਪਰਮਾਣੂ ਦੂਸਰੇ ਤੱਤ ਦੇ ਪਰਮਾਣੂ ਵਿੱਚ ਨਹੀਂ ਬਦਲਦਾ ਹੈ । ਨਾ ਹੀ ਕੋਈ ਪਰਮਾਣੂ ਮਿਸ਼ਰਣ ਤੋਂ ਬਾਹਰ ਜਾਂਦਾ ਹੈ ਨਾ ਹੀ ਬਾਹਰ ਤੋਂ ਮਿਸ਼ਰਣ ਵਿੱਚ ਆਉਂਦਾ ਹੈ । ਅਸਲ ਵਿੱਚ, ਇਸੇ ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਪਰਮਾਣੂਆਂ ਦੇ ਆਪਸੀ ਬੰਧਨ ਦੇ ਟੁੱਟਣ ਅਤੇ ਜੁੜਨ ਨਾਲ ਨਵੇਂ ਪਦਾਰਥਾਂ ਦਾ ਨਿਰਮਾਣ ਹੁੰਦਾ ਹੈ ।
1. ਸੰਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ – ਅਜਿਹੀ ਪ੍ਰਤੀਕਿਰਿਆ ਜਿਸ ਵਿੱਚ ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਅਭਿਕਾਰਕ ਮਿਲ ਕੇ ਏਕਲ ਉਤਪਾਦ ਦਾ ਨਿਰਮਾਣ ਕਰਦੇ ਹਨ, ਉਸ ਨੂੰ ਸੰਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ ਕਹਿੰਦੇ ਹਨ ।
ਜਿਵੇਂ-ਕੈਲਸ਼ੀਅਮ ਆਕਸਾਈਡ ਪਾਣੀ ਨਾਲ ਤੇਜ਼ੀ ਨਾਲ ਪ੍ਰਤੀਕਿਰਿਆ ਕਰਕੇ ਬੁਝੇ ਹੋਏ ਚੂਨੇ ਕੈਲਸ਼ੀਅਮ ਹਾਈਡਰਾਕਸਾਈਡ ਦਾ ਨਿਰਮਾਣ ਕਰਕੇ ਬਹੁਤ ਜ਼ਿਆਦਾ ਮਾਤਰਾ ਵਿੱਚ ਗਰਮੀ ਪੈਦਾ ਕਰਦਾ ਹੈ ।
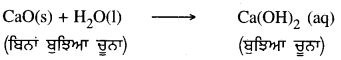
ਇਸ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਕੈਲਸ਼ੀਅਮ ਆਕਸਾਈਡ ਅਤੇ ਪਾਣੀ ਮਿਲ ਕੇ ਏਕਲ ਉਤਪਾਦ ਕੈਲਸ਼ੀਅਮ ਹਾਈਡਰਾਕਸਾਈਡ ਬਣਾਉਂਦੇ ਹਨ ।
2. ਅਪਘਟਨ ਪ੍ਰਤੀਕਿਰਿਆ – ਉਹ ਪ੍ਰਤੀਕਿਰਿਆ ਜਿਸ ਵਿੱਚ ਕੋਈ ਯੌਗਿਕ ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਸਰਲ ਪਦਾਰਥਾਂ ਵਿੱਚ ਟੁੱਟਦਾ ਹੈ, ਉਸ ਨੂੰ ਅਪਘਟਨ ਪ੍ਰਤੀਕਿਰਿਆ ਕਹਿੰਦੇ ਹਨ ।
ਅਪਘਟਨ ਪ੍ਰਤੀਕਿਰਿਆ ਦੇ ਉਦਾਹਰਨ-
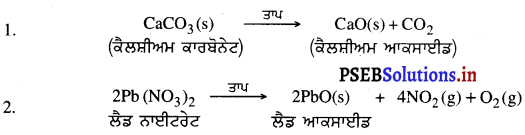
3. ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ – ਜਦੋਂ ਕੋਈ ਤੱਤ ਦੂਸਰੇ ਤੱਤ ਨੂੰ ਉਸ ਦੇ ਯੌਗਿਕ ਵਿੱਚੋਂ ਵਿਸਥਾਪਤ ਕਰ ਦਿੰਦਾ ਹੈ ਤਾਂ ਉਹ ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ਹੁੰਦੀ ਹੈ ।
ਉਦਾਹਰਨ-

4. ਦੂਹਰੀ-ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ – ਦੂਹਰੀ-ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਦੋ ਵੱਖ-ਵੱਖ ਪਰਮਾਣੂ ਜਾਂ ਪਰਮਾਣੂਆਂ ਦੇ ਸਮੂਹ ਦਾ ਆਪਸ ਵਿੱਚ ਆਦਾਨ-ਪ੍ਰਦਾਨ ਹੁੰਦਾ ਹੈ ।
ਉਦਾਹਰਨ-

![]()
ਪ੍ਰਸ਼ਨ 3.
ਆਕਸੀਕਰਨ ਅਤੇ ਲਘੂਕਰਨ ਦੀ ਉਦਾਹਰਨ ਸਹਿਤ ਸੰਖੇਪ ਵਿੱਚ ਵਿਆਖਿਆ ਕਰੋ ।
ਉੱਤਰ-
ਆਕਸੀਕਰਨ ਅਤੇ ਲਘੂਕਰਨ – ਕਿਸੇ ਪ੍ਰਕਿਰਿਆ ਵਿੱਚ ਪਦਾਰਥ ਦਾ ਆਕਸੀਜਨ ਉਦੋਂ ਹੁੰਦਾ ਹੈ ਜਦੋਂ ਉਸ ਵਿੱਚ ਆਕਸੀਜਨ ਦਾ ਵਾਧਾ ਜਾਂ ਹਾਈਡਰੋਜਨ ਦੀ ਹਾਨੀ ਹੁੰਦੀ ਹੈ । ਇਸਦੇ ਉਲਟ ਜਦੋਂ ਪਦਾਰਥ ਦਾ ਲਘੂਕਰਨ, ਹੁੰਦਾ ਹੈ ਤਾਂ ਉਸ ਵਿੱਚ ਆਕਸੀਜਨ ਦੀ ਹਾਨੀ ਜਾਂ ਹਾਈਡਰੋਜਨ ਦਾ ਵਾਧਾ ਹੁੰਦਾ ਹੈ ।
ਉਦਾਹਰਨ – ਕਾਪਰ ਚੂਰਣ ਵੀ ਸਤਹਿ ‘ਤੇ ਕਾਪਰ (II) ਆਕਸਾਈਡ ਦੀ ਕਾਲੀ ਪਰਤ ਚੜ੍ਹ ਜਾਂਦੀ ਹੈ । ਇਹ ਕਾਲਾ ਪਦਾਰਥ ਕਿਉਂ ਬਣਿਆ ? ਇਹ ਕਾਪਰ ਆਕਸਾਈਡ, ਕਾਪਰ ਵਿੱਚ ਆਕਸੀਜਨ ਦੇ ਯੋਗ ਤੋਂ ਬਣਿਆ ਹੈ ।
![]()
ਜੇ ਇਸ ਗਰਮ ਪਦਾਰਥ ਦੇ ਉੱਪਰ ਹਾਈਡਰੋਜਨ ਗੈਸ ਪ੍ਰਵਾਹਿਤ ਕੀਤੀ ਜਾਵੇ, ਤਾਂ ਕਹਿੰਦੇ ਹਨ ਕਿ ਉਸਦਾ ਆਕਸੀਕਰਨ ਹੋਇਆ ਹੈ ਅਤੇ ਜਦੋਂ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਕਿਸੇ ਪਦਾਰਥ ਵਿੱਚ ਆਕਸੀਜਨ ਦੀ ਹਾਨੀ ਹੁੰਦੀ ਹੈ, ਤਾਂ ਕਹਿੰਦੇ ਹਨ ਕਿ ਉਸਦਾ ਲਘੂਕਰਨ ਹੋਇਆ ਹੈ ।
ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਕਾਪਰ (II) ਆਕਸਾਈਡ ਵਿੱਚ ਆਕਸੀਜਨ ਦੀ ਹਾਨੀ ਹੋ ਰਹੀ ਹੈ, ਇਸ ਲਈ ਇਸਦਾ ਲਘੂਕਰਨ ਹੋ ਰਿਹਾ ਹੈ । ਹਾਈਡਰੋਜਨ ਵਿੱਚ ਆਕਸੀਜਨ ਦਾ ਵਾਧਾ ਹੋ ਰਿਹਾ ਹੈ । ਇਸ ਲਈ ਇਸ ਦਾ ਆਕਸੀਕਰਨ ਹੋਇਆ ਹੈ ਅਰਥਾਤ ਕਿਸੇ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਇਕ ਅਭਿਕਾਰਕ ਦਾ ਆਕਸੀਕਰਨ ਅਤੇ ਦੂਸਰੇ ਪ੍ਰਤੀਕਾਰਕ ਦਾ ਲਘੂਕਰਨ ਹੁੰਦਾ ਹੈ । ਇਨ੍ਹਾਂ ਪ੍ਰਤੀਕਿਰਿਆਵਾਂ ਨੂੰ ਆਕਸੀਕਰਨ ਲਘੂਕਰਨ ਜਾਂ ਰੇਡਾਕਸ ਪ੍ਰਤੀਕਿਰਿਆ ਕਹਿੰਦੇ ਹਨ ।
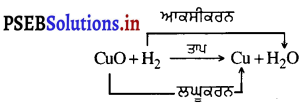
ਰੇਡਾਕਸ ਪ੍ਰਤੀਕਿਰਿਆ ਦੇ ਕੁੱਝ ਹੋਰ ਉਦਾਹਰਨ ਹਨ-
(i) ZnO+C → Zn + CO
ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਕਾਰਬਨ ਦਾ ਆਕਸੀਕਰਨ ਹੋ ਕੇ CO ਅਤੇ ZnO ਦਾ ਲਘੂਕਰਨ ਹੋ ਕੇ Zn ਬਣਦਾ ਹੈ ।
(ii) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ HCl ਦਾ ਆਕਸੀਕਰਨ ਹੋ ਕੇ Cl2 ਅਤੇ MnO2 ਦਾ ਲਘੂਕਰਨ ਹੋ ਕੇ MnCl2 ਬਣਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 4.
ਤੇਜ਼ਾਬ ਕੀ ਹੁੰਦਾ ਹੈ ? ਤੇਜ਼ਾਬਾਂ ਦੇ ਚਾਰ ਗੁਣਾਂ ਦੀ ਵਿਆਖਿਆ ਉਦਾਹਰਨ ਦੇ ਕੇ ਕਰੋ ।
ਉੱਤਰ-
ਤੇਜ਼ਾਬ- ਅਜਿਹੇ ਯੌਗਿਕ ਜਿਨ੍ਹਾਂ ਵਿੱਚ ਇੱਕ ਜਾਂ ਇੱਕ ਤੋਂ ਵੱਧ ਹਾਈਡਰੋਜਨ ਪਰਮਾਣੂ ਮੌਜੂਦ ਹੁੰਦੇ ਹਨ ਅਤੇ ਉਹ ਪਾਣੀ ਵਿੱਚ ਘੁਲ ਕੇ ਚਾਰਜਿਤ ਹਾਈਡਰੋਨੀਅਮ ਆਇਨ (H3O+) ਪੈਦਾ ਕਰਦੇ ਹਨ, ਤੇਜ਼ਾਬ ਕਹਾਉਂਦੇ ਹਨ। ਤੇਜ਼ਾਬਾਂ ਦਾ ਸੁਆਦ ਖੱਟਾ ਹੁੰਦਾ ਹੈ ।
ਤੇਜ਼ਾਬਾਂ ਦੇ ਗੁਣ-
(1) ਧਾਤੂਆਂ ਨਾਲ ਕਿਰਿਆ – ਤੇਜ਼ਾਬ ਕਿਰਿਆਸ਼ੀਲ ਧਾਤਾਂ ਜਿਵੇਂ-ਜ਼ਿੰਕ, ਮੈਗਨੀਸ਼ੀਅਮ, ਲੋਹਾ, ਮੈਗਨੀਜ਼ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਹਾਈਡਰੋਜਨ ਗੈਸ ਪੈਦਾ ਕਰਦੀਆਂ ਹਨ ।
Zn(s) + ਤਣ H2SO4(aq) → ZnSO4(aq) + H2(g) ↑
Mg(s) + ਤਣ 2HCl (aq) → MgCl2(aq) + H2(g) ↑
(2) ਧਾਤੂ ਕਾਰਬੋਨੇਟ ਅਤੇ ਧਾਤੂ ਬਾਈਕਾਰਬੋਨੇਟ ਨਾਲ ਕਿਰਿਆ-ਤੇਜ਼ਾਬ ਧਾਤੂ ਕਾਰਬੋਨੇਟਾਂ ਅਤੇ ਧਾਤੂ ਬਾਈਕਾਰਬੋਨੇਟਾਂ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ CO2 ਗੈਸ ਪੈਦਾ ਕਰਦੇ ਹਨ ।
Na2CO3 + H2SO4 → Na2SO4+ H2O + CO2 ↑
NaHCO3 + HCl → NaCl + H2O + CO2 ↑
(3) ਖਾਰਾਂ ਨਾਲ ਕਿਰਿਆ – ਤੇਜ਼ਾਬ ਖਾਰਾਂ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਉਦਾਸੀਨੀਕਰਨ ਨੂੰ ਪ੍ਰਗਟ ਕਰਦੇ ਹਨ, ਲੂਣ ਅਤੇ ਪਾਣੀ ਤਿਆਰ ਕਰਦੇ ਹਨ ।
HCl + NaOH → NaCl + H2O
HCl + KOH → KCl + H2O
(4) ਧਾਤੂ ਸਲਫਾਈਡ ਅਤੇ ਹਾਈਡਰੋਜਨ ਸਲਫਾਈਡ ਨਾਲ ਕਿਰਿਆ – ਤੇਜ਼ਾਬ, ਵੱਖ-ਵੱਖ ਧਾਤੂ ਸਲਫਾਈਡਾਂ ਅਤੇ ਹਾਈਡਰੋਜਨ ਸਲਫਾਈਡ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ H2S ਗੈਸ ਪੈਦਾ ਕਰਦੇ ਹਨ ।
FeS + H2SO4 → FeSO4 + H2S(g)
KHS + 2HCl → 2KCl + 2H2S(g)
(ਪੋਟਾਸ਼ੀਅਮ ਹਾਈਡਰੋਜਨ ਸਲਫਾਈਡ)
ਪ੍ਰਸ਼ਨ 5.
ਚਿੱਤਰ ਵਿੱਚ ਕਿਸ ਕਿਸਮ ਦੀ ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਦਰਸਾਈ ਗਈ ਹੈ । ਇਸ ਕਿਰਿਆ ਦੀ ਪਰਿਭਾਸ਼ਾ ਉਦਾਹਰਨ ਸਹਿਤ ਲਿਖੋ ।
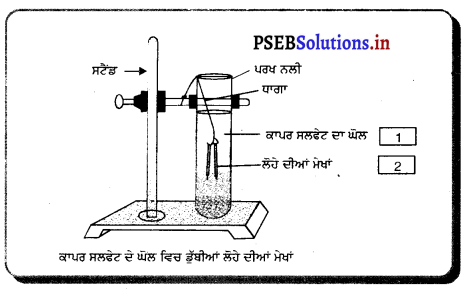
ਉੱਤਰ-
ਚਿੱਤਰ ਵਿੱਚ ਧਾਤਾਂ ਦੀ ਲੂਣਾਂ ਦੇ ਘੋਲਾਂ ਨਾਲ ਕਿਰਿਆ ਦਰਸਾਈ ਗਈ ਹੈ ਇਹ ਵਿਸਥਾਪਨ ਕਿਰਿਆ ਹੈ ।
ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ-ਜਦੋਂ ਕੋਈ ਤੱਤ ਦੂਸਰੇ ਤੱਤ ਨੂੰ ਉਸ ਦੇ ਯੌਗਿਕ ਵਿੱਚੋਂ ਵਿਸਥਾਪਤ ਕਰ ਦਿੰਦਾ ਹੈ ਤਾਂ ਇਹ ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ਹੁੰਦੀ ਹੈ । ਉਦਾਹਰਨ-

ਛੋਟੇ ਉੱਤਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ (Short Answer Type Questions)
ਪ੍ਰਸ਼ਨ 1.
ਰਸਾਇਣਿਕ ਸਮੀਕਰਣਾਂ ਨੂੰ ਲਿਖਦੇ ਸਮੇਂ ਕਿਹੜੀਆਂ-ਕਿਹੜੀਆਂ ਗੱਲਾਂ ਨੂੰ ਧਿਆਨ ਵਿੱਚ ਰੱਖਣਾ ਜ਼ਰੂਰੀ ਹੈ ?
ਉੱਤਰ-
- ਰਸਾਇਣਿਕ ਪਰਿਵਰਤਨ ਨੂੰ ਪ੍ਰਦਰਸ਼ਿਤ ਕਰਨਾ ।
- ਅਭਿਕਾਰਕਾਂ ਅਤੇ ਉਤਪਾਦਾਂ ਦੇ ਸਾਰੇ ਤੱਤਾਂ ਨੂੰ ਪ੍ਰਤੀਕਾਂ ਨਾਲ ਦਰਸਾਉਣਾ ।
- ਅਭਿਕਾਰਕਾਂ ਅਤੇ ਉਤਪਾਦਾਂ ਦੇ ਹਰ ਤੱਤ ਦੇ ਕੁੱਲ ਪਰਿਣਾਮਾਂ ਦੀ ਗਿਣਤੀ ਦਾ ਦੋਵੇਂ ਪਾਸੇ ਬਰਾਬਰ ਹੋਣਾ ।
- ਭੌਤਿਕ ਅਵਸਥਾ, ਤਾਪ ਅਤੇ ਹਾਲਤਾਂ ਨੂੰ ਸਪੱਸ਼ਟ ਕਰਨਾ ।
ਪ੍ਰਸ਼ਨ 2.
ਸੰਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ ਦੀ ਪਰਿਭਾਸ਼ਾ ਉਦਾਹਰਨ ਸਹਿਤ ਸਮਝਾਉ ।
ਉੱਤਰ-
ਸੰਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ – ਅਜਿਹੀ ਪ੍ਰਤੀਕਿਰਿਆ ਜਿਸ ਵਿੱਚ ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਅਭਿਕਾਰਕ ਮਿਲ ਕੇ ਏਕਲ ਉਤਪਾਦ ਦਾ ਨਿਰਮਾਣ ਕਰਦੇ ਹਨ, ਉਸ ਨੂੰ ਸੰਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ ਕਹਿੰਦੇ ਹਨ ।
ਉਦਾਹਰਨ-

ਪ੍ਰਸ਼ਨ 3.
ਬੁਝੇ ਹੋਏ ਚੂਨੇ ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ ਅਤੇ ਉਸਦਾ ਇਕ ਉਪਯੋਗ ਦੱਸੋ ।
ਉੱਤਰ-
ਬੁਝੇ ਹੋਏ ਚੂਨੇ ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ – Ca(OH)2
ਬੁਝੇ ਹੋਏ ਚੂਨੇ ਦੇ ਘੋਲ ਦੀ ਵਰਤੋਂ ਕੰਧਾਂ ਤੇ ਸਫ਼ੇਦੀ ਕਰਨ ਲਈ ਹੁੰਦੀ ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 4.
ਸਫ਼ੇਦੀ ਕਰਨ ਦੇ ਦੋ ਤਿੰਨ ਦਿਨ ਬਾਅਦ ਚਮਕ ਕਿਉਂ ਆ ਜਾਂਦੀ ਹੈ ?
ਉੱਤਰ-
ਕੈਲਸ਼ੀਅਮ ਹਾਈਡਰੋਆਕਸਾਈਡ ਹਵਾ ਵਿੱਚ ਮੌਜੂਦ ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਦੇ ਨਾਲ ਧੀਮੀ ਗਤੀ ਨਾਲ ਅਭਿਕਿਰਿਆ ਕਰਕੇ ਕੰਧਾਂ ਤੇ ਕੈਲਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ ਦੀ ਇਕ ਪਤਲੀ ਪਰਤ ਬਣਾ ਦਿੰਦੀ ਹੈ । ਸਫ਼ੈਦੀ ਕਰਨ ਦੇ ਦੋ-ਤਿੰਨ ਦਿਨਾਂ ਬਾਅਦ ਕੈਲਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ ਦਾ ਨਿਰਮਾਣ ਹੁੰਦਾ ਹੈ ਅਤੇ ਇਸ ਨਾਲ ਕੰਧਾਂ ਤੇ ਚਮਕ ਆ ਜਾਂਦੀ ਹੈ ।
ਪ੍ਰਸ਼ਨ 5.
ਸੰਗਮਰਮਰ ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ ਅਤੇ ਉਸਦੇ ਬਣਨ ਦੀ ਪ੍ਰਤੀਕਿਰਿਆ ਦੱਸੋ ।
ਉੱਤਰ-
ਸੰਗਮਰਮਰ ਨੂੰ ਕੈਲਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ ਵੀ ਕਹਿੰਦੇ ਹਨ ।
ਇਸਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ ਹੈ- CaCO3
ਇਸਦੇ ਬਣਨ ਦੀ ਪ੍ਰਤੀਕਿਰਿਆ-
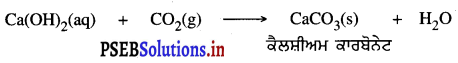
ਪ੍ਰਸ਼ਨ 6.
ਤਾਪ-ਨਿਕਾਸੀ ਪ੍ਰਤੀਕਿਰਿਆ ਦੀ ਪਰਿਭਾਸ਼ਾ ਅਤੇ ਦੋ ਉਦਾਹਰਨਾਂ ਦਿਉ ।
ਉੱਤਰ-
ਤਾਪ-ਨਿਕਾਸੀ ਪ੍ਰਤੀਕਿਰਿਆ (Exothermic Reaction) – ਜਿਹੜੀਆਂ ਪ੍ਰਤੀਕਿਰਿਆਵਾਂ ਵਿੱਚ ਉਤਪਾਦ ਦੇ ਨਿਰਮਾਣ ਦੇ ਨਾਲ-ਨਾਲ ਤਾਪ ਵੀ ਪੈਦਾ ਹੁੰਦਾ ਹੈ ਉਨ੍ਹਾਂ ਨੂੰ ਤਾਪ-ਨਿਕਾਸੀ ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਕਹਿੰਦੇ ਹਨ ।
A + B → C +D+ ਤਾਪ ਊਰਜਾ
ਇਨ੍ਹਾਂ ਪ੍ਰਤੀਕਿਰਿਆਵਾਂ ਵਿੱਚ ਅਭਿਕਾਰਕਾਂ ਦੀ ਕੁੱਲ ਊਰਜਾ ਉਤਪਾਦਾਂ ਦੀ ਕੁੱਲ ਊਰਜਾ ਤੋਂ ਵੱਧ ਹੁੰਦੀ ਹੈ ।
ਅਭਿਕਾਰਕਾਂ ਦੀ ਊਰਜਾ > ਉਤਪਾਦਾਂ ਦੀ ਊਰਜਾ
ਤਾਪ ਨਿਕਾਸੀ ਪ੍ਰਤੀਕਿਰਿਆਵਾਂ ਦੇ ਕੁਝ ਹੋਰ ਉਦਾਹਰਨ ਹਨ-
(i) ਕੁਦਰਤੀ ਗੈਸ ਦਾ ਦਹਿਣ-
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) + ਊਰਜਾ
(ii) ਸਾਗ-ਸਬਜ਼ੀਆਂ ਦਾ ਵਿਘਟਨ ਹੋ ਕੇ ਕੰਪੋਸਟ ਬਣਾਉਣਾ ਵੀ ਤਾਪ ਨਿਕਾਸੀ ਪ੍ਰਤੀਕਿਰਿਆ ਹੈ ।
ਪ੍ਰਸ਼ਨ 7.
ਤਾਪ-ਸੋਖੀ ਪ੍ਰਤੀਕਿਰਿਆਵਾਂ ਦੀ ਉਦਾਹਰਨ ਸਹਿਤ ਪਰਿਭਾਸ਼ਾ ਦਿਉ ।
ਉੱਤਰ-
ਤਾਪ-ਸੋਖੀ ਪ੍ਰਤੀਕਿਰਿਆ (Endothermic Reaction) – ਜਿਹੜੀਆਂ ਪ੍ਰਤੀਕਿਰਿਆਵਾਂ ਵਿੱਚ ਤਾਪ ਦਾ ਸੋਖਣ ਹੁੰਦਾ ਹੈ, ਉਨ੍ਹਾਂ ਨੂੰ ਤਾਪ-ਸੋਖੀ ਪ੍ਰਤੀਕਿਰਿਆ ਕਹਿੰਦੇ ਹਨ ।
A+B + ਤਾਪ → C+D
ਇਸ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਅਭਿਕਾਰਕਾਂ ਦੀ ਕੁੱਲ ਊਰਜਾ ਉਤਪਾਦਾਂ ਦੀ ਕੁੱਲ ਊਰਜਾ ਤੋਂ ਘੱਟ ਹੁੰਦੀ ਹੈ ।
ਪ੍ਰਤੀਕਾਰਕਾਂ ਦੀ ਊਰਜਾ < ਉਤਪਾਦਾਂ ਦੀ ਊਰਜਾ
ਉਦਾਹਰਨ-
(1) ਕੋਕ ਦੀ ਭਾਪ ਨਾਲ ਪ੍ਰਤੀਕਿਰਿਆ
C(s) + H2O(g) + ਤਾਪ → CO(g) + H2(g)
(2) N2 ਅਤੇ O2 ਦੀ ਪ੍ਰਕਿਰਿਆ
N2(g) + O2(g) + ਤਾਪ → 2NO(g)
ਪ੍ਰਸ਼ਨ 8.
ਅਪਘਟਨ ਪ੍ਰਤੀਕਿਰਿਆ ਸੰਯੋਜਨ ਕਿਰਿਆ ਤੋਂ ਕਿਸ ਤਰ੍ਹਾਂ ਵੱਖ ਹੈ ?
ਉੱਤਰ-
ਸੰਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਪਦਾਰਥ ਮਿਲ ਕੇ ਇਕ ਨਵਾਂ ਪਦਾਰਥ ਬਣਾਉਂਦੇ ਹਨ ਜਦੋਂ ਕਿ ਅਪਘਟਨ ਪ੍ਰਤੀਕਿਰਿਆ ਇਸ ਤੋਂ ਉਲਟ ਹੈ । ਅਪਘਟਨ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਏਕਲ ਪਦਾਰਥ ਅਪਘਟਿਤ ਹੋ ਕੇ ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਪਦਾਰਥ ਪ੍ਰਦਾਨ ਕਰਦਾ ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 9.
ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ਦੀ ਪਰਿਭਾਸ਼ਾ ਅਤੇ ਉਦਾਹਰਨ ਦਿਉ ।
ਉੱਤਰ-
ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ-ਜਦੋਂ ਕੋਈ ਤੱਤ ਦੂਸਰੇ ਤੱਤਾਂ ਨੂੰ ਉਸਦੇ ਯੌਗਿਕਾਂ ਨਾਲ ਵਿਸਥਾਪਿਤ ਕਰ ਦਿੰਦਾ ਹੈ, ਤਾਂ ਇਹ ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ਹੁੰਦੀ ਹੈ ।

ਉਪਰੋਕਤ ਉਦਾਹਰਨ ਵਿੱਚ Zn ਕਾਪਰ ਤੋਂ ਵੱਧ ਕਿਰਿਆਸ਼ੀਲ ਹੈ, ਇਸ ਲਈ ਇਹ ਕਾਪਰ ਸਲਫੇਟ ਵਿਚੋਂ ਕਾਪਰ ਦਾ ਵਿਸਥਾਪਨ ਕਰਕੇ ਖ਼ੁਦ ਸਲਫੇਟ ਦੇ ਨਾਲ ਜ਼ਿੰਕ ਸਲਫੇਟ ਬਣਾਉਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 10.
ਦੂਹਰੀ ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ਦੀ ਪਰਿਭਾਸ਼ਾ ਅਤੇ ਉਦਾਹਰਨ ਦਿਓ ।
ਉੱਤਰ-
ਦੂਹਰੀ ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ – ਅਜਿਹੀ ਪ੍ਰਤੀਕਿਰਿਆ ਜਿਨ੍ਹਾਂ ਵਿੱਚ ਤੀਕਾਰਕਾਂ ਦੇ ਵਿੱਚ ਆਇਨਾਂ ਦਾ ਆਦਾਨ-ਪ੍ਰਦਾਨ ਹੁੰਦਾ ਹੈ ਉਨ੍ਹਾਂ ਨੂੰ ਦੂਹਰੀ ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ਕਹਿੰਦੇ ਹਨ ।
ਉਦਾਹਰਨ-

ਉਪਰੋਕਤ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ Cl– ਅਤੇ \(\mathrm{SO}_{4}^{2-}\) ਆਇਨਾਂ ਦਾ ਆਦਾਨ ਪ੍ਰਦਾਨ ਹੋ ਰਿਹਾ ਹੈ ਇਸ ਲਈ ਦੂਹਰੀਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ਦੀ ਉਦਾਹਰਨ ਹੈ ।
ਪ੍ਰਸ਼ਨ 11.

ਉਪਰੋਕਤ ਪ੍ਰਤੀਕਿਰਿਆ ਨੂੰ ਪੂਰਾ ਕਰੋ ਅਤੇ ਉਤਪਾਦ ਦਾ ਰੰਗ ਵੀ ਦੱਸੋ ।
ਉੱਤਰ-
ਉਪਰੋਕਤ ਪ੍ਰਤੀਕਿਰਿਆ ਹੈ-
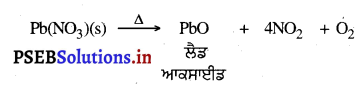
ਇਹ ਉਤਪਾਦ PbO ਪੀਲੇ ਰੰਗ ਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 12.
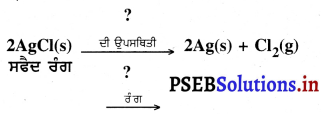
ਜੰਗ ਲੱਗਣਾ ਕਿਸ ਨੂੰ ਕਹਿੰਦੇ ਹਨ ਜੰਗ ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ ਲਿਖੋ । ਇਸ ਨਾਲ ਹੋਣ ਵਾਲੀ ਹਾਨੀ ਕੀ ਹੈ ?
ਉੱਤਰ-
ਲੋਹੇ ਦੀਆਂ ਬਣੀਆਂ ਨਵੀਆਂ ਵਸਤੂਆਂ ਚਮਕੀਲੀਆਂ ਹੁੰਦੀਆਂ ਹਨ, ਪਰ ਕੁੱਝ ਸਮੇਂ ਬਾਅਦ ਉਨ੍ਹਾਂ ਤੇ ਲਾਲਿਮਾ ਯੁਕਤ ਭੂਰੇ ਰੰਗ ਦੀ ਪਰਤ ਚੜ੍ਹ ਜਾਂਦੀ ਹੈ । ਆਮ ਤੌਰ ‘ਤੇ ਇਸ ਪ੍ਰਕਿਰਿਆ ਨੂੰ ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣਾ ਕਹਿੰਦੇ ਹਨ ।
ਜੰਗ ਦਾ ਰਸਾਇਣਿਕ ਸੁਤਰ ਹੈ ।
Fe2O3. x H2O
ਜੰਗ ਹਾਈਡਰੇਟ ਆਇਰਨ (III) ਆਕਸਾਈਡ ਹੈ ।
ਇਹ ਭੁਰਭੁਰਾ ਹੁੰਦਾ ਹੈ ਸਮੇਂ ਦੇ ਨਾਲ ਧਾਤੁ ਦੀ ਸਤਹਿ ਤੋਂ ਵੱਖ ਹੋ ਜਾਂਦਾ ਹੈ, ਜਿਸ ਕਾਰਨ ਲੋਹੇ ਤੋਂ ਬਣੀਆਂ ਵਸਤੂਆਂ ਖ਼ਰਾਬ ਹੁੰਦੀਆਂ ਰਹਿੰਦੀਆਂ ਹਨ ।
ਪ੍ਰਸ਼ਨ 13.
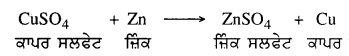
ਕੀ ਹੁੰਦਾ ਹੈ ਜਦੋਂ ਜ਼ਿੰਕ ਦੀ ਛੜ ਕਾਪਰ ਸਲਫੇਟ ਦੇ ਘੋਲ ਵਿੱਚ ਰੱਖੀ ਜਾਂਦੀ ਹੈ ? ਪ੍ਰਤੀਕਿਰਿਆ ਦਾ ਰਸਾਇਣਿਕ ਸਮੀਕਰਨ ਦੱਸੋ ।
ਉੱਤਰ-
ਜ਼ਿੰਕ ਕਾਪਰ ਤੋਂ ਵੱਧ ਕਿਰਿਆਸ਼ੀਲ ਹੈ । ਇਹ ਕਾਪਰ ਸਲਫੇਟ ਘੋਲ ਵਿਚੋਂ ਕਾਪਰ ਨੂੰ ਵਿਸਥਾਪਤ ਕਰ ਦਿੰਦਾ ਹੈ ਅਤੇ ਜ਼ਿੰਕ ਸਲਫੇਟ ਬਣਦਾ ਹੈ । ਕਾਪਰ ਸਲਫੇਟ ਦਾ ਨੀਲਾ ਘੋਲ ਹੌਲੀ-ਹੌਲੀ ਸਫ਼ੇਦ ਹੋ ਜਾਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 14.
ਚੂਨਾ ਬੁੱਝਣਾ (ਸ਼ਮਨ) ਤੋਂ ਕੀ ਭਾਵ ਹੈ ? ਇਸ ਪ੍ਰਕਿਰਿਆ ਵਿੱਚ ਸੁੰ-ਸੂ ਦੀ ਆਵਾਜ਼ ਕਿਉਂ ਹੁੰਦੀ ਹੈ ? ਸੰਬੰਧਿਤ ਪ੍ਰਤੀਕਿਰਿਆ ਨੂੰ ਪ੍ਰਦਰਸ਼ਿਤ ਕਰਨ ਵਾਲੀ ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਲਿਖੋ ।
ਉੱਤਰ-
ਸ਼ਮਨ – ਜਦੋਂ ਚਨੇ ਨੂੰ ਪਾਣੀ ਵਿੱਚ ਮਿਲਾਇਆ ਜਾਂਦਾ ਹੈ, ਇਹ ਬੜੇ ਚਨੇ ਵਿੱਚ ਬਦਲ ਜਾਂਦਾ ਹੈ । ਇਸ ਨੂੰ ਚੂਨਾ ਬੁੱਝਣਾ ਕਹਿੰਦੇ ਹਨ । ਇਹ ਇਕ ਤਾਪ ਨਿਕਾਸੀ ਕਿਰਿਆ ਹੈ, ਜਿਸ ਵਿੱਚ ਤਾਪ ਉਰਜਾ ਬਾਹਰ ਨਿਕਲਦੀ ਹੈ, ਜਿਸ ਕਾਰਨ ਸੂੰ-ਦੀ ਆਵਾਜ਼ ਪੈਦਾ ਹੁੰਦੀ ਹੈ ।

ਪ੍ਰਸ਼ਨ 15.
ਹੇਠਾਂ ਲਿਖੀਆਂ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣਾਂ ਨੂੰ ਸੰਤੁਲਿਤ ਕਰੋ ।
1. H2 + N2 → NH3
2. BaCl2 + Al2(SO4)3 → AlCl3 + BaSO4
3. H2S + O2 → SO2 + H2O
4. KBr + BaI2 → KI + BaBr2
5. Al + CuCl2 → AlCl3 + Cu
6. AgNO3 + Cu → Cu(NO3)2 + Ag
7. Al(OH)3 → Al2O3 + H2O
8. NH3 + CuO → Cu + N2 + H2O
9. KClO3 → KCl + O2
10. KNO3 → KNO2 + O2
11. BaCl2 + K2SO4 → 2BaSO4 + KCl.
ਉੱਤਰ-
1. 3H2 + N2 → 2NH3
2. 3BaCl2 + Al2(SO4)3 ) → 2AlCl3 + 3BaSO4
3. 2H2S + 3O2 → 2SO2 + 2H2O
4. 2KBr + BaI2 → 2KI + BaBr2
5. 2Al + 3CuCl2 → 2AlCl3 + 3Cu
6. 2AgNO3 + Cu → Cu(NO3)2 + 2Ag
7. 2Al(OH)3 → Al2O3 + 3H2O
8. 2NH3 + 3CuO → Cu + N2 + 3H2O
9. 2KClO3 → 2KCl + 3O2
10. 2KNO3 → 2KNO3 + O2
11. BaCl2 + K2SO4 → BaSO4 + 2KCl.
![]()
ਪ੍ਰਸ਼ਨ 16.
ਹੇਠ ਲਿਖੇ ਸਮੀਕਰਣਾਂ ਵਿੱਚ ਆਕਸੀਕਰਨ ਅਤੇ ਲਘੂਕਰਣ ਪਦਾਰਥਾਂ ਦੇ ਨਾਮ ਲਿਖੋ ।
1. SO2 + 2H2S → 2H2O + 3S
2. 2Al + 3HCl → 2ACl3 + 3H2
3. 2H2S + SO2 → 3S + 2H2O
4. Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
5. H2 + CuO → Cu + H2O.
ਉੱਤਰ-
1. SO2 ਵਿੱਚ S ਦਾ ਲਘੂਕਰਣ ਅਤੇ H2S ਵਿੱਚ S ਦਾ ਆਕਸੀਕਰਨ ਹੋਇਆ ।
2. ਐਲੂਮੀਨੀਅਮ ਦਾ ਆਕਸੀਕਰਨ ਅਤੇ ਕਲੋਰੀਨ ਦਾ ਆਕਸੀਕਰਨ ਹੋਇਆ ।
3. ਹਾਈਡਰੋਜਨ ਦਾ ਆਕਸੀਕਰਨ ਅਤੇ ਸਲਫਰ ਦਾ ਲਘੂਕਰਣ ਹੋਇਆ ।
4. ਜ਼ਿੰਕ ਦਾ ਆਕਸੀਕਰਨ ਅਤੇ ਸਿਲਵਰ ਦਾ ਲਘੂਕਰਣ ਹੋਇਆ ।
5. ਹਾਈਡਰੋਜਨ ਦਾ ਆਕਸੀਕਰਨ ਅਤੇ ਤਾਂਬੇ ਦਾ ਲਘੂਕਰਣ ਹੋਇਆ ।
ਪ੍ਰਸ਼ਨ 17.
ਹੇਠ ਲਿਖੀਆਂ ਕਿਰਿਆਵਾਂ ਲਈ ਸੰਕੇਤਾਂ ਅਤੇ ਸੂਤਰਾਂ ਨਾਲ ਸੰਤੁਲਿਤ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣਾਂ ਲਿਖੋ ।
(i) ਜ਼ਿੰਕ + ਸਿਲਵਰ ਨਾਈਟਰੇਟ → ਜ਼ਿੰਕ ਨਾਈਟਰੇਟ + ਸਿਲਵਰ
(ii) ਕਾਪਰ ਆਕਸਾਈਡ + ਹਾਈਡਰੋਜਨ → ਕਾਪਰ + ਪਾਣੀ
(iii) ਬੇਰੀਅਮ ਕੋਲਰਾਈਡ + ਐਲੂਮੀਨੀਅਮ ਸਲਫੇਟ → ਬੇਰੀਅਮ ਸਲਫੇਟ + ਐਲੂਮੀਨੀਅਮ ਕਲੋਰਾਈਡ ।
ਉੱਤਰ-
(i) Zn (s) + 2AgNO3 (aq) → Zn (NO3)2 (aq) +2Ag(s)
(ii) CuO(s) + H2(g) → Cu(s) + H2O(l)
(iii) 3BaCl2 (ag) + Al2(SO4)3(aq) → 3BaSO4(aq) + 2AlCl3(aq).
ਪ੍ਰਸ਼ਨ 18.
ਹੇਠ ਲਿਖੀਆਂ ਸਮੀਕਰਣਾਂ ਨੂੰ ਪੂਰਾ ਲਿਖੋ :
(i) ਕੈਲਸ਼ੀਅਮ ਹਾਈਡਰਾਕਸਾਈਡ + ਕਾਰਬਨ ਡਾਈਆਕਸਾਈਡ → ………… + ………….
(ii) ਸੋਡੀਅਮ + ਪਾਣੀ → ………… +………….
(iii) ਹਾਈਡਰੋਜਨ + ਕਲੋਰੀਨ → ……….. + ………….
ਉੱਤਰ-
(i) ਕੈਲਸ਼ੀਅਮ ਹਾਈਡਰਾਕਸਾਈਡ + ਕਾਰਬਨ ਡਾਈਆਕਸਾਈਡ → ਕੈਲਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ + ਪਾਣੀ
(ii) ਸੋਡੀਅਮ + ਪਾਣੀ → ਸੋਡੀਅਮ ਹਾਈਡਰਾਕਸਾਈਡ + ਹਾਈਡਰੋਜਨ ਗੈਸ
(iii) ਹਾਈਡਰੋਜਨ + ਕਲੋਰੀਨ → ਹਾਈਡਰੋਜਨ ਕਲੋਰਾਈਡ ਗੈਸ ।
ਪ੍ਰਸ਼ਨ 19.
ਸੂਤਰਾਂ ਦੀ ਸਹਾਇਤਾ ਨਾਲ ਹੇਠ ਲਿਖੇ ਕਥਨਾਂ ਨੂੰ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣਾਂ ਦੇ ਰੂਪ ਵਿੱਚ ਲਿਖ ਕੇ ਸੰਤੁਲਿਤ ਕਰੋ :
(i) ਪੋਟਾਸ਼ੀਅਮ ਤੱਤ, ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਪੋਟਾਸ਼ੀਅਮ ਹਾਈਡਰਾਕਸਾਈਡ ਅਤੇ ਹਾਈਡਰੋਜਨ ਗੈਸ ਪੈਦਾ ਕਰਦਾ ਹੈ ।
(ii) ਹਾਈਡਰੋਜਨ ਸਲਫਾਈਡ ਗੈਸ ਹਵਾ/ਆਕਸੀਜਨ ਵਿੱਚ ਬਲਦੇ ਪਾਣੀ ਅਤੇ ਸਲਫਰ ਡਾਈਆਕਸਾਈਡ ਗੈਸ ਬਣਾਉਂਦੀ ਹੈ ?
(iii) ਹਾਈਡਰੋਜਨ ਗੈਸ ਨਾਈਟਰੋਜਨ ਨਾਲ ਜੁੜ ਕੇ ਅਮੋਨੀਆ ਬਣਾਉਂਦੀ ਹੈ ?
ਉੱਤਰ-
(i) 2K + 2H2O → 2KOH + H2
(ii) 2H2S + 3O2 → 2H2O + 2SO2
(iii) 3H2 + N2 → 2NH3.
ਪ੍ਰਸ਼ਨ 20.
ਹੇਠਾਂ ਦਿੱਤੇ ਫਲਾਸਕ ਵਿੱਚ ਵਾਪਰ ਰਹੀ ਪ੍ਰਤੀਕਿਰਿਆ ਦਾ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਲਿਖੋ ਪੈਦਾ ਹੁੰਦੀ ਗੈਸ ਦਾ ਨਾਂ ਅਤੇ ਇੱਕ ਗੁਣ ਲਿਖੋ ।
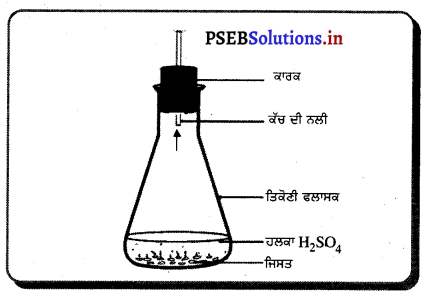
ਉੱਤਰ-
ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ-
Zn + H2SO4 → ZnSO4 + H2
ਜਿਸਤ + ਹਲਕਾ ਸਲਫਿਊਰਿਕ ਐਸਿਡ → ਜਿਸਤ ਸਲਫੇਟ + ਹਾਈਡਰੋਜਨ ਗੈਸ
ਇਸ ਪ੍ਰਕਿਰਿਆ ਵਿੱਚ ਪੈਦਾ ਹੋ ਰਹੀ ਗੈਸ ਦਾ ਨਾਂ ਹਾਈਡਰੋਜਨ ਹੈ ।
ਹਾਈਡਰੋਜਨ ਗੈਸ ਦਾ ਗੁਣ – ਹਾਈਡਰੋਜਨ ਇੱਕ ਜਲਣਸ਼ੀਲ ਗੈਸ ਹੈ ਜੋ ਨੀਲੀ-ਪੀਲੀ ਲੌ ਨਾਲ ਧਮਾਕੇ ਨਾਲ ਬਲਦੀ ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 21.
ਸਾਹਮਣੇ ਦਿੱਤੇ ਚਿੱਤਰ ਵਿੱਚ ਪਰਖ-ਨਲੀ ਵਿੱਚ ਕਿਰਿਆ ਦੌਰਾਨ ਕਿਹੜੀ ਗੈਸ ਪੈਦਾ ਹੋ ਰਹੀ ਹੈ ? ਇਹ ਗੈਸ ਚੂਨੇ ਦੇ ਪਾਣੀ/ਕੈਲਸ਼ੀਅਮ ਹਾਈਡਰਾਕਸਾਈਡ ਨਾਲ ਕਿਸ ਤਰ੍ਹਾਂ ਕਿਰਿਆ ਕਰਦੀ/ਪ੍ਰਭਾਵ ਪਾਂਦੀ ਹੈ ?
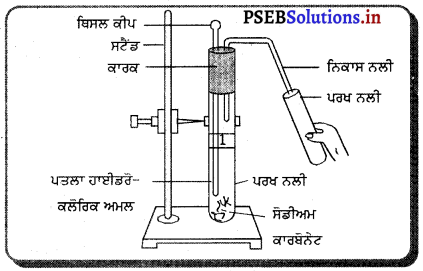
ਉੱਤਰ-
(1) ਸੋਡੀਅਮ ਕਾਰਬੋਨੇਟ ਅਤੇ ਪਤਲਾ ਹਾਈਡਰੋਕਲੋਰਿਕ ਅਮਲ ਦੀ ਕਿਰਿਆ ਦੌਰਾਨ ਕਾਰਬਨ ਡਾਈਆਕਸਾਈਡ ਗੈਸ ਪੈਦਾ ਹੁੰਦੀ ਹੈ ।
(2) ਕਾਰਬਨ ਡਾਈਆਕਸਾਈਡ ਗੈਸ ਚਨੇ ਦੇ ਪਾਣੀ (ਕੈਲਸ਼ੀਅਮ ਹਾਈਡਰਾਕਸਾਈਡ) ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਸਫ਼ੈਦ ਰੰਗ ਦਾ ਕੈਲਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ ਬਣਾਉਂਦੀ ਹੈ ਜਿਸ ਤੋਂ ਚੂਨੇ ਦੇ ਪਾਣੀ ਦਾ ਰੰਗ ਦੁੱਧੀਆ ਹੋ ਜਾਂਦਾ ਹੈ ।

ਪ੍ਰਸ਼ਨ 22.
ਸਾਹਮਣੇ ਦਿੱਤੇ ਚਿੱਤਰ ਵਿੱਚ ਦਰਸਾਏ ਪਰਖ ਨਲੀ ਵਿੱਚ ਹੋ ਰਹੇ ਘੋਲਾਂ/ਰਸਾਇਣਾਂ ਦੀ ਕਿਰਿਆ ਨੂੰ ਸਮੀਕਰਣ ਦੇ ਰੂਪ ਵਿੱਚ ਲਿਖੋ ਘੋਲ ਦੇ ਰੰਗ ਵਿੱਚ ਕਿਸ ਤਰ੍ਹਾਂ ਪਰਿਵਰਤਨ ਆਉਂਦਾ ਹੈ ? ਮੇਖਾਂ/ਕਿੱਲਾਂ ਦੇ ਰੰਗ ਵਿੱਚ ਕੀ ਪਰਿਵਰਤਨ ਆਉਂਦਾ ਹੈ ?
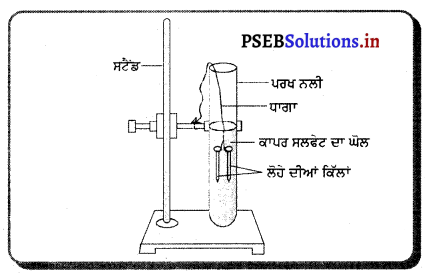
ਉੱਤਰ-
ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਦੀ ਸਮੀਕਰਣ :
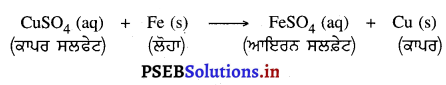
ਜਦੋਂ ਲੋਹੇ ਦੀਆਂ ਕਿੱਲਾਂ ਨੂੰ ਕਾਪਰ ਸਲਫੇਟ ਦੇ ਘੋਲ ਵਿੱਚ ਡੁਬੋਇਆ ਜਾਂਦਾ ਹੈ ਤਾਂ ਨੀਲੇ ਰੰਗ ਦਾ ਘੋਲ ਹੌਲੀ-ਹੌਲੀ ਫਿੱਕਾ ਹੋ ਜਾਂਦਾ ਹੈ ਅਤੇ ਕਿੱਲਾਂ ਦਾ ਰੰਗ ਭੂਰਾ ਹੋ ਜਾਂਦਾ ਹੈ ।
ਬਹੁਤ ਛੋਟੇ ਉੱਤਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ (Very Short Answer Type Questions)
ਪ੍ਰਸ਼ਨ 1.
ਬੁਝੇ ਹੋਏ ਚੂਨੇ ਦੀ ਇਕ ਵਰਤੋ ਲਿਖੋ ।
ਉੱਤਰ-
ਦੀਵਾਰਾਂ ਤੇ ਸਫ਼ੈਦੀ ਕਰਨ ਲਈ ।
ਪ੍ਰਸ਼ਨ 2.
ਸੰਗਮਰਮਰ ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ ਲਿਖੋ ।
ਉੱਤਰ-
CaCO3.
ਪ੍ਰਸ਼ਨ 3.
ਕੁਦਰਤੀ ਗੈਸ ਦਾ ਦਹਿਣ ਕਰਨ ‘ ਤੇ ਕੀ ਪ੍ਰਾਪਤ ਹੁੰਦਾ ਹੈ ?
ਉੱਤਰ-
CO2, H2O ਅਤੇ ਉਰਜਾ ।
![]()
ਪ੍ਰਸ਼ਨ 4.
ਫੋਰਸ ਸਲਫੇਟ ਦਾ ਸੂਤਰ ਲਿਖੋ ।
ਉੱਤਰ-
FeSO4, 7H2O.
ਪ੍ਰਸ਼ਨ 5.
ਚਿਪਸ ਬਣਾਉਣ ਵਾਲੇ ਚਿਪਸ ਦੀ ਥੈਲੀ ਵਿੱਚ ਕੀ ਭਰ ਦਿੰਦੇ ਹਨ ਤਾਂਕਿ ਉਸ ਵਿੱਚ ਆਕਸੀਕਰਨ ਨਾ ਹੋ ਸਕੇ ?
ਉੱਤਰ-
ਨਾਈਟਰੋਜਨ ਗੈਸ ।
ਪ੍ਰਸ਼ਨ 6.
ਆਕਸੀਕਰਨ-ਲਘੂਕਰਣ ਪ੍ਰਤੀਕਿਰਿਆ ਦਾ ਦੂਸਰਾ ਨਾਂ ਕੀ ਹੈ ?
ਉੱਤਰ-
ਰੇਡਾਕਸ ਪ੍ਰਤੀਕਿਰਿਆ ।
ਪ੍ਰਸ਼ਨ 7.
ਕਿਸੀ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਪਦਾਰਥ ਦਾ ਆਕਸੀਕਰਨ ਕਦੋਂ ਹੁੰਦਾ ਹੈ ?
ਉੱਤਰ-
ਜਦੋਂ O2 ਦੀ ਹਾਨੀ ਅਤੇ H2 ਦਾ ਵਾਧਾ ਹੋਵੇ ।
ਪ੍ਰਸ਼ਨ 8.
ਤਾਪ ਦੇਣ ਤੇ ਕੈਲਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ ਕਿਸ ਵਿੱਚ ਟੁੱਟ ਜਾਂਦਾ ਹੈ ?
ਉੱਤਰ-
ਕੈਲਸ਼ੀਅਮ ਆਕਸਾਈਡ ਅਤੇ ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ।
ਪ੍ਰਸ਼ਨ 9.
ਬੁਝੇ ਹੋਏ ਚੂਨੇ ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ ਲਿਖੋ ।
ਉੱਤਰ-
CaO.
![]()
ਪ੍ਰਸ਼ਨ 10.
ਕੁਦਰਤੀ ਗੈਸ ਦਾ ਦਹਿਣ ਹੋਣ ‘ਤੇ ਹੋਣ ਵਾਲੀ ਪ੍ਰਤੀਕਿਰਿਆ ਲਿਖੋ ।
ਉੱਤਰ-
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) + ਉਰਜਾ ।
ਪ੍ਰਸ਼ਨ 11.
ਕੋਇਲੇ ਦੇ ਦਹਿਣ ਅਤੇ H2 ਅਤੇ O2 ਤੋਂ ਪਾਣੀ ਦਾ ਨਿਰਮਾਣ ਕਿਸ ਪ੍ਰਤੀਕਿਰਿਆ ਨੂੰ ਦਰਸਾਉਂਦਾ ਹੈ ?
ਉੱਤਰ-
ਸੰਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ ।
ਪ੍ਰਸ਼ਨ 12.
![]()
ਉਪਰੋਕਤ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ A ਕੀ ਹੈ ?
ਉੱਤਰ-
ਕਲੋਰੋਫਿਲ ।
ਪ੍ਰਸ਼ਨ 13.
ਕਰਣ ਕਿਰਿਆ ਕੀ ਹੈ ?
ਉੱਤਰ-
ਉੱਤਰ-
ਲਘੂਕਰਣ ਇਕ ਅਜਿਹੀ ਕਿਰਿਆ ਹੈ, ਜਿਸ ਵਿੱਚ O2 ਦੀ ਹਾਨੀ ਅਤੇ H2 ਨ ਦਾ ਵਾਧਾ ਹੁੰਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 14.
ਆਕਸੀਕਰਣ ਕਿਰਿਆ ਕੀ ਹੈ ?
ਆਕਸੀਕਰਣ ਉਹ ਕਿਰਿਆ ਹੈ, ਜਿਸ ਵਿੱਚ H2 ਦੀ ਹਾਨੀ ਅਤੇ O2 ਦਾ ਵਾਧਾ ਹੁੰਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 15.
ਮੈਗਨੀਸ਼ੀਅਮ ਰਿੱਬਨ ਨੂੰ ਹਵਾ ਵਿੱਚ ਜਲਾਉਣ ਨਾਲ ਕਿਹੜਾ ਪਦਾਰਥ ਬਣਦਾ ਹੈ ? (ਮਾਂਡਲ ਪੇਪਰ)
ਉੱਤਰ-
ਚਿੱਟਾ ਪਾਊਡਰ ਮੈਗਨੀਸ਼ੀਅਮ ਆਕਸਾਈਡ (MgO) ।
![]()
ਪ੍ਰਸ਼ਨ 16.
ਹੇਠ ਲਿਖੇ ਸਮੀਕਰਣ ਵਿੱਚ ਖ਼ਾਲੀ ਥਾਵਾਂ ਭਰੋ । (ਮਾਡਲ ਪੇਪਰ)
ਉੱਤਰ-

ਪ੍ਰਸ਼ਨ 17.
ਜ਼ਿੰਕ ਦੀ ਪਤਲੇ ਸਲਫਿਊਰਿਕ ਐਸਿਡ ਨਾਲ ਕਿਰਿਆ ਹੋਣ ਤੇ ਕਿਹੜੀ ਗੈਸ ਬਣਦੀ ਹੈ ?
ਉੱਤਰ-
ਹਾਈਡਰੋਜਨ ਗੈਸ (H2).
ਪ੍ਰਸ਼ਨ 18.
ਹੇਠ ਲਿਖੇ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਵਿੱਚ ਖਾਲੀ ਥਾਂਵਾਂ ਭਰੋ :
BaCl2 + Na2SO4 → ………………. +…………..
ਉੱਤਰ-
BaCl2 + Na2SO4 → BaSO4 + 2NaCl.
ਪ੍ਰਸ਼ਨ 19.
ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਗੈਸ ਚੂਨੇ ਦੇ ਪਾਣੀ ਵਿਚੋਂ ਲੰਘਾਉਣ ਨਾਲ ਚੂਨੇ ਦੇ ਪਾਣੀ ਵਿੱਚ ਕੀ ਪਰਿਵਰਤਨ ਆਉਂਦਾ ਹੈ ?
ਉੱਤਰ-
ਚੂਨੇ ਦਾ ਪਾਣੀ ਦੁਧੀਆ ਹੋ ਜਾਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 20.
ਹੇਠ ਲਿਖੇ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਨੂੰ ਪੂਰਾ ਕਰੋ :
Fe(s) + CuSO4(aq) → ……… + ……………….
ਉੱਤਰ-
Fe + CuSO4 → FeSO4(aq) + Cu(s).
ਪ੍ਰਸ਼ਨ 21.
ਹੇਠ ਲਿਖੇ ਸਮੀਕਰਣ ਨੂੰ ਪੂਰਾ ਕਰੋ :
![]()
ਉੱਤਰ-
![]()
![]()
ਪ੍ਰਸ਼ਨ 22.
Zn(s) + CusO4(aq) → ZnSO4(aq) + Cu(s)
ਉਪਰੋਕਤ ਸਮੀਕਰਣ ਵਿੱਚ ਕਿਸ ਪ੍ਰਕਾਰ ਦੀ ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਦਰਸਾਈ ਗਈ ਹੈ ?
(ਉ) ਸੰਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ ।
(ਅ) ਵਿਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ
(ੲ) ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ
(ਸ) ਦੋਹਰਾ ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ।
ਉੱਤਰ-
(ੲ) ਵਿਸਥਾਪਨ ਪ੍ਰਤੀਕਿਰਿਆ ।
ਪ੍ਰਸ਼ਨ- 23.
Na2SO4(aq) + BaCl2(aq) → BaSO4(s) + NaCl(aq)
ਉਪਰੋਕਤ ਰਸਾਇਣਿਕ ਸਮੀਕਰਣ ਕਿਸ ਤਰ੍ਹਾਂ ਦੀ ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਦਾ ਉਦਾਹਰਣ ਹੈ ?
(ਉ) ਸੰਯੋਜਨ ਕਿਰਿਆ ।
(ਅ) ਅਪਘਟਨ ਕਿਰਿਆ
(ੲ) ਵਿਸਥਾਪਨ ਕਿਰਿਆ
(ਸ) ਦੂਹਰਾ ਵਿਸਥਾਪਨ ਕਿਰਿਆ ।
ਉੱਤਰ-
(ਸ) ਦੂਹਰਾ ਵਿਸਥਾਪਨ ਕਿਰਿਆ ।
ਵਸਤੁਨਿਸ਼ਠ ਪ੍ਰਸ਼ਨ (Objective Type Questions)
ਪ੍ਰਸ਼ਨ 1.
BaCl2(aq) + Na2SO4(aq) → Basq1(s) + 2NaClaq) ਹੈ ।
(a) ਵਿਸਥਾਪਨ ਕਿਰਿਆ
(b) ਦੁਹਰੀ ਵਿਸਥਾਪਨ ਕਿਰਿਆ
(c) ਸੰਯੋਜਨ ਕਿਰਿਆ
(d) ਅਪਘਟਨ ਕਿਰਿਆ ।
ਉੱਤਰ-
(b) ਦੁਹਰੀ ਵਿਸਥਾਪਨ ਕਿਰਿਆ ।
ਪ੍ਰਸ਼ਨ 2.
ਉਹ ਕਿਰਿਆ ਜਿਸ ਵਿੱਚ ਤਾਪ ਦਾ ਵੀ ਉਤਸਰਜਨ ਹੁੰਦਾ ਹੈ, ਕਹਾਉਂਦੀ ਹੈ-
(a) ਬਹੁਲੀਕਰਨ ਕਿਰਿਆ
(b) ਤਾਪਸੋਖੀ ਕਿਰਿਆ
(c) ਤਾਪ-ਨਿਕਾਸੀ ਕਿਰਿਆ
(d) ਉਪਰੋਕਤ ਸਾਰੇ ।
ਉੱਤਰ-
(c) ਤਾਪ-ਨਿਕਾਸੀ ਕਿਰਿਆ ।
ਪ੍ਰਸ਼ਨ 3.
ਜਲ ਦੇ ਬਿਜਲਈ ਅਪਘਟਨ ਨਾਲ ਉਤਪੰਨ ਹਾਈਡਰੋਜਨ ਅਤੇ ਆਕਸੀਜਨ ਦਾ ਮੋਲ ਅਨੁਪਾਤ ਹੈ-
(a) 2 : 1
(b) 1 : 1
(c) 2 : 2
(d) 4 : 1.
ਉੱਤਰ-
(a) 2 : 1.
ਪ੍ਰਸ਼ਨ 4.
ਜੰਗ ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ ਹੈ-
(a) Fe2O3
(b) FeCO3
(c) Fe2O3.xH2O
(d) FeCO3. xH2O.
ਉੱਤਰ-
(c) Fe2O3.xH2O
![]()
ਪ੍ਰਸ਼ਨ 5.
ਅਪਘਟਨ ਕਿਰਿਆ ਦੀ ਉਦਾਹਰਨ ਹੈ-
(a) CH4 + 2O2 → CO2 +2H2O
(b) Pb(NO3)2 → 2PbO + 4NO2 + O2
(c) NH3 + HCl → NH4Cl
(d) Pb + CuCl2 → PbCl2 + Cu.
ਉੱਤਰ-
(b) Pb(NO3)2 → 2PbO + 4NO2 + O2
ਪ੍ਰਸ਼ਨ 6.
ਲੋਹਾ ਹੇਠ ਲਿਖੀ ਕਿਹੜੀ ਧਾਤ ਨੂੰ ਉਸਦੇ ਘੋਲ ਤੋਂ ਵਿਸਥਾਪਿਤ ਕਰ ਸਕਦਾ ਹੈ ?
(a) Al
(b) Zn
(c) Cu
(d) Au.
ਉੱਤਰ-
(c) Cu.
ਪ੍ਰਸ਼ਨ 7.
ਹੇਠ ਲਿਖਿਆਂ ਵਿਚੋਂ ਕਿਹੜੀ ਅਧਾਤ ਹੈ ਜਿਹੜੀ ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਲੜੀ ਵਿੱਚ ਮੌਜੂਦ ਰਹਿੰਦੀ ਹੈ ?
(a) ਆਕਸੀਜਨ
(b) ਕਲੋਰੀਨ
(c) ਬੋਮੀਨ
(d) ਹਾਈਡਰੋਜਨ ।
ਉੱਤਰ-
(d) ਹਾਈਡਰੋਜਨ ।
ਖ਼ਾਲੀ ਥਾਂਵਾਂ ਭਰਨਾ
ਪ੍ਰਸ਼ਨ-ਹੇਠ ਲਿਖੀਆਂ ਖ਼ਾਲੀ ਥਾਂਵਾਂ ਭਰੋ :
(i) ਅਪਘਟਨ ਪ੍ਰਤੀਕਿਰਿਆ ……………….. ਦੀ ਵਿਪਰੀਤ ਪ੍ਰਤੀਕਿਰਿਆ ਹੈ ।
ਉੱਤਰ-
ਸੰਯੋਜਨ ਪ੍ਰਤੀਕਿਰਿਆ
(ii) ਤੇਜ਼ਾਬ ਅਤੇ ਖਾਰ ਦੀ ਨਿਸ਼ਚਿਤ ਮਾਤਰਾ ਅਤੇ ਆਇਤਨ ਮਿਲਾਉਣ ਤੇ …………………… ਅਤੇ ………………. ਬਣਦਾ ਹੈ ।
ਉੱਤਰ-
ਲੂਣ, ਪਾਣੀ
![]()
(iii) ਆਕਸੀਜਨ ਦਾ ਸਮਾਵੇਸ਼ ……………………. ਕਹਾਉਂਦਾ ਹੈ ।
ਉੱਤਰ-
ਆਕਸੀਕਰਨ
(iv) ਉਹ ਪ੍ਰਤਿਕਿਰਿਆਂ ਜਿਸ ਵਿੱਚ ਉਸ਼ਮਾ ਦਾ ਉਤਸਰਜਨ ਹੁੰਦਾ ਹੈ, …………………… ਪ੍ਰਤੀਕਿਰਿਆ ਕਹਾਉਂਦੀ ਹੈ ।
ਉੱਤਰ-
ਤਾਪ-ਨਿਕਾਸੀ
(v) ਆਕਸੀਕਰਨ ਅਤੇ ਲਘੂਕਰਨ ਇਕ-ਦੂਜੇ ਦੀ ……………………… ਹਨ ।
ਉੱਤਰ-
ਪੂਰਕ ।
