Punjab State Board PSEB 9th Class Science Important Questions Chapter 3 परमाणु एवं अणु Important Questions and Answers.
PSEB 9th Class Science Important Questions Chapter 3 परमाणु एवं अणु
दीर्घ उत्तरात्मक प्रश्न (Long Answer Type Questions)
प्रश्न 1.
रासायनिक संयोजन के नियमों को स्पष्ट कीजिए।
उत्तर-
वैज्ञानिक आंतवाँ एल० लवाइजिए तथा जोसफ एल० पाउस्ट ने रासायनिक संयोजन के दो नियम प्रतिपादित किए थे।
I. द्रव्यमान संरक्षण या द्रव्य की अविनाशिता का नियम
रूस के वैज्ञानिक एम०वी० लोमोनोसोव (M.V. Lomonosov) ने 1756 ई० में ‘द्रव्यमान संरक्षण के नियम’ का प्रतिपादन किया। द्रव्यमान संरक्षण के नियम के अनुसार जब रासायनिक परिवर्तन पूरा होता है तो रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन होता है और न ही विनाश होता है। अतः किसी भी रासायनिक अभिक्रिया में परिवर्तन के उपरान्त भी पदार्थ का कुल द्रव्यमान उतना ही रहता है जितना अभिक्रिया से पूर्व था।
∴ अभिक्रिया से पूर्व अभिकारकों का कुल द्रव्यमान = अभिक्रिया के उपरांत उत्पादों का कुल द्रव्यमान इस नियम को निम्न प्रयोग द्वारा सिद्ध किया जा सकता है।
प्रयोग – एक फ्लास्क लो। इसमें अग्रलिखित X और Y रसायनों का युगल लो।
X – Y
(i) कॉपर सल्फेट – सोडियम कार्बोनेट
(ii) बेरियम क्लोराइड – सोडियम सल्फेट
(iii) लेड नाइट्रेट – सोडियम क्लोराइड
इनमें से ‘Y’ विलयन को एक शंक्वाकार फ्लास्क में तथा ‘X’ विलयन को एक क्वथन नली में लो। क्वथन नली को विलयन युक्त फ्लास्क में इस प्रकार लटकाओ कि दोनों विलयन आपस में न मिलें। फ्लास्क का मुंह कार्क से बंद कर दें। फ्लास्क में सभी वस्तुओं को ध्यानपूर्वक तोलो तथा फ्लास्क को इस प्रकार हिलाओ कि ‘X’ और ‘Y’ विलयन आपस में मिल जाए। रासायनिक क्रिया के बाद फ्लास्क को तोलो। द्रव्यमान अपरिवर्तित रहेगा जबकि अंतर्वस्तुओं में रासायनिक क्रिया से परिवर्तन होगा। इससे द्रव्यमान संरक्षण का नियम सिद्ध हो जाता है।
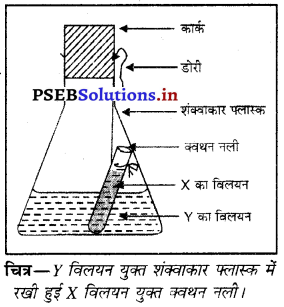
II. स्थिर अनुपात का नियम
रखी हुई x विलयन युक्त क्वथन नली। इस नियम को फ्रेंच वैज्ञानिक जे० एल० प्राउस्ट (J. L. Proust) ने 1799 ई० में प्रतिपादित किया। इस नियम के अनुसार,
प्रत्येक रासायनिक यौगिक में भले वह किसी भी विधि से बनाया या प्राप्त किया गया हो, तत्वों के द्रव्यमान एक निश्चित अनुपात में संयुक्त रहते हैं।
इस नियम से यह स्पष्ट है कि प्रत्येक यौगिक का रासायनिक संघटन निश्चित होता है, जो उसके बनाने की विधि या स्रोत (Source) पर निर्भर नहीं करता है।
उदाहरण 1.-जल (H2O) हाइड्रोजन एवं ऑक्सीजन का यौगिक है। जल को विभिन्न विधियों द्वारा बनाया जा सकता है और प्राकृतिक साधनों द्वारा भी प्राप्त किया जा सकता है। किसी भी प्रकार से प्राप्त जल का विश्लेषण करने पर ज्ञात होता है कि जल में हाइड्रोजन व ऑक्सीजन, भार की दृष्टि से 1 : 8 के अनुपात में संयुक्त है।
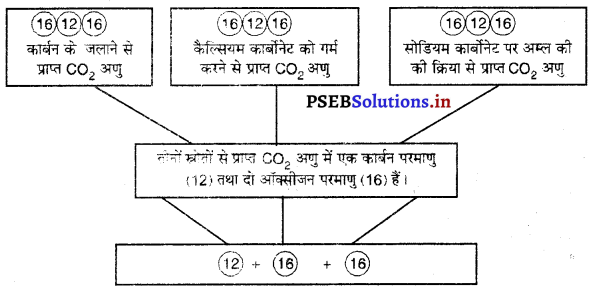
उदाहरण 2.-कार्बन डाइऑक्साइड (CO2) कार्बन तथा ऑक्सीजन का यौगिक है। इसे
(i) कार्बन को वायु में जलाकर,
(ii) कैल्सियम कार्बोनेट को गर्म करके अथवा
(iii) सोडियम कार्बोनेट पर तनु हाइड्रोक्लोरिक अम्ल की अभिक्रिया करके प्राप्त किया जा सकता है। तीनों विधियों से प्राप्त CO2 का विश्लेषण करने पर ज्ञात होता है कि इनमें कार्बन व ऑक्सीजन, द्रव्यमान की दृष्टि से 12 : 32 अर्थात् 3 : 8 के अनुपात में संयुक्त रहते हैं।
![]()
प्रश्न 2.
डाल्टन के परमाणु सिद्धांत की विवेचन कीजिए।
उत्तर-
डाल्टन के परमाणु सिद्धांत के अनुसार, सभी तत्व, यौगिक या मिश्रण सूक्ष्म कणों से बने होते हैं। इन सूक्ष्म कणों को परमाणु कहते हैं। डाल्टन के सिद्धांत की विवेचना इस प्रकार की जा सकती है-
- सभी द्रव्य परमाणुओं से निर्मित होते हैं।
- परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक अभिक्रिया में न तो बनाए जा सकते हैं न ही उनका विनाश होता है।
- दिए गए तत्व के सभी परमाणुओं का द्रव्यमान एवं रासायनिक गुणधर्म समान होते हैं।
- भिन्न-भिन्न तत्वों के परमाणुओं के द्रव्यमान एवं रासायनिक गुणधर्म भिन्न-भिन्न होते हैं।
- भिन्न-भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक बनाते हैं।
- किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या और किस्म निश्चित होते हैं।
प्रश्न 3.
परमाणु द्रव्यमान को परिभाषित कीजिए। ग्राम-परमाणु भार किसे कहते हैं ?
अथवा
परमाणु द्रव्यमान व्यक्त करने का आधुनिक पैमाना क्या है ? इस पैमाने पर आप किसी तत्व का औसत सापेक्ष परमाणु द्रव्यमान किस प्रकार व्यक्त कर सकते हैं ?
उत्तर-
परमाणु द्रव्यमान – किसी तत्व का छोटे-से-छोटा कण परमाणु कहलाता है और वह रासायनिक अभिक्रियाओं में भाग लेता है। परमाणु अत्यंत ही सूक्ष्म होता है और इसका वास्तविक द्रव्यमान ज्ञात करना कठिन है। तत्वों के परमाणु द्रव्यमान से उनका सापेक्ष द्रव्यमान ज्ञात होता है।
हाइड्रोजन का परमाणु सबसे हल्का होता है, इसलिए इसके परमाणु द्रव्यमान को इकाई मानकर अन्य तत्वों के सापेक्ष द्रव्यमान ज्ञात किए जाते हैं और इनको परमाणु द्रव्यमान कहा जाता है।
अतः किसी तत्व का परमाणु द्रव्यमान वह संख्या है जो यह प्रदर्शित करती है कि उस तत्व का एक परमाणु हाइड्रोजन के एक परमाणु से कितने गुना भारी है।

कुछ वैज्ञानिकों ने अपने प्रयोगों के आधार पर परमाणु द्रव्यमान की इकाई हाइड्रोजन के एक परमाणु के द्रव्यमान के स्थान पर ऑक्सीजन के परमाणु द्रव्यमान के सोलहवें भाग (1/16) को अधिक सही माना है।

अब परमाणु द्रव्यमान का ऑक्सीजन मानक भी मान्य नहीं रहा है; क्योंकि ऑक्सीजन का परमाणु द्रव्यमान इसके तीन समस्थानिकों (isotopes) का औसत द्रव्यमान होता है; इसलिए ऑक्सीजन को विश्वस्त न पाकर वैज्ञानिकों ने C12 को मानक निर्धारित किया है।
किसी भी तत्व का परमाणु द्रव्यमान इसके परमाणु का औसत सापेक्ष द्रव्यमान (Average relative mass) होता है, जबकि उसकी तुलना कार्बन परमाणु (C12) समस्थानिक) का भार 12 मानकर की जाती है।

ग्राम परमाणु द्रव्यमान – जब परमाणु द्रव्यमान को ग्राम में प्रकट करते हैं, तो वह ग्राम परमाणु द्रव्यमान कहलाता है।
उदाहरण-कैल्सियम का परमाणु द्रव्यमान 40 है तथा इसका परमाणु द्रव्यमान 40 ग्राम है।
प्रश्न 4.
सरल यौगिकों के सत्र किस प्रकार लिखे जाते हैं ? स्पष्ट कीजिए।
उत्तर-
दो अलग-अलग तत्वों से बने सरलतम यौगिकों को द्विअंगी यौगिक कहते हैं।
आण्विक यौगिकों को रासायनिक सूत्र लिखते समय पहले संघटक तत्वों के प्रतीक लिखकर उनकी संयोजकताएं लिखी जाती हैं। जैसा कि इसके नीचे दिए उदाहरणों में प्रकट किया गया है। इसके बाद संयोजित परमाणुओं की संयोजकताओं को क्रॉस (Cross) करके अणु सूत्र लिखते हैं।
1. हाइड्रोजन क्लोराइड का सूत्र
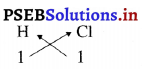
अतः हाइड्रोजन क्लोराइड का रासायनिक सूत्र HCl है।
2. सोडियम सल्फाइट के सूत्र
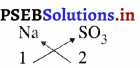
अतः सोडियम सल्फाइट का सूत्र Na2SO3 है।
3. कार्बन टेट्राक्लोराइड का सूत्र
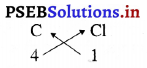
अत: कार्बन टेट्राक्लोराइड का सूत्र CCl4 है।
4. मैग्नीशियम क्लोराइड का सूत्र
मैग्नीशियम क्लोराइड का सूत्र ज्ञात करने के लिए पहले हम धनायन का संकेत (Mg2+) लिखते हैं। इसके बाद ऋणायन क्लोराइड (Cl–) लिखते हैं तथा आवेशों को क्रॉस-गुणा (criss-cross) करके हम सूत्र प्राप्त करते हैं।
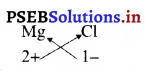
अतः मैग्नीशियम क्लोराइड का सूत्र MgCl2 है।
5. ऐलुमिनियम ऑक्साइड का सूत्र :
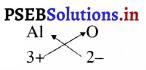
अतः ऐलुमिनियम ऑक्साइड का सूत्र Al2O3 है।
6. कैल्सियम ऑक्साइड का सूत्र :
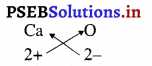
इनमें दोनों तत्वों की संयोजकताएं समान हैं। अतः इसका सूत्र Ca2O2 प्राप्त होगा, किंतु हम इस सूत्र को CaO के रूप में सरलीकृत करते हैं।
बहुपरमाणुक आयनों वाले यौगिक
1. सोडियम नाइट्रेट का सूत्र :

अतः सोडियम नाइट्रेट का सूत्र : NaNO3
2. कैल्सियम हाइड्रोक्साइड का सूत्र :
जब सूत्र में एक ही आयन के दो या दो से अधिक आयन होते हैं तो उनके लिए कोष्ठक का उपयोग किया जाता है। यहां पर OH के कोष्ठक में रखकर पादांक 2 लगाते हैं जो यह दर्शाता है कि एक कैल्सियम परमाणु के साथ दो हाइड्रोक्सिल समूह जुड़े हैं।

अतः कैल्सियम हाइड्रोक्साइड सूत्र : Ca (OH)2
3. सोडियम कार्बोनेट का सूत्र :
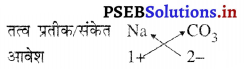
अतः सोडियम कार्बोनेट सूत्र : Na2CO3
इसमें कोष्ठक के उपयोग की आवश्यकता नहीं है क्योंकि बहुपरमाणुक आयन कार्बोनेट का एक ही आयन विद्यमान है।
![]()
प्रश्न 5.
मोल संकल्पना क्या है ? इसकी आवश्यकता पर प्रकाश डालते हुए मोलर-द्रव्यमान को पारिभाषित कीजिए।
उत्तर-
मोल संकल्पना – रसायन शास्त्र में अतिसूक्ष्म स्तर पर कणों (जैसे-परमाणुओं, अणुओं, कणों, इलेक्ट्रॉनों आदि) की संख्या ज्ञात करने के लिए रसायनज्ञों को एक मानक मात्रक की आवश्यकता अनुभव हुई। इसलिए मोल संकल्पना का प्रतिपादन हुआ। मोल संकल्पना के अनुसार, “किसी पदार्थ का एक मोल उसकी वह मात्रा है जिसमें उतने ही कण उपस्थित होते हैं, जितने कार्बन-12 समस्थानिक के ठीक 12 ग्राम में परमाणुओं की संख्या होती है।
किसी पदार्थ के एक मोल में कणों की संख्या सदैव समान होगी, भले ही वह कोई भी पदार्थ हो। इस संख्या के सही निर्धारण के लिए कार्बन-12 परमाणु का द्रव्यमान, द्रव्यमान स्पेक्ट्रममापी द्वारा ज्ञात किया गया जिसका मान 1.992648 × 10-23 ग्राम प्राप्त हुआ। कार्बन के 1 मोल का द्रव्यमान 12 ग्राम होता है; अतः कार्बन के 1 मोल में परमाणुओं की संख्या इस प्रकार होगी-
= 
= 6.0221367 × 1023 ≈ 6.022 × 1023 परमाणु/मोल
इसे ‘आवोगादो संख्या’ कहते हैं तथा ‘N’ या ‘NA‘ से व्यक्त करते हैं।
मोल संकल्पना की आवश्यकता – परमाणु और अणु आकार में अत्यंत छोटे होते हैं तथा किसी पदार्थ को बहत कम मात्रा में भी इनकी संख्या बहुत अधिक होती है, इतनी बड़ी संख्याओं के साथ कार्य करने के लिए इतने ही परिमाण के एक मात्रक को आवश्यकता होती है। मोल संकल्पना के अनुसार 12 ग्राम कार्बन में 6.022 × 1023 (आवोगाद्रो संख्या) कार्बन-परमाणु होते हैं क्योंकि इन कणों को गिनना संभव नहीं है, इसलिए इनकी संख्या को मोल में व्यक्त करके कार्य करना सुगम हो जाता है।
उदाहरणस्वरूप-
1 मोल में ऑक्सीजन परमाणुओं की संख्या = 6.022 × 1023
∴ 3 मोल में ऑक्सीजन परमाणुओं की संख्या = 3 × 6.022 × 1023
= 1.8066
= 1.81 × 1024 परमाणु मोलर द्रव्यमान-किसी पदार्थ के एक मोल को ग्राम में व्यक्त द्रव्यमान को उसका ‘मोलर द्रव्यमान’ कहते हैं। ग्राम में व्यक्त मोलर द्रव्यमान संख्यात्मक रूप से परमाणु द्रव्यमान या आण्विक द्रव्यमान या सूत्र दव्यमान के बराबर होता है।
लघु उत्तरात्मक प्रश्न (Short Answer Type Questions)
प्रश्न 1.
“उच्च ताप पर वायु में चूने के पत्थर (CaCO3) को गर्म करने से द्रव्यमान कम हो जाता है, परंतु लोहे का द्रव्यमान बढ़ जाता है।” ये तथ्य द्रव्यमान-संरक्षण की पुष्टि किस प्रकार करते हैं ?
उत्तर-
चूने के पत्थर को गर्म करने पर कैल्सियम ऑक्साइड तथा कार्बन डाइऑक्साइड प्राप्त होती है।
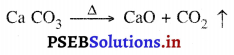
चूँकि CO2 बाहर निकल जाती है, इसलिए CaCO3 के भार में कमी आ जाती है। अभिकारक पदार्थों (CaCO3) व उत्पादों (CaO + CO2) का द्रव्यमान बराबर होता है; अतः इसी से द्रव्यमान-संरक्षण नियम की पुष्टि होती है। अब लोहे को गर्म करने से लोहे का ऑक्साइड (Fe2 O3) बनता है।
4Fe + 3O2 → 2Fe2 O3
रासायनिक क्रिया के अनुसार लोहे का ऑक्सीकरण होने से द्रव्यमान बढ़ जाता है, परंतु अभिकारक पदार्थों व उत्पाद का द्रव्यमान समान रहता है।
इन तथ्यों से प्रकट होता है कि द्रव्य को न तो नष्ट किया जा सकता है और न ही उत्पन्न किया जा सकता है, केवल उसका रूप बदलता है। अतः इससे द्रव्यमान-संरक्षण नियम की पुष्टि होती है।
प्रश्न 2.
परमाणु द्रव्यमान इकाई (a.m.u.) से आप का क्या अभिप्राय है ?
उत्तर-
परमाणु द्रव्यमान इकाई (a.m.u.) – आजकल परमाणु द्रव्यमान को कार्बन-12 परमाणु (6C12) के द्रव्यमान के सापेक्ष व्यक्त किया जाता है। परमाणु द्रव्यमान मात्रक को a.m.u. द्वारा प्रदर्शित करते हैं। कार्बन-12 के एक परमाणु का द्रव्यमान स्वेच्छा से 12 a.m.u. मान लिया गया है। अत: कार्बन-12 के एक परमाणु के द्रव्यमान के बारहवें (1/12) भाग को परमाणु द्रव्यमान इकाई कहते हैं।
परमाणु द्रव्यमान इकाई (1 a.m.u.) = \(\frac {1}{12}\) × कार्बन-12 परमाणु का द्रव्यमान
कार्बन-12 समस्थानिक के एक परमाणु का वास्तविक द्रव्यमान 1.9926 × 10-23 ग्राम होता है जो 12 a.m.u. के बराबर होता है।
∴ 1 a.m.u. = \(\frac{1.9926 \times 10^{-23}}{12}\)
= 1.66 × 10-24 ग्राम 1.66 × 10-24 ग्राम को a.m.u. का ग्राम तुल्यांक (gram equivalent) कहते हैं।
तत्वों के विभिन्न समस्थानिकों के परमाणुओं के द्रव्यमान तथा सब परमाण्विक कणों के द्रव्यमान प्रायः a.m.u. में व्यक्त किए जाते हैं। उदाहरणार्थ-7N14 के एक परमाणु का द्रव्यमान = 14.0032 a.m.u. इलेक्ट्रॉन का द्रव्यमान = 0. 0005486 a.m.u.
प्रश्न 3.
कुछ तत्वों के परमाणु द्रव्यमान पूर्णांक नहीं होते। क्यों ?
उत्तर-
किसी तत्व का परमाणु द्रव्यमान उसके समस्थानिकों के परमाणु द्रव्यमान के सापेक्ष औसत द्रव्यमान होता है। यह सदा पूर्णांक में नहीं होता और इसी कारण कुछ तत्वों के परमाणु द्रव्यमान पूर्णांक नहीं होते। उदाहरण के लिए क्लोरीन के दो समस्थानिक हैं। क्लोरीन का 75% ऐसा है जिसका परमाणु द्रव्यमान 35 है और 25% परमाणु का द्रव्यमान 37 है। इसलिए इसका परमाणु द्रव्यमान 35.5 है।
∴ क्लोरीन का परमाणु द्रव्यमान = \(\frac{3 \times 35+1 \times 37}{4}\)
= \(\frac{105+37}{4}\)
= \(\frac{142}{4}\) = 35.5
प्रश्न 4.
तत्वों के अणुओं की विशेषताएं लिखिए।
उत्तर-
तत्वों के अणुओं की विशेषताएं-
- तत्वों के अणु एक ही प्रकार के परमाणुओं द्वारा रचित होते हैं।
- अधातुओं में अणु एक से अधिक परमाणुओं से बनते हैं, जैसे ऑक्सीजन अणु दो ऑक्सीजन परमाणुओं से बनता है, इसलिए इसे द्वि-परमाणु अणु O2 कहते हैं। यदि सामान्यतः 2 के स्थान पर 3 ऑक्सीजन परमाणु परस्पर संयोग करते हैं तो हमें ओज़ोन प्राप्त होता है।
- किसी अणु की संरचना में प्रयुक्त होने वाले परमाणुओं की संख्या को उस अणु की परमाणुकता कहते हैं।
- धातु अणुओं एवं कार्बन जैसे अन्य तत्वों के अणुओं की सरल संरचना नहीं होती है किंतु उनके अणुओं में असीमित परमाणु परस्पर बंधे होते हैं।
प्रश्न 5.
प्रतीक किस आधार पर तैयार किए गए हैं ? स्पष्ट कीजिए।
उत्तर-
आजकल इंटरनैश्नल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री (IUPAC) तत्वों के नामों को स्वीकृति देता है।
(i) अधिकतर तत्वों के प्रतीक उन तत्वों के अंग्रेजी नामों के एक या दो अक्षरों से बने होते हैं। किसी प्रतीक का पहला अक्षर सदैव बड़े अक्षर में तथा दूसरा अक्षर छोटे अक्षर में लिखा जाता है जैसे
(क) ऑक्सीजन, O
(ख) ऐलुमिनियम, Al
(ग) कोबाल्ट CO
(ii) कुछ तत्वों के प्रतीक उनके अंग्रेजी नामों के प्रथम अक्षर तथा बाद में आने वाले किसी एक अक्षर को संयुक्त करके बनाते हैं जैसे-मैग्नीज़ (Mn), क्लोरीन (Cl), जिंक (Zn) आदि।
(iii) अन्य तत्वों के प्रतीकों को लैटिन, जर्मन और ग्रीक भाषाओं में उनके नामों से बनाया गया है। जैसे-लोहा (Iron) का प्रतीक Fe है, जो उसके लैटिन नाम फेरम से व्युत्पन्न किया गया है। इसी प्रकार सोडियम का प्रतीक Na तथा पोटाशियम का प्रतीक K क्रमश: नैट्रियम एवं केलियम से व्युत्पन्न हैं।
![]()
प्रश्न 6.
अणु और परमाणु में अंतर लिखिए।
उत्तर-
अणु और परमाणु में अंतर-
| अणु | परमाणु |
| 1. अणु दो या दो से अधिक परमाणुओं के मिलने से बनता है। | 1. परमाणु रासायनिक क्रियाओं में भाग लेने वाला पदार्थ का सूक्ष्मतम कण है। |
| 2. यह मुक्त अवस्था में रह सकता है। | 2. यह मुक्त अवस्था में रह सकता है और नहीं भी। |
प्रश्न 7.
आयन किसे कहते हैं ? स्पष्ट कीजिए।
उत्तर-
आयन-धातु और अधातु युक्त यौगिक आवेशित कणों से बने होते हैं। इन आवेशित कणों को आयन कहते हैं। आयन पर ऋण या धन आवेश होता है। ऋण आवेशित कण को ऋणायन (anion) तथा धन आवेशित कण को धनायन (cation) कहते हैं। सोडियम क्लोराइड (NaCl) में धनात्मक सोडियम आयन (Na+) तथा ऋणात्मक क्लोराइड आयन (Cl–) संघटक कण के रूप में विद्यमान होते हैं। अत: आयन एक आवेशित परमाणु अथवा परमाणुओं का एक ऐसा समूह होता है जिस पर नेट आवशेष विद्यमान होता है।
प्रश्न 8.
जल, अमोनिया, कार्बन डाइऑक्साइड, कैल्शियम ऑक्साइड तथा सोडियम क्लोराइड के संघटक तत्वों के द्रव्यमान अनुपात लिखिए।
उत्तर-
| यौगिक | संयुक्त तत्व | संघटक तत्वों के द्रव्यमान का अनुपात |
| जल | हाइड्रोजन, ऑक्सीजन | 1 : 8 |
| अमोनिया | नाइट्रोजन, हाइड्रोजन | 14 : 3 |
| कार्बन डाइऑक्साइड | कार्बन, ऑक्सीजन | 3 : 8 |
| कैल्सियम ऑक्साइड | कैल्सियम, ऑक्सीजन | 40 : 16 अर्थात् 5 : 2 |
| सोडियम क्लोराइड | सोडियम, क्लोरीन | 23 : 35.5 |
प्रश्न 9.
किसी तत्व के परमाणु तथा उसके आयन में अंतर लिखिए।
उत्तर-
तत्व के परमाण तथा आयन में अंतर-
| परमाणु | आयन |
| (1) परमाणु विद्युत् आवेश की दृष्टि से उदासीन होते हैं। | (1) आयन आवेशित कण होते हैं। वे धनात्मक तथा ऋणात्मक आवेशित हो सकते हैं। |
| (2) परमाणु अभिक्रियाशील होता है क्योंकि इनका बाह्यतम कोश पूर्ण नहीं होता। | (2) आयन की इलैक्ट्रॉनिक संरचना किसी एक उत्कृष्ट गैस की इलैक्ट्रॉनिक संरचना के बराबर होती है तथा स्थाई होती है। |
| (3) परमाणु में प्रोटॉनों तथा इलैक्ट्रॉनों की संख्या समान होती है। | (3) धनायन में इलैक्ट्रॉन की संख्या प्रोटॉनों से कम तथा ऋण आयन में प्रोटॉनों से अधिक होती है। |
प्रश्न 10.
Na परमाणु की अपेक्षा Na+ आयन क्यों स्थायी है ?
उत्तर-
Na+ आयन Na (2, 8, 1) परमाणु से एक इलैक्ट्रॉन खोने पर बनता है। इनका विन्यास 2, 8 है। यह विन्यास निष्क्रिय गैस विन्यास के समान है। अत: Na+ आयन Na परमाणु की अपेक्षा अधिक स्थायी है।
प्रश्न 11.
रासायनिक सूत्र किसे कहते हैं ? पानी का उदाहरण बताओ कि रासायनिक सूत्र से हमें क्याक्या जानकारी मिलती है ?
उत्तर-
रासायनिक सूत्र – किसी भी यौगिक के अणु में विभिन्न तत्वों के परमाणु विद्यमान होते हैं। उदाहरण के लिए हाइड्रोजन का अणु म परमाणुओं के मेल से बनता है। उसी प्रकार अमोनिया का अणु H और N परमाणुओं के मेल से बनता है। इसलिए किसी भी पदार्थ के अणु को उसमें विद्यमान तत्वों के संकेतों द्वारा प्रदर्शित किया जा सकता है। विभिन्न तत्वों के संकेतों की सहायता से किसी पदार्थ का प्रदर्शन ही सूत्र कहलाता है। अतः सूत्र को इस प्रकार परिभाषित किया जा सकता है, “किसी पदार्थ के अणु का उसके अवयवी तत्वों के प्रतिरूप संक्षिप्त प्रतीक ही सूत्र है।”
रासायनिक सूत्र का महत्त्व – पानी का उदाहरण लेते हुए इसके महत्त्व पर विचार करते हैं। पानी का रासायनिक सूत्र H2O है।
- सूत्र से ज्ञात होता है कि हाइड्रोजन का एक अणु तथा ऑक्सीजन के दो अणु एक-दूसरे के साथ संयोजित होते हैं।
- ऑक्सीजन की संयोजकता 2 है जबकि हाइड्रोजन की एक।
- H2O का द्रव्यमान 18 है। ऑक्सीजन का परमाणु भार 16 और हाइड्रोजन का 2 है।
- यौगिक वैद्युत् रूप से उदासीन है। इस पर कोई चार्ज (आवेश) नहीं है।
![]()
प्रश्न 12.
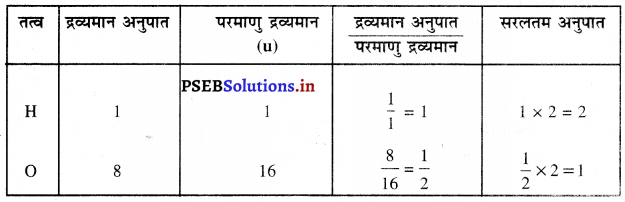
जल के अणु में उपस्थित परमाणुओं की संख्या का सरलतम अनुपात ज्ञात करें।
उत्तर-
प्रश्न 13.
निम्नलिखित के सूत्र लिखिए-
(i) ऐलुमिनियम क्लोराइड
(iii) अमोनियम कार्बोनेट
(ii) फॉस्फोरस पेंटाक्लोराइड
(iv) डाइनाइट्रोजन ट्रेटाऑक्साइड
उत्तर-

प्रश्न 14.
निम्नलिखित सूत्र लिखिए-
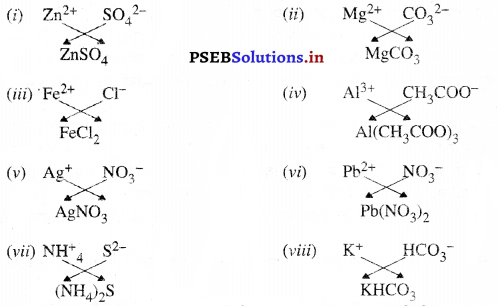
उत्तर-
(i) जिंक सल्फेट
(it) मैग्नीशियम कार्बोनेट
(iii) फैरस क्लोराइड
(iv) ऐल्युमिनियम एसीटेट
(v) सिल्वर नाइट्रेट
(vi) प्लम्बस नाइट्रेट
(vii) अमोनियम सल्फाइड
(viii) पोटाशियम बाइकार्बोनेट।
प्रश्न 15.
निम्नलिखित के द्वारा बने यौगिकों के सूत्र तथा नाम लिखिए-
(1) Fe3+ तथा SO42-
(ii) Cr3+ तथा PO43-
(iii) Hg22+ तथा Cl–
(iv) NH4+ तथा CO32-
उत्तर-

प्रश्न 16.
निम्नलिखित के द्वारा बने यौगिकों के सूत्र तथा नाम लिखिए-
(i) प्लम्बस आयन तथा नाइट्रेट आयन
(it) निकिल आयन तथा कार्बोनेट आयन
(iii) कैल्सियम आयन तथा ऑक्सेलेट आयन
(iv) अमोनियम आयन तथा ऐसीटेट आयन
(v) मैग्नीशियम आयन तथा कार्बोनेट आयन।
उत्तर-
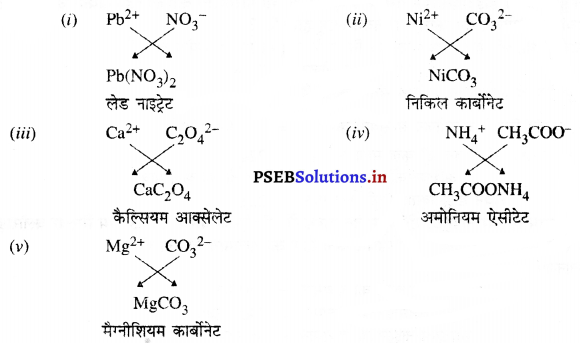
![]()
प्रश्न 17.
निम्नलिखित यौगिकों के नाम लिखिए-
(i) HgCl
(ii) (NH4)2CO3
(iii) NaHCO3
(iv) CrPO4
(v) Sr(HCO3)2
(vi) PtBr4
(vii) ZnS
(viii) BaC2O4
(ix) Pb(NO3)2
(x) Fe2(SO4)3
(xi) CuSO3
(xii) PCI5
(xiii) (NH4)2Cr2O7
(xiv) Ni(NO3)2
उत्तर-
(i) मयूरस क्लोराइड
(ii) अमोनियम कार्बोनेट
(iii) सोडियम हाइड्रोजन कार्बोनेट
(iv) क्रोमियम फॉस्फेट
(v) स्ट्रॉन्शियम बाइकार्बोनेट
(vi) प्लेटिनम ब्रोमाइड
(vii) जिंक सल्फाइड
(viii) बेरियम आक्सेलेट
(ix) लैड नाइट्रेट
(x) फैरिक सल्फेट
(xi) कॉपर सल्फाइट
(xii) फास्फोरस पेंटाक्लोराइड
(xiii) अमोनियम डाइक्रोमेट
(xiv) निकल नाइट्रेट।
संख्यात्मक प्रश्न (Numerical Problems)
प्रश्न 1.
4 ग्राम हाइड्रोजन तथा 32 ग्राम ऑक्सीजन के रासायनिक संयोग से 36 ग्राम जल बना । ये रासायनिक संयोग के किस नियम की पुष्टि करता है ? कारण सहित बताइए।
हल :
रासायनिक अभिक्रिया में अभिकारकों का कुल द्रव्यमान = 32 ग्राम + 4 ग्राम
= 36 ग्राम
उत्पाद का द्रव्यमान = 36 ग्राम
चूंकि अभिकारकों का कुल द्रव्यमान उत्पाद के द्रव्यमान के बराबर है अतः यह उदाहरण द्रव्य की अविनाशिता के नियम की पुष्टि करता है।
प्रश्न 2.
कार्बन तथा ऑक्सीजन संयोग करके कार्बन डाइऑक्साइड गैस बनाते हैं। वे 3 : 8 के अनुपात में संयोग करते हैं। 6.0g कार्बन के साथ पूर्ण अभिक्रिया करने के लिए कितनी ऑक्सीजन की आवश्यकता पड़ेगी। उत्पन्न हुई कार्बन डाइऑक्साइड गैस के द्रव्यमान का भी परिकलन कीजिए। इस प्रकार आपके उत्तर के लिए रासायनिक संयोजन का कौन-सा नियम लागू होता है ?
उत्तर-
कार्बन तथा ऑक्सीजन स्थिर अनुपात नियम के अनुसार परस्पर संयोग करते हैं।
कार्बन : ऑक्सीजन = 3 : 8
∴ 3g कार्बन जितनी ऑक्सीजन के साथ संयोग करता है = 8g
6g कार्बन जितनी ऑक्सीजन से संयोग करता है = \(\frac{8}{3}\) × 6 = 16g
कार्बन तथा ऑक्सीजन की कुल मात्रा 6 + 16 = 22g
∵ अभिकारकों की कुल मात्रा = उत्पादों की कुल मात्रा
∴ कार्बन डाइऑक्साइड की कुल मात्रा = 22g
प्रश्न 3.
170 ग्राम सिल्वर नाइट्रेट, सोडियम क्लोराइड से अभिक्रिया करके 143.5 ग्राम सिल्वर क्लोराइड तथा 85 ग्राम सोडियम नाइट्रेट देता है। सोडियम क्लोराइड का द्रव्यमान कितना होगा ?
हल :
प्रश्नानुसार,
सिल्वर नाइट्रेट का द्रव्यमान = 170
ग्राम सिल्वर क्लोराइड का द्रव्यमान = 143.5 ग्राम
सोडियम नाइट्रेट का द्रव्यमान = 85 ग्राम
मान लो, सोडियम क्लोराइड का द्रव्यमान = x ग्राम
द्रव्यमान संरक्षण के नियम के अनुसार,
अभिकारकों का कुल द्रव्यमान = उत्पादों का कुल द्रव्यमान
रासायनिक अभिक्रिया का समीकरण :
NaCl + AgNO3 = AgCl + NaNO3
x + 170 = 143.5 + 85
x = (143.5 + 85 – 170)
= (228.5 – 170) ग्राम
= 58.5 ग्राम
इसलिए सोडियम क्लोराइड (NaCl) का द्रव्यमान = 58.5 ग्राम उत्तर
प्रश्न 4.
सिद्ध कीजिए कि निम्नलिखित आंकड़े स्थिर अनुपात के नियम की पुष्टि करते हैं। कॉपर मोनोऑक्साइड के दो नमूनों में कॉपर के द्रव्यमान निम्नलिखित हैं-
(i) 1.26 ग्राम कॉपर, 1.42 ग्राम कॉपर मोनो-ऑक्साइड में।
(ii) 1.008 ग्राम कॉपर, 1.136 ग्राम कॉपर मोनो-ऑक्साइड में।
(कॉपर का परमाणु द्रव्यमान = 63, ऑक्सीजन का परमाणु द्रव्यमान = 16)
हल : पहले नमूने में,
कॉपर मोनोऑक्साइड का द्रव्यमान = 1.42 ग्राम
कॉपर का द्रव्यमान = 1.26 ग्राम
∴ ऑक्सीजन का द्रव्यमान = (1.42 – 1.26) ग्राम = 0.16 ग्राम
अतः कॉपर तथा ऑक्सीजन के द्रव्यमान का अनुपात = 1.26 : 0.16
= 7.875 : 1
दूसरे नमूने में,
कॉपर मोनोऑक्साइड का द्रव्यमान = 1.136 ग्राम
कॉपर का द्रव्यमान = 1.008 ग्राम
ऑक्सीजन का द्रव्यमान = (1.136 – 1.008) ग्राम
= 0.128 ग्राम
अतः कॉपर तथा ऑक्सीजन का अनुपात = 0.008 ग्राम : 0.128 ग्राम
= 7.875 : 1
चूंकि इन दोनों नमूनों में कॉपर तथा ऑक्सीजन के द्रव्यमानों का अनुपात 7.875:1 है, इसलिए आँकड़ों से स्थिर अनुपात के नियम की पुष्टि होती है।
![]()
प्रश्न 5.
एक प्रयोग में 2.4 ग्राम आयरन ऑक्साइड को हाइड्रोजन द्वारा पूर्णतया अपचयित करने पर 1.68 ग्राम आयरन प्राप्त होता है। दूसरे प्रयोग में 2.90 ग्राम आयरन ऑक्साइड अपचयित होने पर 2.03 ग्राम आयरन देता है। इन प्रयोगों के परिणामों से स्थिर अनुपात का नियम सिद्ध कीजिए।
हल :
पहले प्रयोग में,
आयरन ऑक्साइड का द्रव्यमान = 2.40 ग्राम ………………. (i)
आयरन का द्रव्यमान = 1.68 ग्राम ……………… (ii)
अतः संयुक्त ऑक्सीजन का द्रव्यमान = (i) … (ii)
= (2.40 – 1.68) ग्राम
= 0.72 ग्राम
अब आयरन एवं ऑक्सीजन के द्रव्यमानों का अनुपात = 1.68 : 0.72
= 7 : 3
दूसरे प्रयोग में,
आयरन ऑक्साइड का द्रव्यमान = 2.90 ग्राम ……………….. (iii)
आयरन का द्रव्यमान = 2.03 ग्राम …………….. (iv)
अतः संयुक्त ऑक्सीजन का द्रव्यमान = (iii) … (iv)
= (2.90 – 2.03) ग्राम
= 0.87 ग्राम आयरन एवं ऑक्सीजन के द्रव्यमानों का अनुपात = 2.03 : 0.87
= 7 : 3
चूँकि दोनों प्रयोगों में आयरन तथा ऑक्सीजन के द्रव्यमानों का अनुपात 7 : 3 है, इसलिए इससे स्थिर अनुपात के नियम की पुष्टि होती है।
प्रश्न 6.
कितने अणु विद्यमान होंगे ?
(a) 9g जल
(b) 17 g अमोनिया।
हल :
(a) जल (H2O) का आण्विक द्रव्यमान = 2 × H + 1 × O
= 2 × 1 + 16 × 1
= 18 a.m.u.
जल का 1 मोल = 18 g
= 6.022 × 1023 अणु
अर्थात् जल के 18 g में अणुओं की संख्या = 6.022 × 1023 अणु
जल के 9 g में अणुओं की संख्या = \(\frac{6.022 \times 10^{23} \times 9}{18}\)
= 3.011 × 1023 अणु
(b) NH3 का मोलर द्रव्यमान = 14 + 3 × 1 = 17 g /mol
NH3 की मोल संख्या = \(\frac{17 \mathrm{~g}}{17 \mathrm{~g} \mathrm{~mol}^{-1}}\) = 1 mol
प्रश्न 7.
17 ग्राम H2O2 में मोलों की संख्या ज्ञात कीजिए।
हल :
H2O2 का आण्विक द्रव्यमान = 1 × 2 + 16 × 2
= 34 a.m.u.
17 g H2O2 में मोलों की संख्या = \(\frac{1 \times 17}{34}\)
= \(\frac{1}{2}\) = 10.5 मोल
प्रश्न 8.
निम्नलिखित के आण्विक द्रव्यमान का परिकलन कीजिए।
(i) PCl5
(ii) NH3
(iii) CH2 Cl2
(iv) H2O2
(v) S8.
हल :
(i) PCl5 का आण्विक द्रव्यमान = 31 + 5 × 35.5
= 31 + 177.5
= 208.5 u
(ii) NH3 का आण्विक द्रव्यमान = 14 + 1 × 3
= 14 +3
= 17 u
(iii) CH2 Cl2 का आण्विक द्रव्यमान = 12 + 1 × 2 + 2 × 35.5
= 12 + 2 + 71
= 85u
(iv) H2O2 का आण्विक द्रव्यमान = 1 × 2 + 16 × 2
= 2 + 32
= 34u
(v) S8 का आण्विक द्रव्यमान = 32 × 8
= 256 u
प्रश्न 9.
निम्न यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिए-
(i) MgO
(ii) CaCl2
(iii) CaCO3
(iv) AlCl3
हल :
(i) Mgo का सूत्र इकाई द्रव्यमान = 24 + 16
= 40g
= 40 u
(ii) CaCl2 का सूत्र इकाई द्रव्यमान = 40 + 2 × 35.5
= 40 + 71.0
= 111.0g
= 111 u
(iii) CaCO3 का सूत्र इकाई द्रव्यमान = 40 + 12 + 16 × 3
= 40+ 12 + 48
= 100g
= 100 u
(iv) AlCl3 का सूत्र इकाई द्रव्यमान = 27 + 3 × 35.5
= 27 + 106.5
= 133.5 g
= 133.5 u
![]()
प्रश्न 10.
सोडियम कार्बोनेट (Na2 CO3.10H2O) एक औद्योगिक रासायनिक पदार्थ है। इसका सूत्र द्रव्यपान (Formula Mass) ज्ञात करो।
हल :
Na2 CO3.10H2O का सूत्र द्रव्यमान (Formula Mass)
= 23 × 2 + 12 + 3 × 16 + 10 (1 × 2 + 16)
= 46 + 12 + 48 + 10 (18)
= (46 + 12 + 48 + 180) g
= 286 g
प्रश्न 11.
निम्नलिखित पदार्थों के मोलर द्रव्यमान (Molar Mass) का परिकलन करो-
(a) इथाइन, C2H2
(b) सल्फर अणु, S8
(c) फॉस्फोरस अणु, P4
(d) हाइड्रोक्लोरिक अम्ल, HCl
(e) नाइटिक अम्ल, HNO3
हल :
(a) C2H2 का मोलर द्रव्यमान (Molar Mass) = 12 × 2 + 1 × 2
= 26 a.m.u.
= 26g
(b) S8 का मोलर द्रव्यमान (Molar Mass) = 32 × 8
= 256 a.m.u.
= 256 g
(c) P4 का मोलर द्रव्यमान (Molar Mass) = 31× 4
= 124 a.m.u.
= 124g
(d) HCl का मोलर द्रव्यमान (Molar Mass) = 1 + 35.5
= 36.5 a.m.u.
= 36.5g
(e) HNO3 का मोलर द्रव्यमान (Molar Mass) = 1 + 14 + 16 × 3
= 1 + 14 + 48
= 63 a.m.u.
= 63g
प्रश्न 12.
ग्लूकोस (C6H12O8) अणु का आण्विक द्रव्यमान परिकलित कीजिए।
हल :
ग्लूकोस (C6H12O8) का आण्विक द्रव्यमान = 6 (12) + 12 (1) + 6 (16)
= (72) + (12) + (96)
= 180u
प्रश्न 13.
प्राप्त कार्बनडाइऑक्साइड की मात्रा का परिकलन कीजिए। जब-
(i) 1 मोल कार्बन को हवा में जलाया जाता है, और ।
(ii) 1 मोल कार्बन को 16 ग्राम ऑक्सीजन में जलाया जाता है।
हल :
हवा में कार्बन को जलाने का रासायनिक समीकरण निम्नलिखित है-

(i) जब 1 मोल कार्बन को वायु में जलाया जाता है-
1 मोल कार्बन जलकर CO2 उत्पन्न करेगा = 1 मोल = 44 ग्राम
(ii) जब 1 मोल कार्बन को 16 ग्राम ऑक्सीजन में जलाया जाता है-
1 मोल कार्बन के लिए, आवश्यक ऑक्सीजन = 32 ग्राम = 1 मोल
परन्तु ऑक्सीजन का उपलब्ध द्रव्यमान = 16 ग्राम = \(\frac{1}{2}\) मोल
अतः ऑक्सीजन सीमित मात्रा में है
∴ उत्पन्न हुई CO2 का द्रव्यमान = \(\frac{1}{2}\) मोल = 22 ग्राम
प्रश्न 14.
निम्नलिखित अणुओं के द्रव्यमान ज्ञात करो
(i) क्लोरीन (Cl2),
(ii) क्लोरोफॉर्म (CHCl3),
(iii) मीथेन (CH4),
(iv) जल (H2O),
(v) कार्बनडाइऑक्साइड (CO2)
जबकि C = 12, H = 1, Cl = 35.5, S = 32, O = 16.
हल :
(i) क्लोरीन (Cl2) का अणु द्रव्यमान = 2 × 35.5 = 71 g
(ii) क्लोरोफॉर्म (CHCl3) का अणु द्रव्यमान = 12 + 1 + 3 × 35.5 = 119.5 g
(iii) मीथेन (CH4) का अणु द्रव्यमान 12 + 4 × 1 = 16g
(iv) जल (H2O) का अणु द्रव्यमान = 2 × 1 + 16 = 18 g
(v) कार्बन डाइऑक्साइड (CO2) का अणु द्रव्यमान = 12 + 2 × 16 = 44 g
![]()
प्रश्न 15.
चाय में विद्यमान कैफ़ीन (C8H10N4O2) का अणु द्रव्यमान ज्ञात करो।
हल :
कैफ़ीन का अणु द्रव्यमान = 8 × 12 + 10 × 1 + 4 × 14 + 2 × 16
= 96 + 10 + 56 + 32
= 194 g
प्रश्न 16.
C-12 के एक अणु का द्रव्यमान 1.993 × 1023g है। एक a.m.u. का द्रव्यमान ज्ञात करो।
हल:
1a.m.u. = \(\frac{1}{12}\) कार्बन अणु का द्रव्यमान
कार्बन (C-12) अणु का द्रव्यमान = 1.993 × 10-23 g
1 a.m.u = \(\frac{1.993 \times 10^{-23} \mathrm{~g}}{12}\)
= 1.66 × 10-24
∴ 1 a.m.u. = 1.66 × 10-24g
प्रश्न 17.
0.0239 g क्लोरोफॉर्म (CHCl3) में मोल की संख्या ज्ञात करो, जबकि C = 12, Cl = 35.5, H = 1.
हल:
CHCl3 का मोलर द्रव्यमान = 12 + 1 + 3 × 35.5
= 119.5
अर्थात् 119.5g में विद्यमान अणु = 6.023 × 1023
1g में विद्यमान अणु = \(\frac{6.023 \times 10^{-23}}{119.5}\)
∴ 0.0239g में विद्यमान अण \(\frac{6.023 \times 10^{-23}}{119.5}\) × 0.0239
= 1.2046 × 1020
प्रश्न 18.
चांदी के एक अणु का द्रव्यमान 1.794 × 10-22g है। चांदी का आण्विक द्रव्यमान ज्ञात करो।
हल :
हम जानते हैं कि, किसी तत्व के 6.022 × 1023 अणुओं का द्रव्यमान
= ग्राम अणु द्रव्यमान
चांदी के 1 अणु का द्रव्यमान = 1.794 × 10-22 g (दिया है)
6.022 × 1023 चांदी के अणुओं का द्रव्यमान = 1.794 × 10-22 × 6.022 × 1023 g
= 108.05 g
अर्थात् चांदी का ग्राम अणु का द्रव्यमान = 108.05 g
चांदी का आण्विक द्रव्यमान = 108.05
प्रश्न 19.
नमक के एक कि० ग्रा० पैकेट का मूल्य 4 रुपये है। नमक का मोलर द्रव्यमान 58.5 है। इसका प्रति मोल (mol) मूल्य ज्ञात करो।
हल:
नमक का मोलर द्रव्यमान = 58.5
1 मोल नमक का द्रव्यमान = 58.5 g
1000 g नमक का मूल्य = 4 रुपये
1 ग्राम नमक का मूल्य = \(\frac{4}{1000}\)
∴ 58.5 ग्राम नमक का मूल्य = \(\frac{4}{1000}\) × 58.5
= 0.23 रुपये
प्रश्न 20.
नाइट्रोजन (N) का द्रव्यमान ज्ञात करो जिसमें अणुओं की उतनी ही संख्या विद्यमान है जितनी 4.4g CO, में है।
हल:
CO2 को मोलर द्रव्यमान = 1 × C + 2 × O
= 1 × 12 + 2 × 16
= 12 + 32
= 44g
44 g कार्बन डाइऑक्साइड में अणु = 6.022 × 1023
1 g कार्बन डाइऑक्साइड में अणुओं की संख्या = \(\frac{6.022 \times 10^{23}}{44}\)
4.4 g कार्बन डाइऑक्साइड में अणु = \(\frac{6.022 \times 10^{23}}{44}\) × 4.4
= 6.022 × 1022
नाइट्रोजन (N2) के अणु = 6.022 × 1022
N2 का मोलर द्रव्यमान = 28
6.022 × 1022 N2 का अणुओं का द्रव्यमान = 28 g
N2 के 6.022 × 1022 अणुओं का द्रव्यमान = \(\frac{28}{6.022 \times 10^{22}}\) × 6.022 × 1022
= 28 g
प्रश्न 21.
निम्नलिखित प्रत्येक में कणों की संख्या का परिकलन कीजिए :
(i) 4g सोडियम परमाणु
(ii) 8 g ऑक्सीजन अणु
(iii) 0.1 मोल कार्बन परमाणु
हल :
(i) 
N = \(\frac{\mathrm{m}}{\mathrm{M}}\) × N0
N = \(\frac{46}{23}\) × 6.022 × 1023
N = 12.044 × 1023
(ii) 
N = \(\frac{\mathrm{m}}{\mathrm{M}}\) × N0
∴ ऑक्सीजन का परमाणु द्रव्यमान = 16 u
ऑक्सीजन अणुओं का मोलर द्रव्यमान = 16 × 2 = 32 g
N = 32
= \(\frac{8}{32}\) × 6.022 × 1023
N = 1.5055 × 1023
= 1.51 × 1023
(iii) कणों (परमाणु) की संख्या = कण के मोलों की संख्या × आवोगाद्रो संख्या
N = n × N0
= 0.1 × 6.022 × 1023
= 6.022 × 1023
![]()
प्रश्न 22.
ग्लूकोज (C6H12O6) की प्रतिशत संरचना ज्ञात कीजिए।
(C = 12, H = 1, 0 = 16)
हल :
ग्लकोज़ का आण्विक द्रव्यमान = 6 × 12 + 12 × 1 + 6 × 16
= 72 + 12 + 96
= 180g
% कार्बन = \(\frac{72}{180}\) × 100 = 40
% हाइड्रोजन = \(\frac{12}{180}\) × 100 = 6.66
% ऑक्सीजन = \(\frac{96}{180}\) × 100 = 53.33
प्रश्न 23.
निम्नलिखित का ग्रामों में द्रव्यमान ज्ञात करो।
(i) 1 मोल सल्फ्यूरिक एसिड (H2SO4)
(2) 0.5 मोल ऐलूमिनियम सल्फेट [Al2(SO4)3]
(1) 0.03 मोल अमोनिया (NH3)
(iv) 0.7 मोल हाइड्रोजन क्लोराइड (HCl)
(v) 10 मोल सोडियम सल्फाइट (Na2SO3)
(vi) 0.5 मोल नाइट्रोजन गैस (N2)
हल :
(i) 1 मोल H2SO4 का द्रव्यमान = 2 + 32 + 64
= 98 g = आण्विक पुंज
(ii) 1 मोल Al2(SO4)3 का द्रव्यमान = 2 × 27 + 3 × (32 + 64)
= 342 g = आण्विक पुंज
∴ 0.5 मोल Al2(SO4)3 का द्रव्यमान = \(\frac{34 \times 5}{10}\)
= 171 g
(iii) 1 मोल NH3 का द्रव्यमान = 14 + 3 = 17g
∴ 0.05 मोल NH3 का द्रव्यमान
= 17 × 0.05
= 0.85g
(iv) 1 मोल HCl का द्रव्यमान = 1 + 35.5
= 36.5g
∴ 0.7 मोल HCl का द्रव्यमान
= 36.5 × 0.7
= 25.55 g
(v) 1 मोल Na2SO3 का द्रव्यमान = 2 × 23 + 1 × 32 + 16 × 3
= 126 u = 126 g
∴ 10 मोल Na2SO3 का द्रव्यमान = 126 × 10
= 1260g
(vi) 1 मोल नाइट्रोजन गैस (N2) का द्रव्यमान = 2 × 14
= 28g
∴ 0.5 मोल नाइट्रोजन गैस (N2) का द्रव्यमान = 28 × 0.5
= 14g
अति लघु उत्तरात्मक प्रश्न (Very Short Answer Type Questions)
प्रश्न 1.
भारतीय दार्शनिकों ने पदार्थ की विभाज्यता के विषय में पहली बार कब विचार किया ?
उत्तर-
लगभग 500 ई० पूर्व।
प्रश्न 2.
महर्षि कणाद ने पदार्थ के विभाजन के बारे में क्या प्रतिपादित किया था ?
उत्तर-
पदार्थ का सूक्ष्मतम कण अविभाज्य रहेगा।
प्रश्न 3.
महर्षि कणाद ने अविभाज्य सूक्ष्मतम कण को क्या नाम दिया था ?
उत्तर-
परमाणु।
प्रश्न 4.
किन दो ग्रीक दार्शनिकों ने सूक्ष्मतम कण को अविभाज्य कण माना था ?
उत्तर-
डेमोक्रिटस और लियुसपिस ने।
![]()
प्रश्न 5.
यौगिक जल में हाइड्रोजन और ऑक्सीजन के द्रव्यमानों का अनुपात सदैव क्या होता है ?
उत्तर-
1 : 8.
प्रश्न 6.
अमोनिया (NHT) में नाइट्रोजन और हाइड्रोजन के द्रव्यमानों का अनुपात क्या होता है ?
उत्तर-
14 : 3.
प्रश्न 7.
प्राउस्ट ने निश्चित अनुपात के नियम के अंतर्गत क्या कहा था ?
उत्तर-
दो या दो से अधिक तत्वों द्वारा निर्मित यौगिक में इन दो तत्वों का अनुपात सदैव निश्चित रहता है।
प्रश्न 8.
जॉन डाल्टन ने परमाणु सिद्धांत कब प्रस्तुत किया था ?
उत्तर-
सन् 1808 में।
प्रश्न 9.
द्रव्यों की प्रकृति के बारे में आधारभूत सिद्धांत किसने प्रस्तुत किया था ?
उत्तर-
जॉन डाल्टन ने।
प्रश्न 10.
परमाणु के अर्धव्यास को किस इकाई में मापा जाता है ?
उत्तर-
नेनोमीटर (nm) में।
प्रश्न 11.
नेनोमीटर और मीटर में परस्पर क्या संबंध है ?
उत्तर-
1 nm = 10-9m.
![]()
प्रश्न 12.
हमारे इर्द-गिर्द की वस्तुएं किस से मिलकर बनी हैं ?
उत्तर-
परमाणुओं से।
प्रश्न 13.
सबसे पहले तत्वों के लिए प्रतीकों का प्रयोग किस वैज्ञानिक ने किया था ?
उत्तर-
जॉन डाल्टन ने।
प्रश्न 14.
बर्जीलियस के प्रतीकों में क्या विशेषता थी ?
उत्तर-
उनमें तत्वों के नाम को एक या दो अक्षरों से प्रदर्शित किया जाता था।
प्रश्न 15.
विभिन्न परमाणु द्रव्यमानों की इकाइयाँ पहले किस आधार पर ली जाती थीं ?
उत्तर-
ऑक्सीजन परमाणु के परमाणु द्रव्यमानों का \(\frac {1}{16}\) वां भाग के आधार पर।
प्रश्न 16.
परमाणु द्रव्यमानों को ज्ञात करने के लिए परमाणु द्रव्यमान इकाई कार्बन-12 समस्थानिक मानक के रूप में सार्वभौमिक रूप से कब स्वीकार की गई ?
उत्तर-
1961 में।
![]()
प्रश्न 17.
आजकल परमाणु द्रव्यमान ज्ञात करने के लिए कौन-सी इकाई उपयोग में लायी जाती है ?
उत्तर-
C-12 समस्थानिक के परमाणु द्रव्यमान के \(\frac {1}{12}\) वें भाग को मानक परमाणु द्रव्यमान इकाई के रूप में उपयोग किया जाता है।
प्रश्न 18.
किसी तत्व या यौगिक का सूक्ष्मतम कण क्या है जो स्वतंत्र रूप से विचर सकता है ?
उत्तर-
अणु।
प्रश्न 19.
किसी तत्व के एक समान परमाणुओं से क्या बनता है ?
उत्तर-
अणु।
प्रश्न 20.
ऑक्सीजन के अणु में कितने परमाणु उपस्थित होते हैं ?
उत्तर-
दो परमाणु । इसलिए इसे द्विपरमाणुक कहते हैं।
प्रश्न 21.
द्विपरमाणुक अणु के चार उदाहरण दीजिए।
उत्तर-
- हाइड्रोजन
- ऑक्सीजन
- नाइट्रोजन
- क्लोरीन।
प्रश्न 22.
चतुर्परमाणुक अणु का एक उदाहरण दीजिए।
उत्तर-
फास्फोरस (P4)।
प्रश्न 23.
अष्टपरमाणुक या (बहुपरमाणुक) अणु की एक उदाहरण दीजिए।
उत्तर-
सल्फर (S8)।
![]()
प्रश्न 24.
जब ऑक्सीजन के तीन परमाणु परस्पर संयोग करते हैं तो क्या प्राप्त होता है ?
उत्तर-
ओज़ोन (O3)।
प्रश्न 25.
किस तत्व के अणुओं की सरल संरचना नहीं होती ?
उत्तर-
कार्बन।
प्रश्न 26.
कार्बन डाइऑक्साइड में कार्बन और ऑक्सीजन के अणुओं का द्रव्यमान अनुपात लिखो।
उत्तर-
3 : 8.
प्रश्न 27.
जल अणु में हाइड्रोजन और ऑक्सीजन के परमाणुओं की संख्या का क्या अनुपात है ?
उत्तर-
H : 0 = 2 : 1
प्रश्न 28.
आयन किसे कहते हैं ?
उत्तर-
आयन – आवेशित कणों को आयन कहते हैं।
प्रश्न 29.
धनायन (Cation) किसे कहते हैं ?
उत्तर-
धन-आवेशित कणों को धन-आयन कहते हैं।
प्रश्न 30.
ऋणायन किसे कहते हैं ?
उत्तर-
ऋण आवेशित कणों को ऋणायन कहते हैं।
![]()
प्रश्न 31.
कैल्सियम ऑक्साइड के संघटक तत्वों का द्रव्यमान अनुपात लिखिए।
उत्तर-
कैल्सियम ऑक्साइड में कैल्सियम और ऑक्सीजन का अनुपात 5 : 2 है।
प्रश्न 32.
मैग्नीशियम सल्फाइड में मैग्नीशियम और सल्फर का द्रव्यमान अनुपात क्या है ?
उत्तर.-
3 : 4.
प्रश्न 33.
सोडियम क्लोराइड में सोडियम और कलोरीन का द्रव्यमान अनुपात लिखिए।
उत्तर-
सोडियम (Na) : क्लोरीन (Cl) = 23 : 35.5
प्रशन 34.
रालामनिक सूत्र किसे कहते हैं ?
उत्तर-
रावानिक नकिसी दौरिका उसके संघटक तत्वों के प्रतीकों तथा उनकी संखोजकता की सहायता से निरूपण, रासायनिक सूत्र कहलाता है।
प्रश्न 35.
संयोजकता किसे कहते हैं ?
उत्तर-
संयोजकता- किसी तत्व की संयोजन सामर्थ्य को उस तत्व की संयोजकता कहते हैं।
प्रश्न 36.
दवि-अंगी यौगिक किसे कहते हैं ?
उत्तर-
दो भिन्न-भिन्न तत्वों से बने यौगिको को द्वि-अंगी यौगिक कहते हैं।
![]()
प्रश्न 37.
किसी पदार्थ का आण्विक द्रव्यमान क्या होता है ?
उत्तर-
आण्विक द्रव्यमान – किसी पदार्थ का आण्विक द्रव्यमान वह संख्या है जो यह प्रदर्शित करती है कि इस पदार्थ का एक अणु, कार्बन-12 समस्थानिक के एक परमाणु के बारहवें अंश से कितने गुना भारी है।
प्रश्न 38.
आण्विक द्रव्यमान किस इकाई से व्यक्त किया जाता है ?
उत्तर-
आण्विक द्रव्यमान को इकाई u (यूनीफाइड) द्वारा व्यक्त किया जाता है।
प्रश्न 39.
a.m.u. के नाम के लिए IUPAC का नया प्रस्ताव क्या है ?
उत्तर-
u (यूनीफाइड) है।
प्रश्न 40.
जल किन तत्वों के संयोग से बना हुआ है ?
उत्तर-
हाइड्रोडन तथा ऑक्सीजन तत्वों के संयोग से जल बना हुआ है।
प्रश्न 41.
मोल किसे कहते हैं ?
उत्तर-
मोल – किसी स्पीशीज़ (अणु, परमाणु अथवा कण) की वह संख्या है जो ग्रामों में उसके परमाणु या आण्विक द्रव्यमान के बराबर होती है।
प्रश्न 42.
आवोगाद्रो संख्या किसे कहते हैं ?
उत्तर-
आवोगाद्रो संख्या – किसी पदार्थ के 1 मोल में कणों की निश्चित संख्या होती है जिसका मान 6.022 × 1023 होता है को आवोगाद्रो संख्या कहते हैं। इसे N0 से व्यक्त किया जाता है।
प्रश्न 43.
आवोगाद्रो संख्या को किससे प्रदर्शित किया जाता है ?
उत्तर-
N0 से।
![]()
प्रश्न 44.
तत्व द्रव्यमान के किस अनुपात में संयोजन करके यौगिक बनाते हैं ?
उत्तर-
तत्व द्रव्यमान के स्थिर अनुपात में संयोग करके यौगिक बनाते हैं।
प्रश्न 45.
द्रव्यमान संरक्षण नियम को किस वैज्ञानिक ने प्रस्तुत किया था ?
उत्तर-
रूस के वैज्ञानिक लोमोनोसोव ने सन् 1756 में द्रव्यमान संरक्षण नियम प्रस्तुत किया था।
प्रश्न 46.
“स्थिर अनुपात नियम’ का प्रतिपादन किस वैज्ञानिक ने किया था ?
उत्तर-
फ्रांस के वैज्ञानिक प्राउस्ट ने सन् 1799 में।
प्रश्न 47.
a.m.u. क्या प्रदर्शित करता है ?
उत्तर-
परमाणु द्रव्यमान इकाई को।
प्रश्न 48.
कार्बन का कौन-सा समस्थानिक तत्व के सापेक्ष परमाणु द्रव्यमान को दर्शाने के लिए प्रयोग किया जाता है ?
उत्तर-
कार्बन-12 समस्थानिक (आइसोटोप)।
प्रश्न 49.
अधिकांश तत्वों के परमाणु द्रव्यमान पूर्णांक नहीं होते हैं। यह किस तथ्य को दर्शाता है ?
उत्तर-
तत्वों के परमाणु द्रव्यमानों का पूर्णांक में न होना उस तत्व के समस्थानिकों का होना दर्शाता है।
![]()
प्रश्न 50.
मोलर द्रव्यमान क्या होता है ?
उत्तर-
मोलर द्रव्यमान-किसी पदार्थ के 1 मोल का ग्राम में व्यक्त किया गया द्रव्यमान उसका मोलर द्रव्यमान होता है।
प्रश्न 51.
मोल संकल्प के अनुरूप तत्व का ग्राम परमाणु द्रव्यमान परिभाषित करें।
उत्तर-
ग्राम परमाणु द्रव्यमान या एक ग्राम परमाणु किसी तत्व के 1 मोल (6.022 × 1023 परमाणुओं) का द्रव्यमान होता है जिसे ग्राम में प्रदर्शित किया जाता है।
प्रश्न 52.
किसी तत्व के एक ग्राम परमाणुओं में कितने परमाणु उपस्थित होते हैं ?
उत्तर-
6.022 × 1023 (आवोगाद्रो संख्या के बराबर)।
प्रश्न 53.
क्या सोडियम और कैल्शियम के एक ग्राम मोल में परमाणुओं की संख्या भिन्न-भिन्न होती है ?
उत्तर-
नहीं। इनमें परमाणुओं की संख्या एक समान होगी।
प्रश्न 54.
एक बड़े बर्तन में दो बीकर रखे गए हैं। एक बीकर में लैड नाइट्रेट तथा दूसरे बीकर में सोडियम सल्फेट का विलयन है। बर्तन को तोला गया तथा बाद में बर्तन में रखे दोनों विलयनों को परस्पर भली-भांति मिलाया जाता है। बर्तन को पुनः तोला गया। क्या द्रव्यमान परिवर्तित होता है अथवा नहीं तथा ऐसा किस नियम के अंतर्गत होता है ?
उत्तर-
द्रव्यमान परिवर्तित नहीं होता है। द्रव्यमान संरक्षण नियमानुसार रासायनिक अभिक्रिया से पूर्व तथा पश्चात् द्रव्यमान समान रहता है।
प्रश्न 55.
12 ग्राम मैग्नीशियम तथा 16 ग्राम ऑक्सीजन के संयोग से 28 ग्राम मैग्नीशियम ऑक्साइड प्राप्त होता है। इन आँकड़ों से रासायनिक संयोजन के किस नियम की पुष्टि होती है ?
उत्तर-
इन आँकड़ों से द्रव्यमान संरक्षण नियम की पुष्टि होती है।
प्रश्न 56.
क्या 1 मोल सोडियम तथा 1 मोल ऑक्सीजन का द्रव्यमान बराबर होगा ?
उत्तर-
नहीं, 1 मोल सोडियम (6.022 × 1023 परमाणु) का द्रव्यमान 23 ग्राम (परमाणु द्रव्यमान) तथा 1 मोल ऑक्सीजन (6.022 × 1023 अणु) का द्रव्यमान 32 ग्राम (अणु द्रव्यमान) होता है।
![]()
प्रश्न 57.
1 मोल किस संख्या को प्रदर्शित करता है ?
उत्तर-
6.022 × 1023.
प्रश्न 58.
34 ग्राम अमोनिया (NH3) में कितने मोल उपस्थित होते हैं ?
उत्तर-
2 मोल अमोनिया।
प्रश्न 59.
एक तत्व ‘2’ की संयोजकता 3 है। इस तत्व ‘Z’ के ऑक्साइड का सूत्र क्या होगा ?
उत्तर-
Z2O3.
प्रश्न 60.
कार्बन-12 के 0.012 kg में कितने परमाणु विद्यमान होते हैं ? इस स्थिराँक को क्या नाम दिया गया है ?
उत्तर-
6.022 × 1023 परमाणु। इस संख्या को आवोगाद्रो स्थिराँक कहते हैं।
प्रश्न 61.
Al3+ तथा SO42- आयनों से बनने वाले यौगिक का सूत्र क्या होगा ?
उत्तर-
Al2 (SO4)3 .
प्रश्न 62.
जल के 9g में कितने अणु उपस्थित होते हैं ?
उत्तर-
9g जल में कितने अणुओं की संख्या = \(\frac{1}{9}\) × 6.022 × 1023 = 3.011 × 1023अणु ।
![]()
प्रश्न 63.
HNO3 का मोलर द्रव्यमान ज्ञात करो। परमाणु द्रव्यमान दिए गए हैं H = 1u, N = 14u, 0 = 16u.
उत्तर-
HNO3 का मोलर द्रव्यमान = 1u + 14u + 3 × 16u = 63u
प्रश्न 64.
क्लोरीन परमाणु में कितने संयोजकता इलैक्ट्रान उपस्थित होते हैं ?
उत्तर-
7.
प्रश्न 65.
बहुपरमाण्विक आयन क्या होते हैं ?
उत्तर-
बहुपरमाण्विक आयन-परमाणुओं का समूह-जिस पर नेट आवेश हो जैसे-NH31+ ।
