Punjab State Board PSEB 9th Class Science Important Questions Chapter 3 ਪਰਮਾਣੂ ਅਤੇ ਅਣੂ Important Questions and Answers.
PSEB 9th Class Science Important Questions Chapter 3 ਪਰਮਾਣੂ ਅਤੇ ਅਣੂ
ਵੱਡੇ ਉੱਤਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ (Long Answer Type Questions)
ਪ੍ਰਸ਼ਨ 1.
ਰਸਾਇਣਿਕ ਸੰਯੋਜਨ ਦੇ ਨਿਯਮਾਂ ਨੂੰ ਸਪੱਸ਼ਟ ਕਰੋ ।
ਉੱਤਰ-
ਵਿਗਿਆਨਿਕ ਅਨਟੋਨੀ ਐੱਲ. ਲਵਾਇਜ਼ਿਏ (Antonie L. Lavoisier) ਅਤੇ ਜੋਜ਼ਫ ਐੱਲ. ਪਉਸਟ (Joseph L. Proust) ਨੇ ਰਸਾਇਣਿਕ ਸੰਯੋਜਨ ਦੇ ਦੋ ਨਿਯਮਾਂ ਨੂੰ ਪ੍ਰਤਿਪਾਦਿਤ ਕੀਤਾ ।
(i) ਪੁੰਜ ਸੁਰੱਖਿਅਣ ਜਾਂ ਪਦਾਰਥ ਦੀ ਅਵਿਨਾਸ਼ਤਾ ਦਾ ਨਿਯਮ – ਰੁਸ ਦੇ ਵਿਗਿਆਨੀ ਐੱਮ. ਵੀ. ਲੋਮੋਨੋਸੋਵ ਨੇ 1756 ਈ: ਵਿੱਚ ਪੁੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਸਥਾਪਿਤ ਕੀਤਾ ।
ਪੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਅਨੁਸਾਰ ਜਦੋਂ ਰਸਾਇਣਿਕ ਪਰਿਵਰਤਨ (ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਪੂਰਾ ਹੁੰਦਾ ਹੈ ਤਾਂ ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਪੰਜ ਨਾ ਤਾਂ ਬਣਦਾ ਹੈ (ਸਿਰਜਣ) ਅਤੇ ਨਾਂ ਹੀ ਨਸ਼ਟ ਹੁੰਦਾ ਹੈ । ਅਰਥਾਤ ਪੰਜ ਵਿੱਚ ਕੋਈ ਪਰਿਵਰਤਨ ਨਹੀਂ ਹੁੰਦਾ ਹੈ । ਇਸ ਲਈ, ਕਿਸੇ ਵੀ ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਪਰਿਵਰਤਨ ਤੋਂ ਬਾਅਦ ਪਦਾਰਥ (ਉਪਜਾਂ ਦਾ ਕੁੱਲ ਪੰਜ ਓਨਾ ਹੀ ਰਹਿੰਦਾ ਹੈ ਜਿੰਨਾ ਪ੍ਰਤੀਕਿਰਿਆ ਤੋਂ ਪਹਿਲਾਂ ਪਦਾਰਥ (ਅਭਿਕਾਰਕਾਂ ਦਾ ਕੁੱਲ ਪੰਜ ਸੀ ।
∴ ਪ੍ਰਤੀਕਿਰਿਆ ਤੋਂ ਪਹਿਲਾਂ ਅਭਿਕਾਰਕਾਂ ਦਾ ਕੁੱਲ ਪੰਜ = ਪ੍ਰਤੀਕਿਰਿਆ ਤੋਂ ਬਾਅਦ ਉਪਜਾਂ ਦਾ ਕੁੱਲ ਪੰਜ
ਇਸ ਨਿਯਮ ਨੂੰ ਹੇਠ ਲਿਖੇ ਪ੍ਰਯੋਗ ਦੁਆਰਾ ਸਿੱਧ ਕੀਤਾ ਜਾ ਸਕਦਾ ਹੈ ।
ਪ੍ਰਯੋਗ – ਇੱਕ ਕੋਨੀਕਲ ਫਲਾਸਕ ਲਓ । ਹੇਠਾਂ ਲਿਖੇ ‘X’ ਅਤੇ ‘Y’ ਰਸਾਇਣਾਂ ਦਾ ਇੱਕ ਸੈਂਟ ਲਓ ।
‘X’ – ‘Y’
(i) ਕਾਪਰ ਸਲਫੇਟ – ਸੋਡੀਅਮ ਕਾਰਬੋਨੇਟ
(ii) ਬੇਰੀਅਮ ਕਲੋਰਾਈਡ – ਸੋਡੀਅਮ ਸਲਫੇਟ
(iii) ਲੈਂਡ ਨਾਈਟੇਟ – ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ
ਇੱਕ ਸੈੱਟ ਦੇ ਰਸਾਇਣਾਂ ਦੇ ਵੱਖ-ਵੱਖ 5% ਘੋਲ ਪਾਣੀ ਵਿੱਚ । ਤਿਆਰ ਕਰੋ ।
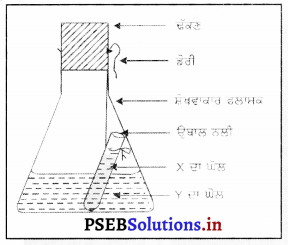
‘Y’ ਦੇ ਘੋਲ ਦੀ ਕੁੱਝ ਮਾਤਰਾ ਨੂੰ ਕੋਠੀਕਲ ਫਲਾਸਕ ਵਿੱਚ ਲਓ । ਸੈਂਟ ਮੁਤਾਬਿਕ ‘X’ ਘਲ ਦੀ ਕੁੱਝ ਮਾਤਰਾ ਨੂੰ ਉਬਾਲ ਨਲੀ ਵਿੱਚ ਲਓ ਅਤੇ ਉਬਾਲ ਨਲੀ ਨੂੰ ਫਲਾਸਕ ਵਿੱਚ ਇਸ ਤਰ੍ਹਾਂ ਲਟਕਾਓ ਤਾਂ ਜੋ ਦੋਵੇਂ ਘੋਲ ਆਪਸ ਵਿੱਚ ਨਾ ਮਿਲਣ (ਮਿਸ਼ਰਤ ਹੋਣ) । ਹੁਣ ਫਲਾਸਕ ਦਾ ਮੂੰਹ ਕਾਰਕ ਨਾਲ ਬੰਦ ਕਰ ਦਿਓ । ਫਲਾਸਕ ਨੂੰ ਸਾਰੇ ਪਦਾਰਥਾਂ ਸਮੇਤ ਧਿਆਨ ਨਾਲ ਤੋਲ ਲਓ । ਹੁਣ ਫਲਾਸਕ ਨੂੰ ਇਸ ਤਰ੍ਹਾਂ ਹਿਲਾਓ ਤਾਂ ਜੋ ‘X’ ਅਤੇ ‘Y’ ਘੋਲ ਆਪਸ ਵਿੱਚ ਚੰਗੀ ਤਰ੍ਹਾਂ ਮਿਸ਼ਰਤ ਹੋ ਜਾਣ ! ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਹੋ ਜਾਣ ਤੋਂ ਬਾਅਦ ਫਲਾਸਕ ਨੂੰ ਦੁਬਾਰਾ ਤੋਲੋਂ । ਪੰਜ ਅਪਰਿਵਰਤਿਤ ਰਹੇਗਾ, ਜਦ ਕਿ ਫਲਾਸਕ ਦੇ ਅੰਦਰ ਪਈਆਂ ਵਿੱਚ ਪਰਿਵਰਤਨ ਹੋ ਗਿਆ ਹੈ । ਇਸ ਤੋਂ ਪਦਾਰਥ ਦਾ ਪੁੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਸਿੱਧ ਹੁੰਦਾ ਹੈ ।
(ii) ਸਥਿਰ ਅਨੁਪਾਤ ਦਾ ਨਿਯਮ – ਇਸ ਨਿਯਮ ਦਾ ਫਰਾਂਸ ਦੇ ਵਿਗਿਆਨਿਕ ਜੇ. ਐੱਲ. ਪਉਸਟ (J. L. Proust) ਨੇ 1799 ਈ: ਵਿੱਚ ਪ੍ਰਤਿਪਾਦਨ ਕੀਤਾ । ਇਸ ਨਿਯਮ ਅਨੁਸਾਰ-
‘‘ਹਰੇਕ ਰਸਾਇਣਿਕ ਯੌਗਿਕ ਵਿੱਚ ਭਾਵੇਂ ਉਹ ਕਿਸੇ ਵੀ ਵਿਧੀ ਦੁਆਰਾ ਬਣਾਇਆ ਜਾਂ ਪ੍ਰਾਪਤ ਕੀਤਾ ਗਿਆ ਹੋਵੇ, ਉਪਸਥਿਤ ਸੰਘਟਕ ਤੱਤਾਂ ਦੇ ਪੁੰਜ ਇੱਕ ਨਿਸਚਿਤ ਅਨੁਪਾਤ ਵਿੱਚ ਹੁੰਦੇ ਹਨ ।”
ਇਸ ਨਿਯਮ ਤੋਂ ਇਹ ਸਪੱਸ਼ਟ ਹੁੰਦਾ ਹੈ ਕਿ ਹਰੇਕ ਯੋਗਿਕ ਦੀ ਰਸਾਇਣਿਕ ਸੰਰਚਨਾ ਨਿਸ਼ਚਿਤ ਰਹਿੰਦੀ ਹੈ, ਜੋ ਉਸ ਨੂੰ ਬਣਾਉਣ ਦੀ ਵਿਧੀ ਜਾਂ ਸਰੋਤ ‘ਤੇ ਨਿਰਭਰ ਨਹੀਂ ਕਰਦੀ ਹੈ ।
ਉਦਾਹਰਨ – ਪਾਣੀ (H2O), ਹਾਈਡੋਜਨ ਅਤੇ ਆਕਸੀਜਨ ਤੱਤਾਂ ਦੇ ਸੰਯੋਗ ਤੋਂ ਬਣਿਆ ਹੋਇਆ ਯੌਗਿਕ ਹੈ । ਪਾਣੀ ਵੱਖ-ਵੱਖ ਵਿਧੀਆਂ ਦੁਆਰਾ ਬਣਾਇਆ ਜਾ ਸਕਦਾ ਹੈ ਅਤੇ ਪ੍ਰਕਿਰਤਿਕ ਸਾਧਨਾਂ ਦੁਆਰਾ ਵੀ ਪ੍ਰਾਪਤ ਕੀਤਾ ਜਾ ਸਕਦਾ ਹੈ । ਕਿਸੇ ਵੀ ਤਰ੍ਹਾਂ ਪ੍ਰਾਪਤ ਹੋਏ ਪਾਣੀ ਦਾ ਵਿਸ਼ਲੇਸ਼ਣ ਕਰਨ ‘ਤੇ ਗਿਆਤ ਹੁੰਦਾ ਹੈ ਕਿ ਹਾਈਡ੍ਰੋਜਨ ਅਤੇ ਆਕਸੀਜਨ ਭਾਰ ਦੀ ਦ੍ਰਿਸ਼ਟੀ ਤੋਂ 1 : 8 ਦੇ ਅਨੁਪਾਤ ਵਿੱਚ ਸੰਯੁਕਤ ਹਨ ।
![]()
ਪ੍ਰਸ਼ਨ 2.
ਡਾਲਟਨ ਦੇ ਪਰਮਾਣੁ ਸਿਧਾਂਤ ਦੀ ਵਿਵੇਚਨਾ ਕਰੋ ।
ਉੱਤਰ-
ਡਾਲਟਨ ਦੇ ਪਰਮਾਣੁ ਸਿਧਾਂਤ ਦੇ ਅਨੁਸਾਰ ਸਾਰੇ ਤੱਤ, ਯੌਗਿਕ ਅਤੇ ਮਿਸ਼ਰਣ ਸੂਖ਼ਮ ਕਣਾਂ ਤੋਂ ਬਣੇ ਹੁੰਦੇ ਹਨ । ਇਹਨਾਂ ਸੂਖ਼ਮ ਕਣਾਂ ਨੂੰ ਪਰਮਾਣੂ ਕਹਿੰਦੇ ਹਨ । ਡਾਲਟਨ ਦੇ ਪਰਮਾਣੂ ਸਿਧਾਂਤ ਦੀ ਵਿਵੇਚਨਾ ਹੇਠ ਲਿਖੇ ਅਨੁਸਾਰ ਕੀਤੀ ਜਾ ਸਕਦੀ ਹੈ-
- ਸਾਰੇ ਪਦਾਰਥ ਪਰਮਾਣੂਆਂ ਤੋਂ ਬਣਦੇ ਹਨ ।
- ਪਰਮਾਣੂ ਅਵਿਭਾਜ ਸੂਖ਼ਮਤਮ ਕਣ ਹੁੰਦੇ ਹਨ ਜਿਨ੍ਹਾਂ ਦਾ ਰਸਾਣਿਇਕ ਕਿਰਿਆ ਵਿੱਚ ਨਾ ਤਾਂ ਸਿਰਜਨ ਹੁੰਦਾ ਹੈ ਅਤੇ ਨਾ ਹੀ ਵਿਨਾਸ਼ ਹੁੰਦਾ ਹੈ ।
- ਕਿਸੇ ਤੱਤਾਂ ਦੇ ਸਾਰੇ ਪਰਮਾਣੂਆਂ ਦੇ ਪੁੰਜ ਅਤੇ ਗੁਣ ਸਮਾਨ ਹੁੰਦੇ ਹਨ ।
- ਵੱਖ-ਵੱਖ ਤੱਤ ਦੇ ਪਰਮਾਣੂਆਂ ਦੇ ਪੁੰਜ ਅਤੇ ਰਸਾਇਣਿਕ ਗੁਣ ਵੱਖ-ਵੱਖ ਹੁੰਦੇ ਹਨ ।
- ਵੱਖ-ਵੱਖ ਤੱਤਾਂ ਦੇ ਪ੍ਰਮਾਣੂ ਆਪਸ ਵਿੱਚ ਇੱਕ ਪੂਰਨ ਸੰਖਿਆ ਦੇ ਅਨੁਪਾਤ ਵਿੱਚ ਸੰਯੋਗ ਕਰਕੇ ਯੌਗਿਕ ਬਣਾਉਂਦੇ ਹਨ ।
- ਕਿਸੇ ਵੀ ਯੌਗਿਕ ਦੇ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ ਅਤੇ ਕਿਸਮਾਂ ਨਿਸਚਿਤ ਹੁੰਦੀਆਂ ਹਨ ।
ਪ੍ਰਸ਼ਨ 3.
ਪਰਮਾਣੂ ਪੁੰਜ ਨੂੰ ਪਰਿਭਾਸ਼ਿਤ ਕਰੋ | ਗਰਾਮ ਪਰਮਾਣੂ ਪੁੰਜ ਕਿਸ ਨੂੰ ਆਖਦੇ ਹਨ ?
ਜਾਂ
ਪਰਮਾਣੂ ਪੁੰਜ ਦਰਸਾਉਣ ਦਾ ਆਧੁਨਿਕ ਪੈਮਾਨਾ ਕੀ ਹੈ ? ਇਸ ਪੈਮਾਨੇ ‘ਤੇ ਤੁਸੀਂ ਕਿਸੇ ਤੱਤ ਦਾ ਔਸਤ ਸਾਪੇਖ ਪਰਮਾਣੂ ਪੰਜ ਕਿਸ ਤਰ੍ਹਾਂ ਵਿਅਕਤ ਕਰ ਸਕਦੇ ਹੋ ?
ਉੱਤਰ-
ਪਰਮਾਣੂ ਪੰਜ- ਕਿਸੇ ਤੱਤ ਦਾ ਛੋਟੇ ਤੋਂ ਛੋਟਾ ਕਣ ਪਰਮਾਣੁ ਅਖਵਾਉਂਦਾ ਹੈ ਅਤੇ ਉਹ ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਵਿੱਚ ਭਾਗ ਲੈਂਦਾ ਹੈ | ਪਰਮਾਣੁ ਸੁਖ਼ਤਮ ਕਣ ਹੁੰਦਾ ਹੈ ਅਤੇ ਇਸ ਦਾ ਵਾਸਤਵਿਕ ਪੁੱਜ ਗਿਆਤ ਕਰਨਾ ਮੁਸ਼ਕਿਲ ਹੁੰਦਾ ਹੈ । ਤੱਤਾਂ ਦੇ ਪਰਮਾਣੂ ਪੁੰਜ ਤੋਂ ਉਹਨਾਂ ਦੇ ਸਾਪੇਖ ਪੁੰਜ ਦਾ ਪਤਾ ਲਗਦਾ ਹੈ । ‘ਹਾਈਡੋਜਨ ਦਾ ਪਰਮਾਣੁ ਸਭ ਤੋਂ ਹਲਕਾ ਹੁੰਦਾ ਹੈ, ਇਸ ਲਈ ਇਸ ਦੇ ਪਰਮਾਣੁ ਪੁੰਜ ਨੂੰ ਇਕਾਈ ਮੰਨ ਕੇ ਹੋਰ ਤੱਤਾਂ ਦੇ ਸਾਪੇਖ ਪੁੱਜ ਗਿਆਤ ਕੀਤੇ ਜਾ ਸਕਦੇ ਹਨ ਅਤੇ ਇਹਨਾਂ ਨੂੰ ਪਰਮਾਣੂ ਪੁੰਜ ਕਿਹਾ ਜਾਂਦਾ ਹੈ ।
ਇਸ ਲਈ ਕਿਸੇ ਤੱਤ ਦਾ ਪਰਮਾਣੁ ਪੁੰਜ ਉਹ ਸੰਖਿਆ ਹੈ, ਜੋ ਇਹ ਦਰਸਾਉਂਦੀ ਹੈ ਕਿ ਉਸ ਤੱਤ ਦਾ ਇੱਕ ਪਰਮਾਣੂ ਹਾਈਡ੍ਰੋਜਨ ਦੇ ਇੱਕ ਪਰਮਾਣੂ ਤੋਂ ਕਿੰਨੇ ਗੁਣਾਂ ਭਾਰੀ ਹੈ ?

ਕੁੱਝ ਵਿਗਿਆਨਿਕਾਂ ਨੇ ਆਪਣੇ ਕੀਤੇ ਗਏ ਪ੍ਰਯੋਗਾਂ ਦੇ ਆਧਾਰ ‘ਤੇ ਪਰਮਾਣੂ ਪੁੰਜ ਦੀ ਇਕਾਈ ਹਾਈਡੋਜਨ ਦੇ ਇੱਕ ਪਰਮਾਣੂ ਦੇ ਪੁੰਜ ਦੀ ਥਾਂ ‘ਤੇ ਆਕਸੀਜਨ ਦੇ ਪਰਮਾਣੂ ਪੁੰਜ ਦੇ ਸੋਲ੍ਹਵੇਂ ਭਾਗ (\(\frac{1}{16}\)) ਨੂੰ ਜ਼ਿਆਦਾ ਸਹੀ ਮੰਨਿਆ ਹੈ ।

ਹੁਣ ਪਰਮਾਣੂ ਪੁੰਜ ਦਾ ਆਕਸੀਜਨ ਮਾਨਕ ਵੀ ਮੰਨਿਆ ਨਹੀਂ ਜਾ ਰਿਹਾ ਹੈ, ਕਿਉਂਕਿ ਆਕਸੀਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ ਇਸਦੇ ਤਿੰਨ ਸਮਸਥਾਨਿਕਾਂ ਦਾ ਔਸਤ ਪੁੰਜ ਹੁੰਦਾ ਹੈ । ਇਸ ਲਈ ਆਕਸੀਜਨ ਨੂੰ ਵਿਸ਼ਵਾਸ ਕਰਨ ਯੋਗ ਨਾ ਸਮਝ ਕੇ ਵਿਗਿਆਨਿਕਾਂ ਨੇ -12 ਨੂੰ ਮਾਨਕ ਦੇ ਰੂਪ ਵਿੱਚ ਨਿਰਧਾਰਿਤ ਕੀਤਾ ਹੈ । ਇਸ ਲਈ ਕਿਸੇ ਵੀ ਤੱਤ ਦਾ ਪਰਮਾਣੂ-ਪੁੰਜ ਇਸਦੇ ਪਰਮਾਣੂ ਦਾ ਔਸਤ ਸਾਪੇਖ ਪੁੰਜ ਹੁੰਦਾ ਹੈ, ਜਦਕਿ ਉਸਦੀ ਤੁਲਨਾ ਕਾਰਬਨ ਪਰਮਾਣੂ (C-12 ਆਇਸੋਟੋਪ) ਦਾ ਪੁੰਜ 12 ਮੰਨ ਕੇ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।

ਗਰਾਮ ਪਰਮਾਣੂ ਪੰਜ – ਜਦੋਂ ਪਰਮਾਣੂ ਪੁੰਜ ਨੂੰ ਗਰਾਮਾਂ ਵਿੱਚ ਪ੍ਰਗਟ ਕਰਦੇ ਹਾਂ ਤਾਂ ਉਹ ਗਰਾਮ ਪਰਮਾਣੂ ਪੁੰਜ ਕਹਾਉਂਦਾ ਹੈ ।
ਉਦਾਹਰਨ – ਕੈਲਸ਼ੀਅਮ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ 40 ਹੈ ਅਤੇ ਇਸ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ 40 ਗਰਾਮ ਹੈ ।
ਪ੍ਰਸ਼ਨ 4.
ਸਰਲ ਯੌਗਿਕਾਂ ਦੇ ਸੂਤਰ (ਰਸਾਇਣਿਕ ਫਾਰਮੂਲੇ) ਕਿਸ ਤਰ੍ਹਾਂ ਲਿਖੇ ਜਾਂਦੇ ਹਨ ? ਸਪੱਸ਼ਟ ਕਰੋ ।
ਉੱਤਰ-
ਰਸਾਇਣਿਕ ਸੂਤਰ ਲਿਖਣਾ – ਦੋ ਵੱਖ-ਵੱਖ ਤੱਤਾਂ ਤੋਂ ਬਣੇ ਹੋਏ ਯੌਗਿਕਾਂ ਨੂੰ ਦੋ-ਅੰਗੀ ਯੌਗਿਕ ਆਖਦੇ ਹਨ । ਅਣਵੀਂ ਯੌਗਿਕਾਂ ਦੇ ਰਸਾਇਣਿਕ ਸੂਤਰ ਲਿਖਦੇ ਸਮੇਂ ਅਸੀਂ ਪਹਿਲਾਂ ਸੰਘਟਕ ਤੱਤਾਂ ਦੇ ਸੰਕੇਤ ਲਿਖ ਕੇ ਉਹਨਾਂ ਦੀਆਂ ਸੰਯੋਜਕਤਾ ਲਿਖੀਆਂ ਜਾਂਦੀਆਂ ਹਨ, ਜਿਵੇਂ ਕਿ ਹੇਠਾਂ ਦਿੱਤੀਆਂ ਉਦਾਹਰਨਾਂ ਵਿੱਚ ਪ੍ਰਗਟਾਇਆ ਗਿਆ ਹੈ । ਉਸ ਤੋਂ ਬਾਅਦ ਜੁੜਨ ਵਾਲੇ ਸੰਯੋਜਿਤ) ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਯੋਜਕਤਾ ਨੂੰ ਕਰਾਸ ਕਰਕੇ ਅਣੂ ਸੂਤਰ ਲਿਖਦੇ ਹਾਂ ।
ਉਦਾਹਰਨ
1. ਹਾਈਡੋਜਨ ਕਲੋਰਾਈਡ ਦਾ ਸੂਤਰ :

ਇਸ ਤਰ੍ਹਾਂ ਹਾਈਜਨ ਕਲੋਰਾਈਡ ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ HCl ਹੈ ।
2. ਸੋਡੀਅਮ ਸਲਫਾਈਟ ਦਾ ਸੂਤਰ :

ਇਸ ਤਰ੍ਹਾਂ ਸੋਡੀਅਮ ਸਲਫਾਈਟ ਦਾ ਸੂਤਰ Na2SO3 ਹੈ ।
3. ਕਾਰਬਨ ਟੈਕਲੋਰਾਈਡ ਦਾ ਸੂਤਰ :
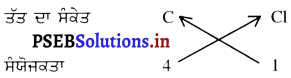
ਇਸ ਤਰ੍ਹਾਂ ਕਾਰਬਨ ਟੈਕਲੋਰਾਈਡ ਦਾ ਸੂਤਰ: CCl4 ਹੈ ।
4. ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ ਦਾ ਸੂਤਰ :

ਇਸ ਤਰ੍ਹਾਂ ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ ਦਾ ਸੂਤਰ Al2O3 ਹੈ ।
5. ਕੈਲਸ਼ੀਅਮ ਆਕਸਾਈਡ ਦਾ ਸੂਤਰ :

ਇਸ ਤਰ੍ਹਾਂ ਕੈਲਸ਼ੀਅਮ ਆਕਸਾਈਡ ਦਾ ਸੂਤਰ Ca2O2 ਜੋ ਸਰਲ ਕਰਕੇ Ca0 ਹੈ ।
ਬਹੁ-ਪਰਮਾਣਵੀਂ ਆਇਨਾਂ ਵਾਲੇ ਯੌਗਿਕ
1. ਸੋਡੀਅਮ ਨਾਈਟ ਦਾ ਸੂਤਰ:

ਇਸ ਤਰ੍ਹਾਂ ਸੋਡੀਅਮ ਨਾਈਟ੍ਰੇਟ ਦਾ ਸੂਤਰ NaNO3 ਹੈ ।
2. ਕੈਲਸ਼ੀਅਮ ਹਾਈਡੋਕਸਾਈਡ ਦਾ ਸੂਤਰ :
ਕੈਲਸ਼ੀਅਮ ਹਾਈਡ੍ਰੋਕਸਾਈਡ ਵਿੱਚ ਹਾਈਬ੍ਰੋਕਸਾਈਡ ਆਇਨ (OH ) ਦੋ ਆਇਨਾਂ ਤੋਂ ਬਣਿਆ ਹੋਇਆ ਹੈ । ਜਦੋਂ ਸੂਤਰ ਵਿੱਚ ਇੱਕ ਹੀ ਆਇਨ ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਆਇਨ ਹੁੰਦੇ ਹਨ ਤਾਂ ਉਨ੍ਹਾਂ ਲਈ ਬਰੈਕਟ ਦੀ ਵਰਤੋਂ ਕੀਤੀ ਜਾਂਦੀ ਹੈ ।
ਇੱਥੇ OH ਨੂੰ ਬਰੈਕਟ ਵਿੱਚ ਰੱਖ ਕੇ ਪਦ ਅੰਕ 2 ਲਗਾਉਂਦੇ ਹਾਂ ਜੋ ਇਹ ਦੱਸਦਾ ਹੈ ਕਿ ਕੈਲਸ਼ੀਅਮ ਪਰਮਾਣੂ ਦੋ OH ਗਰੁੱਪਾਂ ਨਾਲ ਜੁੜਿਆ ਹੋਇਆ ਹੈ ।

ਇਸ ਤਰ੍ਹਾਂ ਕੈਲਸ਼ੀਅਮ ਹਾਈਡੋਕਸਾਈਡ ਦਾ ਸੂਤਰ Ca(OH)2 ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 5.
ਮੋਲ ਸੰਕਲਪ ਕੀ ਹੈ ? ਇਸ ਦੀ ਜ਼ਰੂਰਤ ਤੇ ਪ੍ਰਕਾਸ਼ ਪਾਉਂਦੇ ਹੋਏ ਮੋਲਰ ਪੁੰਜ ਨੂੰ ਪਰਿਭਾਸ਼ਿਤ ਕਰੋ ।
ਉੱਤਰ-
ਮੋਲ ਸੰਕਲਪਨਾ-ਰਸਾਇਣ ਵਿਗਿਆਨ ਵਿੱਚ ਅਤਿ ਸੂਖ਼ਮ ਸਤਰ ਦੇ ਕਣਾਂ (ਜਿਵੇਂ-ਪਰਮਾਣੂਆਂ, ਅਣੂਆਂ, ਕਣਾਂ, ਇਲੈੱਕਟਾਨਾਂ ਆਦਿ) ਨੂੰ ਸੰਖਿਆ ਗਿਆਤ ਕਰਨ ਲਈ ਰਸਾਇਣ ਵਿਗਿਆਨਿਕਾਂ ਨੂੰ ਇੱਕ ਮਾਨਕ ਮਾਤਿਕ ਦੀ ਲੋੜ ਮਹਿਸੂਸ ਹੋਈ । ਇਸ ਲਈ ਸੰਕਲਪਨਾ ਦਾ ਜਨਮ ਹੋਇਆ । ਮੋਲ ਸੰਕਲਪਨਾ ਦੇ ਅਨੁਸਾਰ, “ਕਿਸੇ ਪਦਾਰਥ ਦਾ ਇੱਕ ਮੋਲ ਉਹ ਮਾਤਰਾ ਹੈ ਜਿਸ ਵਿੱਚ ਓਨੇ ਹੀ ਕਣ ਉਪਸਥਿਤ ਹੁੰਦੇ ਹਨ ਜਿੰਨੇ ਕਾਰਬਨ-12 ਸਮਸਥਾਨਿਕ ਦੋ 12 ਗ੍ਰਾਮ ਵਿੱਚ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ ਹੁੰਦੀ ਹੈ ।”
ਕਿਸੇ ਪਦਾਰਥ ਦੇ ਇੱਕ ਮੋਲ ਵਿੱਚ ਕਣਾਂ ਦੀ ਸੰਖਿਆ ਹਮੇਸ਼ਾ ਇੱਕੋ ਜਿੰਨੀ ਹੀ ਹੋਵੇਗੀ ਭਾਵੇਂ ਉਹ ਕੋਈ ਵੀ ਪਦਾਰਥ ਕਿਉਂ ਨਾ ਹੋਵੇ । ਇਸ ਸੰਖਿਆ ਦੇ ਸਹੀ ਨਿਰਧਾਰਨ ਲਈ ਕਾਰਬਨ-12 ਪਰਮਾਣੁ ਦਾ ਪੁੰਜ ਸਪੈਕਟੋਸਕੋਪੀ ਦੁਆਰਾ ਗਿਆਤ ਕੀਤਾ ਗਿਆ ਜਿਸਦਾ ਮਾਨ 1.992648 × 10-23 ਗਰਮ ਸੀ । ਕਾਰਬਨ ਦੇ 1 ਮੋਲ ਦਾ ਪੁੰਜ 12 ਗਰਾਮ ਹੁੰਦਾ ਹੈ । ਇਸ ਲਈ ਕਾਰਬਨ ਦੇ 1 ਮੋਲ ਵਿੱਚ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ ਇੰਝ ਹੋਵੇਗੀ ।

= 6.0221367 × 1023
= 6.022 × 1023 ਪਰਮਾਣੂ/ਮੋਲ
ਇਸ ਸੰਖਿਆ ਨੂੰ ਆਵੋਗਾਦਰੋ ਸੰਖਿਆ ਕਹਿੰਦੇ ਹਨ ਅਤੇ ‘N’ ਜਾਂ NA ਨਾਲ ਪ੍ਰਦਰਸ਼ਿਤ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
ਮੋਲ ਸੰਕਲਪਨਾ ਦੀ ਜ਼ਰੂਰਤ – ਪਰਮਾਣੁ ਅਤੇ ਅਣੁ ਆਕਾਰ ਵਿੱਚ ਬਹੁਤ ਸੂਖ਼ਮ ਹੁੰਦੇ ਹਨ ਅਤੇ ਕਿਸੇ ਪਦਾਰਥ ਦੀ ਬਹੁਤ ਘੱਟ ਮਾਤਰਾ ਵਿੱਚ ਇਹਨਾਂ ਦੀ ਸੰਖਿਆ ਬਹੁਤ ਜ਼ਿਆਦਾ ਹੋ ਜਾਂਦੀ ਹੈ । ਇੰਨੀ ਵੱਡੀ ਸੰਖਿਆ ਨਾਲ ਕੰਮ ਕਰਨ ਲਈ ਇੰਨੇ ਹੀ ਪਰਿਮਾਣ ਦੇ ਮਾਤਕ ਦੀ ਲੋੜ ਹੁੰਦੀ ਹੈ । ਮੋਲ ਸੰਕਲਪਨਾ ਅਨੁਸਾਰ 12 ਗ੍ਰਾਮ ਕਾਰਬਨ ਵਿੱਚ 6.022 × 1023 ਕਾਰਬਨ ਪਰਮਾਣੂ ਹੁੰਦੇ ਹਨ ਜਿਨ੍ਹਾਂ ਨੂੰ ਗਿਣਨਾ ਸੰਭਵ ਨਹੀਂ ਹੈ । ਇਸ ਲਈ ਇਹਨਾਂ ਦੀ ਸੰਖਿਆ ਨੂੰ ਮੋਲ ਵਿੱਚ ਵਿਅਕਤ ਕਰਕੇ ਕੰਮ ਸੌਖਾ ਹੋ ਜਾਂਦਾ ਹੈ ।
ਉਦਾਹਰਨ ਵਜੋਂ :
1 ਮੋਲ ਆਕਸੀਜਨ ਵਿੱਚ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ = 6.022 × 1023
∴ 3 ਮੋਲ ਆਕਸੀਜਨ ਵਿੱਚ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ = 3 × 6.022 × 1023
= 1.81 × 1024 ਪਰਮਾਣੂ
ਇਸ ਤਰ੍ਹਾਂ 1.81 × 1024 ਪਰਮਾਣੁ ਕਹਿਣਾ ਔਖਾ ਹੈ ਪਰ 3 ਮੋਲ ਕਹਿਣਾ ਬਹੁਤ ਹੀ ਸਰਲ ਹੈ । ਮੋਲਰ ਪੰਜ-ਕਿਸੇ ਪਦਾਰਥ ਦੇ । ਮੋਲ ਨੂੰ ਗ੍ਰਾਮ ਵਿੱਚ ਵਿਅਕਤ ਪੁੰਜ ਨੂੰ ਉਸ ਦਾ ਮੋਲਰ ਪੰਜ ਆਖਦੇ ਹਨ ।
ਗਰਾਮਾਂ ਵਿੱਚ ਵਿਅਕਤ ਕੀਤਾ ਗਿਆ ਮੋਰ ਪੁੰਜ ਸੰਖਿਆਤਮਕ ਰੂਪ ਵਿੱਚ ਪਰਮਾਣੂ ਪੁੰਜ ਜਾਂ ਅਣਵੀਂ ਪੰਜ ਜਾਂ ਸੂਤਰ ਪੁੰਜ ਦੇ ਬਰਾਬਰ ਹੁੰਦਾ ਹੈ ।
ਛੋਟੇ ਉੱਤਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ (Short Answer Type Questions)
ਪ੍ਰਸ਼ਨ 1.
‘‘ਉੱਚ ਤਾਪ ਤੇ ਹਵਾ ਵਿੱਚ ਚੂਨੇ ਦੇ ਪੱਥਰ (CaCO)3 ਨੂੰ ਗਰਮ ਕਰਨ ‘ਤੇ ਇਸ ਦਾ ਪੁੰਜ ਘੱਟ ਜਾਂਦਾ ਹੈ ਪਰੰਤੂ ਲੋਹੇ ਦਾ ਪੁੰਜ ਵੱਧ ਜਾਂਦਾ ਹੈ’’ ਇਹ ਤੱਥ ਪੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਕਿਵੇਂ ਕਰਦੇ ਹਨ ?
ਉੱਤਰ-
ਚੂਨੇ ਦੇ ਪੱਥਰ (CaCO)3 ਨੂੰ ਗਰਮ ਕਰਨ ‘ਤੇ ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਪ੍ਰਾਪਤ ਹੁੰਦੀ ਹੈ ।
![]()
ਕਿਉਂਕਿ CO2 ਗੈਸ ਬਾਹਰ ਨਿਕਲ ਜਾਂਦੀ ਹੈ, ਇਸ ਲਈ CaCO3 ਦੇ ਪੁੰਜ ਵਿੱਚ ਘਾਟ ਆ ਜਾਂਦੀ ਹੈ । ਅਭਿਕਾਰਕ ਪਦਾਰਥ CaCO3 ਅਤੇ ਉਪਜਾਂ (Ca + CO2 ) ਦੇ ਪੁੰਜ ਬਰਾਬਰ ਹੀ ਰਹਿੰਦੇ ਹਨ । ਇਸ ਲਈ ਇਸ ਤੋਂ ਪੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਹੁੰਦੀ ਹੈ ।
ਹੁਣ ਲੋਹੇ ਨੂੰ ਗਰਮ ਕਰਨ ਤੇ ਲੋਹੇ ਦਾ ਆਂਕਸਾਈਡ (FO2 O3 ) ਬਣਦਾ ਹੈ
4Fe + 3O2 → 2Fe2 O2
ਇਸ ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਅਨੁਸਾਰ ਲੋਹੇ ਦੇ ਆਕਸੀਕਰਨ ਹੋਣ ਕਾਰਨ ਪੁੰਜ ਵੱਧ ਜਾਂਦਾ ਹੈ, ਪਰੰਤੂ ਅਭਿਕਾਰਕਾਂ (Fe ਅਤੇ O2 ) ਅਤੇ ਉਪਜ (Fe3O3) ਦਾ ਪੁੰਜ ਬਰਾਬਰ ਹੀ ਰਹਿੰਦਾ ਹੈ ।
ਇਨ੍ਹਾਂ ਤੱਥਾਂ ਤੋਂ ਇਹ ਪੁੰਜ ਪ੍ਰਗਟ ਹੁੰਦਾ ਹੈ ਕਿ ਪਦਾਰਥ ਨਾ ਤਾਂ ਨਸ਼ਟ ਹੋ ਸਕਦਾ ਹੈ ਅਤੇ ਨਾ ਹੀ ਇਸ ਦਾ ਸਿਰਜਣ ਕੀਤਾ ਜਾ ਸਕਦਾ ਹੈ ਸਿਰਫ਼ ਉਸ ਦੇ ਰੂਪ ਵਿੱਚ ਪਰਿਵਰਤਨ ਹੁੰਦਾ ਹੈ । ਇਸ ਲਈ ਇਸ ਤੋਂ ਪੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਹੁੰਦੀ ਹੈ ।
ਪ੍ਰਸ਼ਨ 2.
ਪਰਮਾਣੂ ਪੁੰਜ ਇਕਾਈ (a.m.u.) ਤੋਂ ਤੁਹਾਡਾ ਕੀ ਭਾਵ ਹੈ ?
ਉੱਤਰ-
ਪਰਮਾਣੂ ਪੁੰਜ ਇਕਾਈ (a.m.u.) – ਅੱਜ-ਕਲ੍ਹ ਪਰਮਾਣੂ ਪੁੰਜ ਨੂੰ ਕਾਰਬਨ-12 ਪਰਮਾਣੂ (6C12)
ਦੇ ਪੁੰਜ ਦੇ ਸਾਪੇਖ ਵਿਅਕਤ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਪਰਮਾਣੁ ਪੁੰਜ ਮਾਤਕ ਨੂੰ a.m.u. ਨਾਲ ਪਰਦਰਸ਼ਿਤ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਕਾਰਬਨ-12 ਦੇ ਇੱਕ ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ ਆਪਣੀ ਮਰਜ਼ੀ ਨਾਲ 12 am.u. ਮੰਨ ਲਿਆ ਗਿਆ ਹੈ । ਇਸ ਲਈ ਕਾਰਬਨ-12 ਦੇ ਇੱਕ ਪਰਮਾਣੂ ਦੇ ਪੁੰਜ ਦੇ ਬਾਹਰਵੇਂ (\(\frac{1}{12}\)) ਭਾਗ ਨੂੰ ਪਰਮਾਣੂ ਪੰਜ ਇਕਾਈ ਆਖਦੇ ਹਨ ।
ਪਰਮਾਣੂ ਪੁੰਜ ਇਕਾਈ ( 1a.m.u.) = \(\frac{1}{12}\) × ਕਾਰਬਨ -12 ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ
ਕਾਰਬਨ 12 ਦੇ ਇੱਕ ਪਰਮਾਣੂ ਦਾ ਵਾਸਤਵਿਕ ਪੁੰਜ 1.9926 × 10-23 ਗ੍ਰਾਮ ਹੁੰਦਾ ਹੈ ਜੋ 12 a.m.u. ਦੇ ਬਰਾਬਰ ਹੈ ।
∴ 1a.m.u = \(\frac{1.9926 \times 10^{-23}}{12}\)
= 1.66 × 10-24 ਗ੍ਰਾਮ ।
1.66 × 10-24 ਗ੍ਰਾਮ ਨੂੰ a.m.u ਦਾ ਗਾਮ ਤੁਲ-ਅੰਕ ਕਹਿੰਦੇ ਹਨ ।
ਤੱਤਾਂ ਦੇ ਵਿਭਿੰਨ ਸਮਸਥਾਨਿਕਾਂ ਦੇ ਪਰਮਾਣੂਆਂ ਦੇ ਪੁੰਜ ਅਤੇ ਸਾਰੇ ਪਰਮਾਣਵੀਂ ਕਣਾਂ ਦੇ ਪੁੰਜ ਆਮ ਤੌਰ ‘ਤੇ a.m.u ਵਿੱਚ ਪਰਦਰਸ਼ਿਤ ਕੀਤੇ ਜਾਂਦੇ ਹਨ । ਉਦਾਹਰਨ ਵਜੋਂ 7N14 ਦੇ ਇੱਕ ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ = 14.0032 a.m.u.
1 ਇਲੈੱਕਟ੍ਰਾਨ ਦਾ ਪੁੰਜ = 0.0005486 a.m.u.
ਪ੍ਰਸ਼ਨ 3.
ਕੁੱਝ ਤੱਤਾਂ ਦੇ ਪਰਮਾਣੂ ਪੁੰਜ ਪੁਰਣਾਂਕ ਨਹੀਂ ਹੁੰਦੇ ਹਨ । ਕਿਉਂ ?
ਉੱਤਰ-
ਕਿਸੇ ਤੱਤ ਦਾ ਪਰਮਾਣੁ ਪੁੰਜ ਉਸ ਦੇ ਸਮਸਥਾਨਿਕਾਂ ਦੇ ਪਰਮਾਣੂ ਪੰਜਾਂ ਦੇ ਸਾਪੇਖ ਔਸਤ ਪੁੰਜ ਹੁੰਦਾ ਹੈ । ਇਹ ਹਮੇਸ਼ਾ ਪੂਰਨ ਅੰਕ ਨਹੀਂ ਹੁੰਦਾ ਹੈ ਅਤੇ ਇਸੇ ਕਾਰਨ ਕੁੱਝ ਤੱਤਾਂ ਦੇ ਪਰਮਾਣੁ ਪੰਜ ਪੁਰਣੀਕ ਨਹੀਂ ਹੁੰਦੇ ਹਨ । ਉਦਾਹਰਨ ਵਜੋਂ ਕਲੋਰੀਨ ਦੇ ਦੋ ਸਮਸਥਾਨਿਕ ਹਨ । ਕਲੋਰੀਨ ਦਾ 75 ਅਜਿਹਾ ਹੈ ਜਿਸ ਦਾ ਪਰਮਾਣੁ ਪੁੰਜ 35 ਹੈ ਅਤੇ 25% ।ਕਲੋਰੀਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ 37 ਹੈ । ਇਸ ਲਈ ਕਲੋਰੀਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ 35.5 ਹੈ ।
ਕਲੋਰੀਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = \(\frac{3 \times 35+1 \times 37}{4}\)
= \(\frac{105+37}{4}\)
= \(\frac{142}{4}\)
= 35.5
ਪ੍ਰਸ਼ਨ 4.
ਤੱਤਾਂ ਦੇ ਅਣੂਆਂ ਦੀਆਂ ਵਿਸ਼ੇਸ਼ਤਾਈਆਂ ਦੱਸੋ ।
ਉੱਤਰ-
ਤੱਤਾਂ ਦੀਆਂ ਵਿਸ਼ੇਸ਼ਤਾਈਆਂ-
- ਕਿਸੇ ਤੱਤ ਦੇ ਅਣੂ ਇੱਕ ਹੀ ਕਿਸਮ ਦੇ ਪਰਮਾਣੁਆਂ ਦੁਆਰਾ ਰਚਿਤ ਹੁੰਦੇ ਹਨ ।
- ਅਧਾਤਾਂ ਦੇ ਅਣੂ ਇੱਕ ਤੋਂ ਵੱਧ ਪਰਮਾਣੂਆਂ ਤੋਂ ਬਣਦੇ ਹਨ, ਜਿਵੇਂ ਆਕਸੀਜਨ ਅਣੂ ਦੋ ਆਕਸੀਜਨ ਪਰਮਾਣੂਆਂ ਤੋਂ ਬਣਦਾ ਹੈ । ਇਸ ਲਈ O2 ਦੋ-ਪਰਮਾਣਵੀਂ ਅਣੂ ਕਹਾਉਂਦਾ ਹੈ । ਜੇਕਰ 2 ਦੀ ਥਾਂ ‘ਤੇ 3 ਆਕਸੀਜਨ ਪਰਮਾਣੂ ਆਪਸ ਵਿੱਚ ਸੰਯੋਗ ਕਰਨ ਤਾਂ ਸਾਨੂੰ ਓਜ਼ੋਨ (O3 ) ਪ੍ਰਾਪਤ ਹੁੰਦੀ ਹੈ ।
- ਕਿਸੇ ਅਣੂ ਦੀ ਸੰਰਚਨਾ ਵਿੱਚ ਵਰਤੇ ਜਾਣ ਵਾਲੇ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ ਨੂੰ ਉਸ ਅਣੂ ਦੀ ਪਰਮਾਣੂਕਤਾ ਕਹਿੰਦੇ ਹਨ ।
- ਧਾਤਵੀ ਅਣੂਆਂ ਅਤੇ ਕਾਰਬਨ ਜਿਹੇ ਹੋਰ ਤੱਤਾਂ ਦੀ ਸਰਲ ਸੰਰਚਨਾ ਨਹੀਂ ਹੁੰਦੀ ਬਲਕਿ ਉਨ੍ਹਾਂ ਦੇ ਅਣੂਆਂ ਵਿੱਚ ਅਸੀਮਿਤ ਪਰਮਾਣੂ ਆਪਸ ਵਿੱਚ ਬੰਨ੍ਹੇ ਹੁੰਦੇ ਹਨ ।
![]()
ਪ੍ਰਸ਼ਨ 5.
ਸੰਕੇਤ ਕਿਸ ਆਧਾਰ ‘ਤੇ ਤਿਆਰ ਕੀਤੇ ਗਏ ਹਨ ? ਸਪੱਸ਼ਟ ਕਰੋ ।
ਉੱਤਰ-
ਅੱਜ-ਕਲ ਇੰਟਰਨੈਸ਼ਨਲ ਯੂਨੀਅਨ ਆਫ ਪਿਉਰ ਐਂਡ ਅਪਲਾਇਡ ਕੈਮਿਸਟਰੀ (IUPAC) ਤੱਤਾਂ ਦੇ ਨਾਂ ਦੀ ਮੰਜੂਰੀ ਦਿੰਦਾ ਹੈ ਜਿਸ ਲਈ ਹੇਠ ਲਿਖੇ ਸਟੈਂਡਰਡ ਪੂਰੇ ਕਰਨੇ ਲੋੜੀਂਦੇ ਹਨ ।
- ਜ਼ਿਆਦਾਤਰ ਤੱਤਾਂ ਦੇ ਸੰਕੇਤ ਉਹਨਾਂ ਤੱਤਾਂ ਦੇ ਅੰਗਰੇਜ਼ੀ ਨਾਂਵਾਂ ਦੇ ਇੱਕ ਜਾਂ ਦੋ ਅੱਖਰਾਂ ਤੋਂ ਬਣੇ ਹੁੰਦੇ ਹਨ । ਸੰਕੇਤ ਦਾ ਪਹਿਲਾ ਅੱਖਰ ਹਮੇਸ਼ਾ ਵੱਡਾ ਅਤੇ ਦੂਜਾ ਅੱਖਰ ਛੋਟਾ ਹੁੰਦਾ ਹੈ, ਜਿਵੇਂ ਆਕਸੀਜਨ ਦਾ ਸੰਕੇਤ O, ਐਲੂਮੀਨੀਅਮ ਦਾ ਸੰਕੇਤ AI ਅਤੇ ਕੋਬਾਲਟ ਦਾ ਸੰਕੇਤ CO ਹੈ ।
- ਕੁੱਝ ਤੱਤਾਂ ਦੇ ਸੰਕੇਤ ਉਹਨਾਂ ਦੇ ਅੰਗਰੇਜ਼ੀ ਨਾਂਵਾਂ ਦੇ ਪਹਿਲੇ ਅੱਖਰ ਅਤੇ ਬਾਅਦ ਵਿੱਚ ਆਉਣ ਵਾਲੇ ਕਿਸੇ ਹੋਰ ਮਹੱਤਵਪੂਰਨ ਅੱਖਰ ਨੂੰ ਜੋੜ ਕੇ ਬਣਾਉਂਦੇ ਹਨ , ਜਿਵੇਂ-ਮੈਗਨੀਜ਼ ਦਾ ਸੰਕੇਤ Mn, ਕਲੋਰੀਨ ਦਾ ਸੰਕੇਤ Cl ਅਤੇ ਜ਼ਿੰਕ ਦਾ ਸੰਕੇਤ Zn ਆਦਿ ।
- ਕੁੱਝ ਹੋਰ ਤੱਤਾਂ ਦੇ ਸੰਕੇਤਾਂ ਨੂੰ ਲੈਟਿਨ, ਜਰਮਨੀ ਅਤੇ ਸ਼੍ਰੀਕ ਭਾਸ਼ਾਵਾਂ ਵਿੱਚ ਉਹਨਾਂ ਦੇ ਨਾਂ ਤੋਂ ਲਿਆ ਗਿਆ ਹੈ, ਜਿਵੇਂ ਲੋਹਾ ਦਾ ਸੰਕੇਤ Fe ਹੈ ਜੋ ਲੈਟਿਨ ਨਾਂ ਫੈਰਮ ਤੋਂ ਕੱਢਿਆ ਗਿਆ ਹੈ । ਇਸੇ ਤਰ੍ਹਾਂ ਸੋਡੀਅਮ ਦਾ ਸੰਕੇਤ Na ਅਤੇ ਪੋਟਾਸ਼ੀਅਮ ਦਾ K ਹੈ ਜੋ ਕੁਮਵਾਰ ਨੇਟਰੀਅਮ ਅਤੇ ਕੇਲੀਅਮ ਤੋਂ ਉਤਪੰਨ ਹੋਏ ਹਨ ।
ਪ੍ਰਸ਼ਨ 6.
ਅਣੂ ਅਤੇ ਪਰਮਾਣੂ ਵਿੱਚ ਅੰਤਰ ਲਿਖੋ ।
ਉੱਤਰ-
ਅਣੂ ਅਤੇ ਪਰਮਾਣੂ ਵਿੱਚ ਅੰਤਰ-
| ਅਣੂ | ਪਰਮਾਣੂ |
| (1) ਅਣੂ ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਪਰਮਾਣੂਆਂ ਦੇ ਆਪਸੀ ਮੇਲ ਤੋਂ ਬਣਦੇ ਹਨ । | (1) ਪਰਮਾਣੂ ਰਸਾਇਣਿਕ ਕਿਰਿਆਵਾਂ ਵਿੱਚ ਭਾਗ ਲੈਣ ਵਾਲਾ ਸੂਖਮ ਕਣ ਹੈ । |
| (2) ਅਣੂ ਮੁਕਤ ਅਵਸਥਾ ਵਿੱਚ ਰਹਿ ਸਕਦੇ ਹਨ । | (2) ਇਹ ਮੁਕਤ ਅਵਸਥਾ ਵਿੱਚ ਰਹਿ ਵੀ ਸਕਦਾ ਹੈ ਅਤੇ ਨਹੀਂ ਵੀ ਰਹਿ ਸਕਦਾ ਹੈ । |
ਪ੍ਰਸ਼ਨ 7.
ਆਇਨ ਕਿਸ ਨੂੰ ਆਖਦੇ ਹਨ ? ਸਪੱਸ਼ਟ ਕਰੋ ।
ਉੱਤਰ-
ਆਇਨ-ਧਾਤ ਅਤੇ ਅਧਾਤ ਯੁਕਤ ਯੌਗਿਕ ਚਾਰਜਿਤ ਕਣਾਂ ਤੋਂ ਮਿਲ ਕੇ ਬਣੇ ਹੁੰਦੇ ਹਨ । ਇਨ੍ਹਾਂ ਚਾਰਜਿਤ ਕਣਾਂ ਨੂੰ ਆਇਨ ਆਖਦੇ ਹਨ । ਆਇਨ ਚਾਰਜਿਤ ਕਣ ਹੁੰਦੇ ਹਨ ਅਤੇ ਇਨ੍ਹਾਂ ਉੱਤੇ ਰਿਣ ਜਾਂ ਧਨ ਚਾਰਜ ਹੁੰਦਾ ਹੈ । ਰਿਣ ਚਾਰਜਿਤ ਕਣਾਂ ਨੂੰ ਰਿਣ ਆਇਨ (anion) ਅਤੇ ਧਨ ਚਾਰਜਿਤ ਕਣਾਂ ਨੂੰ ਧਨ ਆਇਨ (Cation) ਆਖਦੇ ਹਨ ।
ਉਦਾਹਰਨ ਵਜੋਂ ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ ਧਨਾਤਮਕ ਸੋਡੀਅਮ ਆਇਨ (Na+) ਅਤੇ ਰਿਣਾਤਮਕ ਕਲੋਰਾਈਡ ਆਇਨ (Cl–) ਸੰਘਟਕ ਕਣ ਦੇ ਰੂਪ ਵਿੱਚ ਮੌਜੂਦ ਹੁੰਦੇ ਹਨ । ਇਸ ਲਈ ਆਇਨ ਇੱਕ ਚਾਰਜਿਤ ਪਰਮਾਣੂ ਜਾਂ ਪਰਮਾਣੂਆਂ ਦਾ ਇੱਕ ਜਿਹਾ ਸਮੂਹ ਹੁੰਦਾ ਹੈ ਜਿਸ ਵਿੱਚ ਲੈਣ ਚਾਰਜ ਮੌਜੂਦ ਹੁੰਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 8.
ਕਿਸੇ ਤੱਤ ਦੇ ਪਰਮਾਣੂ ਅਤੇ ਉਸਦੇ ਆਇਨ ਵਿੱਚ ਅੰਤਰ ਲਿਖੋ ।
ਉੱਤਰ-
ਤੱਤ ਦੇ ਪਰਮਾਣੂ ਅਤੇ ਆਇਨ ਵਿੱਚ ਅੰਤਰ-
| ਪਰਮਾਣੂ | ਆਇਨ |
| (1) ਪਰਮਾਣੂ ਬਿਜਲੀ ਚਾਰਜ ਦੀ ਦ੍ਰਿਸ਼ਟੀ ਵਿੱਚ ਉਦਾਸੀਨ ਹੁੰਦੇ ਹਨ । | (1) ਆਇਨ ਚਾਰਜਿਤ ਕਣ ਹੁੰਦੇ ਹਨ । ਇਹ ਧਨਾਤਮਕ ਜਾਂ ਰਿਣਾਤਮਕ ਰੂਪ ਨਾਲ ਚਾਰਜਿਤ ਹੋ ਸਕਦੇ ਹਨ । |
| (2) ਪਰਮਾਣੁ ਰਸਾਇਣਿਕ ਰੂਪ ਨਾਲ ਕਿਰਿਆਸ਼ੀਲ ਹੁੰਦੇ ਹਨ ਕਿਉਂਕਿ ਇਨ੍ਹਾਂ ਦੇ ਬਾਹਰਲੇ ਸੈੱਲ ਪੂਰਨ ਰੂਪ ਨਾਲ ਭਰੇ ਨਹੀਂ ਹੁੰਦੇ । | (2) ਆਇਨ ਦੀ ਇਲੈੱਕਟਾਨੀ ਸੰਰਚਨਾ ਕਿਸੇ ਇੱਕ ਨੋਬਲ ਗੈਸ ਦੀ ਇਲੈੱਕਟਾਨੀ ਸੰਰਚਨਾ ਦੇ ਬਰਾਬਰ ਤੇ ਸਥਾਈ ਹੁੰਦੀ ਹੈ । |
| (3) ਪਰਮਾਣੂ ਵਿੱਚ ਪ੍ਰੋਟਾਨਾਂ ਅਤੇ ਇਲੈੱਕਟ੍ਰਾਨਾਂ ਦੀ ਸੰਖਿਆ ਸਮਾਨ ਹੁੰਦੀ ਹੈ । | (3) ਧਨ ਆਇਨ ਵਿੱਚ ਇਲੈੱਕਟ੍ਰਾਨ ਸੰਖਿਆ ਪ੍ਰੋਟਾਨਾਂ ਤੋਂ ਘੱਟ ਅਤੇ ਰਿਣਾਦਨ ਵਿੱਚ ਪ੍ਰੋਟਾਨਾਂ ਤੋਂ ਵੱਧ ਹੁੰਦੀ ਹੈ । |
ਪ੍ਰਸ਼ਨ 9.
Na ਪਰਮਾਣੂ ਦੀ ਤੁਲਨਾ ਵਿੱਚ Na ਆਇਨ ਸਥਾਈ ਕਿਉਂ ਹੁੰਦਾ ਹੈ ।
ਉੱਤਰ-
Na ਪਰਮਾਣੂ (2, 8, 1) ਦੇ 1 ਇਲੈੱਕਟ੍ਰਾਨ ਦੀ ਹਾਨੀ ਮਗਰੋਂ Na+ ਆਇਨ ਬਣਦਾ ਹੈ । ਇਸ ਦੀ ਇਲੈੱਕਟਾਨੀ ਬਣਤਰ (2, 8) ਹੈ । ਇਹ ਬਣਤਰ ਅਕਿਰਿਆਸ਼ੀਲ ਗੈਸ ਦੀ ਬਣਤਰ ਦੇ ਬਰਾਬਰ ਹੁੰਦੀ ਹੈ । ਇਸ ਲਈ Na+ ਆਇਨ Na ਪਰਮਾਣੁ ਦੇ ਮੁਕਾਬਲੇ ਵਿੱਚ ਜ਼ਿਆਦਾ ਸਥਾਈ ਹੁੰਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 10.
ਰਸਾਇਣਿਕ ਸੂਤਰ ਕਿਸ ਨੂੰ ਆਖਦੇ ਹਨ ? ਪਾਣੀ ਦੀ ਉਦਾਹਰਨ ਨਾਲ ਸਮਝਾਓ ਕਿ ਰਸਾਇਣਿਕ ਸੂਤਰ ਤੋਂ ਸਾਨੂੰ ਕੀ-ਕੀ ਜਾਣਕਾਰੀ ਪ੍ਰਾਪਤ ਹੁੰਦੀ ਹੈ ।
ਉੱਤਰ-
ਰਸਾਇਣਿਕ ਸੂਤਰ- “ਕਿਸੇ ਪਦਾਰਥ (ਯੋਗਿਕ) ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ ਉਸਦੇ ਸੰਘਟਕ ਤੱਤਾਂ ਦਾ ਸੰਕੇਤਕ ਨਿਰੂਪਣ ਹੁੰਦਾ ਹੈ ।
ਰਸਾਇਣਿਕ ਸੂਤਰ ਦੀ ਮਹੱਤਤਾ ਜਾਂ ਸੂਤਰ ਤੋਂ ਪ੍ਰਾਪਤ ਜਾਣਕਾਰੀ-
ਪਾਣੀ ਦੀ ਉਦਾਹਰਨ ਲੈ ਕੇ ਆਓ ਇਸ ਦੀ ਮਹੱਤਤਾ ਤੇ ਵਿਚਾਰ ਕਰੀਏ । ਪਾਣੀ ਦਾ ਰਸਾਇਣਿਕ ਸੂਤਰ H2 O ਹੈ ।
- ਇਸ ਸੂਤਰ ਤੋਂ ਇਹ ਗਿਆਤ ਹੁੰਦਾ ਹੈ ਕਿ ਹਾਈਡ੍ਰੋਜਨ ਦਾ ਇਕ ਅਣੂ ਅਤੇ ਆਕਸੀਜਨ ਦੇ ਦੋ ਅਣੂ ਇੱਕ-ਦੂਜੇ ਨਾਲ ਸੰਯੋਜਿਤ ਹੁੰਦੇ ਹਨ ।
- ਆਕਸੀਜਨ ਦੀ ਸੰਯੋਜਕਤਾ 2 ਹੈ ਜਦਕਿ ਹਾਈਡੋਜਨ ਦੀ ਸੰਯੋਜਕਤਾ ਇੱਕ ਹੈ ।
- ਪਾਣੀ (H2O) ਦਾ ਪੁੰਜ 18 ਹੈ । ਆਕਸੀਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ 16 ਹੈ । ਇਸ ਉੱਤੇ ਕੋਈ ਚਾਰਜ ਨਹੀਂ ਹੈ ।
- ਯੌਗਿਕ (H O) ਬਿਜਲਈ ਰੂਪ ਵਿੱਚ ਉਦਾਸੀਨ ਹੈ ਅਤੇ ਇਸ ਉੱਤੇ ਕੋਈ ਚਾਰਜ ਨਹੀਂ ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 11.
ਪਾਣੀ ਦੇ ਅਣੂ (H2 O) ਵਿੱਚ ਉਪਸਥਿਤ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ ਦਾ ਸਰਲਤਮ ਅਨੁਪਾਤ ਗਿਆਤ ਕਰੋ ।
ਉੱਤਰ-

ਪ੍ਰਸ਼ਨ 12.
ਹੇਠ ਲਿਖਿਆਂ ਦੇ ਸੂਤਰ ਲਿਖੋ :-
(i) ਐਲੂਮੀਨੀਅਮ ਕਲੋਰਾਈਡ
(ii) ਫਾਸਫੋਰਸ ਪੈਂਟਾਕਲੋਰਾਈਡ
(iii) ਅਮੋਨੀਅਮ ਕਾਰਬੋਨੇਟ
(iv) ਡਾਈਨਾਈਟ੍ਰੋਜਨ ਟੈਟੂ ਆਕਸਾਈਡ ।
ਉੱਤਰ-
(i) ਐਲੂਮੀਨੀਅਮ ਕਲੋਰਾਈਡ ਦਾ ਸੂਤਰ :
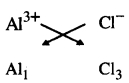
ਇਸ ਲਈ ਐਲੂਮੀਨੀਅਮ ਕਲੋਰਾਈਡ ਦਾ ਸੂਤਰ AlCl3 ਹੈ ।
(ii) ਫਾਸਫੋਰਸ ਪੈਂਟਾਕਲੋਰਾਈਡ ਦਾ ਸੂਤਰ :
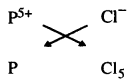
ਇਸ ਲਈ ਫਾਸਫੋਰਸ ਪੈਂਟਾਕਲੋਰਾਈਡ ਦਾ ਸੂਤਰ PCl5 ਹੈ ।
(iii) ਅਮੋਨੀਅਮ ਕਾਰਬੋਨੇਟ ਦਾ ਸੂਤਰ :
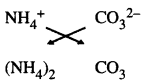
ਇਸ ਤਰ੍ਹਾਂ ਅਮੋਨੀਅਮ ਕਾਰਬੋਨੇਟ ਦਾ ਸੂਤਰ (NH4)2 CO3 ਹੈ ।
(iv) ਡਾਈਨਾਈਟ੍ਰੋਜਨ ਆਕਸਾਈਡ ਦਾ ਸੂਤਰ :
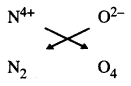
ਇਸ ਤਰ੍ਹਾਂ ਡਾਈਨਾਈਟ੍ਰੋਜਨ ਟੈਟੂਆਂਕਸਾਈਡ ਦਾ ਸੂਤਰ N2O4 ਹੈ ।
ਪ੍ਰਸ਼ਨ 13.
ਹੇਠ ਲਿਖਿਆਂ ਦੇ ਸੂਤਰ ਲਿਖੋ-
(i) ਜ਼ਿੰਕ ਸਲਫੇਟ
(ii) ਮੈਗਨੀਸ਼ੀਅਮ ਕਾਰਬੋਨੇਟ
(iii) ਫੈਰਸ ਕਲੋਰਾਈਡ
(iv) ਐਲੂਮੀਨਿਯਮ ਐਸੀਟੇਟ
(v) ਸਿਲਵਰ ਨਾਈਟ੍ਰੇਟ
(vi) ਪਲੰਬਸ ਨਾਈਟ੍ਰੇਟ
(vii) ਅਮੋਨੀਅਮ ਸਲਫਾਈਡ
(viii) ਪੋਟਾਸ਼ੀਅਮ ਬਾਈਕਾਰਬੋਨੇਟ ।
ਉੱਤਰ-
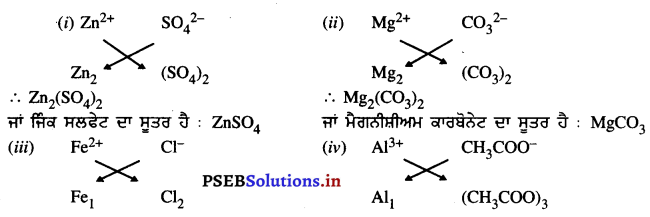
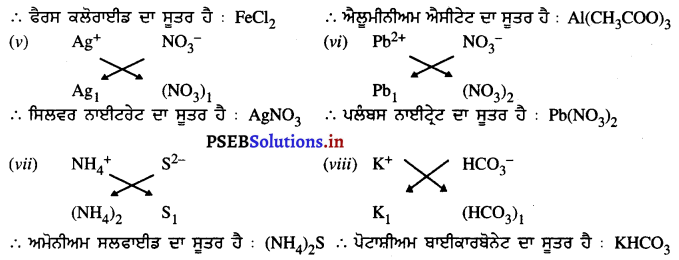
ਪ੍ਰਸ਼ਨ 14.
ਹੇਠ ਲਿਖਿਆਂ ਦੁਆਰਾ ਬਣੇ ਯੌਗਿਕਾਂ ਦੇ ਸੂਤਰ ਅਤੇ ਨਾਂ ਲਿਖੋ :-
(i) Fe3+ ਅਤੇ SO42-
(ii) Cr3+ ਅਤੇ PO43-
(iii) Hg2+ ਅਤੇ Cl–
(iv) NH4+ ਅਤੇ CO32-
ਉੱਤਰ-
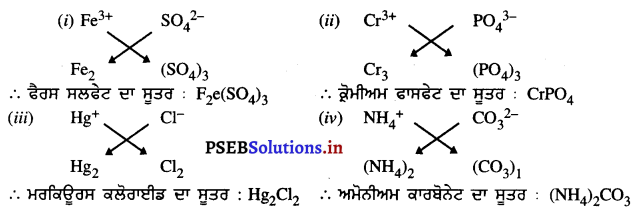
![]()
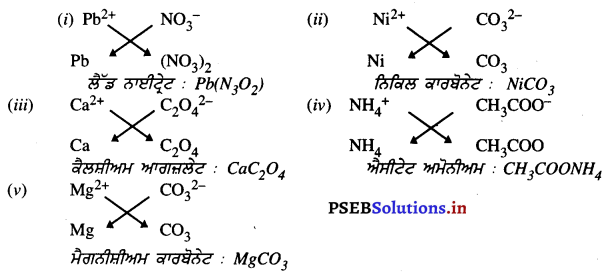
ਪ੍ਰਸ਼ਨ 15.
ਹੇਠ ਲਿਖਿਆਂ ਦੁਆਰਾ ਬਣੇ ਯੌਗਿਕਾਂ ਦੇ ਸੂਤਰ ਅਤੇ ਨਾਂ ਲਿਖੋ
(i) ਪਲੰਬਸ ਆਇਨ ਅਤੇ ਨਾਈਟ੍ਰੇਟ ਆਇਨ ।
(ii) ਨਿਕਲ ਆਇਨ ਅਤੇ ਕਾਰਬੋਨੇਟ ਆਇਨ
(iii) ਕੈਲਸ਼ੀਅਮ ਆਇਨ ਅਤੇ ਆਗਜ਼ਲੇਟ ਆਇਨ
(iv) ਅਮੋਨੀਅਮ ਆਇਨ ਅਤੇ ਐਸ਼ੀਟੇਟ ਆਇਨ
(v) ਮੈਗਨੀਸ਼ੀਅਮ ਆਇਨ ਅਤੇ ਕਾਰਬੋਨੇਟ ਆਇਨ ।
ਉੱਤਰ-
ਪ੍ਰਸ਼ਨ 16.
ਹੇਠ ਲਿਖੇ ਯੌਗਿਕਾਂ ਦੇ ਨਾਂ ਲਿਖੋ-
(i) HgCl
(ii) (NH4)2 CO3
(iii) NaHCO3
(iv) CrPO4
(v) Sr(HCO3)2
(vi) PtBr4
(vii) ZnS
(viii) BaC2O4
(ix) Pb(NO3)2
(x) Fe2(SO4)3
(xi) CuSO3
(xii) PCl5
(xiii) (NH4)2Cr2O7
(iv) Ni(NO3)2
ਉੱਤਰ-
(i) ਮਰਕਿਊਰਸ ਕਲੋਰਾਈਡ
(ii) ਅਮੋਨੀਅਮ ਕਾਰਬੋਨੇਟ
(iii) ਸੋਡੀਅਮ ਹਾਈਡਰੋਜਨ ਕਾਰਬੋਨੇਟ
(iv) ਕ੍ਰੋਮੀਅਮ ਫਾਸਫੇਟ
(v) ਸਵਾਂਸ਼ਿਅਮ ਬਾਈਕਾਰਬੋਨੇਟ
(vi) ਪਲਾਟੀਨਮ ਬੋਮਾਈਡ
(vii) ਜ਼ਿੰਕ ਸਲਫਾਈਡ
(viii) ਬੇਰੀਅਮ ਆਗਜ਼ਲੇਟ
(x) ਲੈਂਡ ਨਾਈਟ੍ਰੇਟ
(x) ਫੈਰਿਕ ਸਲਫੇਟ
(xi) ਕਾਪਰ ਸਲਫਾਈਟ
(xii) ਫਾਸਫੋਰਸ ਪੈਂਟਾਕਲੋਰਾਈਡ
(xiii) ਅਮੋਨੀਅਮ ਡਾਈਕੋਮੇਟ
(xiv) ਨਿਕਿਲ ਨਾਈਟ੍ਰੇਟ ।
ਸੰਖਿਆਤਮਕ ਪ੍ਰਸ਼ਨ (Numerical Problems)
ਪ੍ਰਸ਼ਨ 1.
4 ਗ੍ਰਾਮ ਹਾਈਡ੍ਰੋਜਨ ਅਤੇ 32 ਗ੍ਰਾਮ ਆਕਸੀਜਨ ਦੇ ਰਸਾਇਣਿਕ ਸੰਯੋਗ ਤੋਂ 36 ਗ੍ਰਾਮ ਪਾਣੀ ਬਣਿਆ । ਇਹ ਆਂਕੜੇ ਰਸਾਇਣਿਕ ਸੰਯੋਗ ਦੇ ਕਿਸ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਕਰਦੇ ਹਨ ? ਕਾਰਨ ਸਹਿਤ ਦੱਸੋ ।
ਹੱਲ:
ਰਸਾਇਣਿਕ ਪ੍ਰਤੀਕਿਰਿਆ ਵਿੱਚ ਅਭਿਕਾਰਕਾਂ ਦਾ ਕੁੱਲ ਪੰਜ = ਹਾਈਡੋਜਨ ਦਾ ਪੁੰਜ + ਆਕਸੀਜਨ ਦਾ ਪੁੰਜ
= 4 ਗ੍ਰਾਮ + 32 ਗ੍ਰਾਮ
= 36 ਗ੍ਰਾਮ
ਉਪਜਾਂ ਦਾ ਪੁੰਜ = 36 ਗ੍ਰਾਮ
ਕਿਉਂਕਿ ਅਭਿਕਾਰਕਾਂ ਦਾ ਕੁੱਲ ਪੁੰਜ ਅਤੇ ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਦੌਰਾਨ ਉਪਜੇ ਪਦਾਰਥਾਂ ਦਾ ਪੁੰਜ ਸਮਾਨ ਹੈ ; ਇਸ ਲਈ ਇਹ ਆਂਕੜੇ ਪੁੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਕਰਦੇ ਹਨ ।
ਪ੍ਰਸ਼ਨ 2.
ਕਾਰਬਨ ਅਤੇ ਆਕਸੀਜਨ ਸੰਯੋਗ ਕਰਕੇ ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਗੈਸ ਬਣਾਉਂਦੀ ਹੈ । ਇਹ 3 : 8 ਵਿੱਚ ਸੰਯੋਗ ਕਰਦੇ ਹਨ । 6.0g ਕਾਰਬਨ ਦੇ ਨਾਲ ਪੂਰਨ ਰੂਪ ਨਾਲ ਪ੍ਰਤਿਕਿਰਿਆ ਕਰਨ ਲਈ ਕਿੰਨੀ ਆਕਸੀਜਨ ਦੀ ਮਾਤਰਾ ਦੀ ਲੋੜ ਪਵੇਗੀ ? ਉਪਜੀ ਕਾਰਬਨ ਡਾਈਆਕਸਾਈਡ ਗੈਸ ਦੇ ਪੁੰਜ ਦਾ ਪਤਾ ਲਗਾਓ । ਇਸ ਤਰ੍ਹਾਂ ਤੁਹਾਡੇ ਉੱਤਰ ਦੇ ਲਈ ਰਸਾਇਣਿਕ ਸੰਯੋਜਨ ਦਾ ਕਿਹੜਾ ਨਿਯਮ ਲਾਗੂ ਹੁੰਦਾ ਹੈ ?
ਹੱਲ:
ਕਾਰਬਨ ਅਤੇ ਆਕਸੀਜਨ ਸਥਿਰ ਅਨੁਪਾਤ ਦੇ ਨਿਯਮ ਅਨੁਸਾਰ ਆਪਸ ਵਿੱਚ ਸੰਯੋਗ ਕਰਦੇ ਹਨ ।
ਕਾਰਬਨ : ਆਕਸੀਜਨ = 3 : 8.
∴ 3g ਕਾਰਬਨ, ਜਿੰਨੀ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਦਾ ਹੈ = 8g
6.0 ਕਾਰਬਨ ਜਿੰਨੀ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਦਾ ਹੈ = \(\frac{8}{3}\) × 6
= 16g
ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਦੀ ਉਪਜੀ ਮਾਤਰਾ = 6g + 16g
= 22g.
∵ ਅਭਿਕਾਰਕਾਂ ਦੀ ਕੁੱਲ ਮਾਤਰਾ = ਉਪਜਾਂ ਦੀ ਕੁੱਲ ਮਾਤਰਾ
ਇਸ ਲਈ ਆਂਕੜੇ ਪੁੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਕਰਦੇ ਹਨ ।
![]()
ਪ੍ਰਸ਼ਨ 3.
170 ਗ੍ਰਾਮ ਸਿਲਵਰ ਨਾਈਟਰੇਟ, ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ ਨਾਲ ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਕਰਕੇ 143.5 ਗ੍ਰਾਮ ਸਿਲਵਰ ਕਲੋਰਾਈਡ ਅਤੇ 85 ਗ੍ਰਾਮ ਸੋਡੀਅਮ ਨਾਈਟਰੇਟ ਬਣਾਉਂਦੇ ਹਨ । ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ ਦਾ ਪੁੰਜ ਕਿੰਨਾ ਹੋਵੇਗਾ ?
ਹੱਲ:
ਇੱਥੇ, ਸਿਲਵਰ ਨਾਈਟਰੇਟ ਦਾ ਪੁੰਜ = 170
ਗ੍ਰਾਮ ਸਿਲਵਰ ਕਲੋਰਾਈਡ ਦਾ ਪੁੰਜ = 143.5 ਗ੍ਰਾਮ
ਸੋਡੀਅਮ ਨਾਈਟਰੇਟ ਦਾ ਪੁੰਜ = 85 ਗ੍ਰਾਮ
ਮੰਨ ਲਓ ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ ਦਾ ਪੁੰਜ = x ਗ੍ਰਾਮ
ਅਸੀਂ ਜਾਣਦੇ ਹਾਂ ਕਿ ਪੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਅਨੁਸਾਰ ਅਭਿਕਾਰਕਾਂ ਦਾ ਕੁੱਲ ਪੰਜ = ਉਪਜਾਂ ਦਾ ਕੁੱਲ ਪੂੰਜ ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਅਨੁਸਾਰ ਸਮੀਕਰਣ :
NaCl + AgNO3 → AgCl + NaNO3
x + 170 → 143.5 + 85
x + 170 = 228.5
x = 228.5 – 170
∴ ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ ਦਾ ਪੁੰਜ = 58.5g
ਪ੍ਰਸ਼ਨ 4.
ਸਿੱਧ ਕਰੋ ਕਿ ਹੇਠ ਲਿਖੇ ਆਂਕੜੇ ਸਥਿਰ ਅਨੁਪਾਤ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਕਰਦੇ ਹਨ । ਕਾਪਰ ਆਕਸਾਈਡ ਦੇ ਦੋ ਸੈਂਪਲਾਂ ਵਿੱਚ ਕਾਪਰ ਅਤੇ ਕਾਪਰ ਮੋਨੋ-ਆਕਸਾਈਡ ਦੇ ਪੁੰਜ ਹੇਠ ਲਿਖੇ ਅਨੁਸਾਰ ਸੀ-
(i) ਕਾਪਰ = 1.26 ਗ੍ਰਾਮ, ਕਾਪਰ ਮੋਨੋਆਕਸਾਈਡ = 1.42 ਗ੍ਰਾਮ,
(ii) ਕਾਪਰ = 1.008 ਗ੍ਰਾਮ, ਕਾਪਰ ਮੋਨੋਆਕਸਾਈਡ = 1.36
(ਗ੍ਰਾਮ ਕਾਪਰ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 63, ਆਕਸੀਜਨ ਦਾ ਪਰਮਾਣੂ ਪੁੰਜ = 16)
ਹੱਲ:
ਸੈਂਪਲ
(i) ਵਿੱਚ :
ਕਾਪਰ ਮੋਨੋਆਕਸਾਈਡ ਦਾ ਪੁੰਜ = 1.42 ਗ੍ਰਾਮ
ਕਾਪਰ ਦਾ ਪੁੰਜ = 1.26 ਗ੍ਰਾਮ
∴ ਸੰਯੋਜਿਤ ਆਕਸੀਜਨ ਦਾ ਪੁੰਜ = ਕਾਪਰ ਮੋਨੋਆਕਸਾਈਡ ਦਾ ਪੁੰਜ – ਕਾਪਰ ਦਾ ਪੁੰਜ
= (1.42 – 1.26) ਗ੍ਰਾਮ
= 0.16 ਗ੍ਰਾਮ
∴ ਕਾਪਰ : ਆਕਸੀਜਨ = 1.26 : 0.16
= 7.875 : 1
ਸੈਂਪਲ (ii) ਵਿੱਚ :
ਕਾਪਰ ਮੋਨੋਆਕਸਾਈਡ ਦਾ ਪੁੰਜ = 1.136 ਗ੍ਰਾਮ
ਕਾਪਰ ਦਾ ਪੁੰਜ = 1.008 ਗ੍ਰਾਮ
∴ ਸੰਯੋਜਿਤ ਆਕਸੀਜਨ ਦਾ ਪੁੰਜ = ਕਾਪਰ ਮੋਨੋਆਕਸਾਈਡ ਦਾ ਪੁੰਜ – ਕਾਪਰ ਦਾ ਪੁੰਜ
= (1.136 – 1.008) ਗ੍ਰਾਮ
= 0.128 ਗ੍ਰਾਮ
ਕਾਪਰ : ਆਕਸੀਜਨ = 1.008 : 0.128
= 7.875 : 1
ਕਿਉਂਕਿ ਦੋਨਾਂ ਸੈਂਪਲਾਂ ਵਿੱਚ ਕਾਪਰ ਅਤੇ ਆਕਸੀਜਨ ਦਾ ਅਨੁਪਾਤ 7.875 : 1 ਹੈ, ਇਸ ਲਈ ਇਹ ਆਂਕੜੇ ਸੰਯੋਜਕ ਤੱਤਾਂ ਦੇ ਸਥਿਰ ਅਨੁਪਾਤ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਕਰਦੇ ਹਨ ।
ਪ੍ਰਸ਼ਨ 5.
ਪਹਿਲੇ ਪ੍ਰਯੋਗ ਵਿੱਚ 2.4 ਗ੍ਰਾਮ ਆਇਰਨ ਆਕਸਾਈਡ ਨੂੰ ਹਾਈਡ੍ਰੋਜਨ ਦੁਆਰਾ ਪੂਰੀ ਤਰ੍ਹਾਂ ਲਘੂਕਰਣ ਕਰਨ ‘ਤੇ 1.68 ਗ੍ਰਾਮ ਆਇਰਨ ਪ੍ਰਾਪਤ ਹੋਇਆ । ਦੂਸਰੇ ਪ੍ਰਯੋਗ ਵਿੱਚ 2.90 ਗ੍ਰਾਮ ਆਇਰਨ ਆਕਸਾਈਡ ਅਪਚਤ ਹੋਣ ‘ਤੇ 2.03 ਗ੍ਰਾਮ ਆਇਰਨ ਦਿੰਦਾ ਹੈ । ਇਨ੍ਹਾਂ ਪ੍ਰਯੋਗਾਂ ਦੇ ਨਤੀਜਿਆਂ ਤੋਂ ਸਥਿਰ ਅਨੁਪਾਤ ਦਾ ਨਿਯਮ ਸਿੱਧ ਕਰੋ ।
ਹੱਲ:
ਪਹਿਲਾ ਪ੍ਰਯੋਗ :
ਆਇਰਨ ਆਕਸਾਈਡ ਦਾ ਪੁੰਜ = 2.40 ਗ੍ਰਾਮ ……………. (i)
ਆਇਰਨ ਦਾ ਪੁੰਜ = 1.68 ਗ੍ਰਾਮ ………….(ii)
∴ ਸੰਯੋਜਿਤ ਹੋਈ ਆਕਸੀਜਨ ਦਾ ਪੁੰਜ = ਆਇਰਨ ਆਕਸਾਈਡ ਦਾ ਪੁੰਜ – ਆਇਰਨ ਦਾ ਪੁੰਜ
= (i) – (ii)
= (2.40 – 1.68) ਗ੍ਰਾਮ
= 0.72 ਗ੍ਰਾਮ
ਆਇਨ ਦਾ ਪੁੰਜ : ਆਕਸੀਜਨ ਦਾ ਪੁੰਜ = 1.68 : 0.72
= 7 : 3
ਦੂਸਰਾ ਪ੍ਰਯੋਗ :
ਆਇਰਨ ਆਕਸਾਈਡ ਦਾ ਪੁੰਜ . = 2.90 ਗ੍ਰਾਮ ……….. (iii)
ਆਇਰਨ ਦਾ ਪੁੰਜ = 2.03 ਗ੍ਰਾਮ ………….. (iv)
∴ ਸੰਯੋਜਿਤ ਹੋਈ ਆਕਸੀਜਨ ਦਾ ਪੁੰਜ = ਆਇਰਨ ਆਕਸਾਈਡ ਦਾ ਪੁੰਜ – ਆਇਰਨ ਦਾ ਪੁੰਜ .
= (iii) – (iv)
= (2.90 – 2.03) ਗ੍ਰਾਮ
= 0.87 ਗ੍ਰਾਮ
ਆਇਨ ਦਾ ਪੁੰਜ : ਆਕਸੀਜਨ ਦਾ ਪੁੰਜ = 2.03 : 0.87
= 7 : 3
ਕਿਉਂਕਿ ਦੋਨਾਂ ਪ੍ਰਯੋਗਾਂ ਤੋਂ ਆਇਰਨ ਅਤੇ ਆਕਸੀਜਨ ਦੇ ਪੁੰਜਾਂ ਦਾ ਅਨੁਪਾਤ 7 : 3 ਬਰਾਬਰ ਹੈ, ਇਸ ਲਈ ਸਥਿਰ ਅਨੁਪਾਤ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਹੁੰਦੀ ਹੈ ।
ਪ੍ਰਸ਼ਨ 6.
ਕਿੰਨੇ ਅਣੂ ਮੌਜੂਦ ਹੋਣਗੇ ?
(i) 9g ਪਾਣੀ
(ii) 17g ਅਮੋਨੀਆ |
ਹੱਲ:
(i) ਪਾਣੀ ਦਾ ਅਣਵੀਂ ਪੰਜ = H2O
– 2 × H + 1 × O
= -2 × 1 + 1 × 16
= 18 a.m.u.
∴ ਪਾਣੀ ਦਾ 1 ਮੋਲ = 18g
= 6.023 × 10 ਅਣੁ
ਅਰਥਾਤ ਪਾਣੀ ਦੇ 18g ਵਿੱਚ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ = 6.023 × 1023
∴ ਪਾਣੀ ਦੇ 9g ਵਿੱਚ ਅਣੂਆਂ ਦੀ ਸੰਖਿਆ = \(\frac{6.022 \times 10^{23} \times 9}{18}\)
= 3·011 × 1023
(ii) ਅਮੋਨੀਆ (NH3) ਦਾ ਮੋਲਰ ਪੰਜ = 1 × N + 3 × H
= 1 × 14 + 3 × 1
= 17g/mol.
ਅਮੋਨੀਆ (NH3) ਵਿੱਚ ਮੋਲਾਂ ਦੀ ਸੰਖਿਆ = \(\frac{17 \mathrm{~g}}{17 \mathrm{~g} / \mathrm{mol} .}\)
= 1 mol.
![]()
ਪ੍ਰਸ਼ਨ 7.
17 ਗ੍ਰਾਮ H2O2 ਵਿੱਚ ਮੋਲਾਂ ਦੀ ਸੰਖਿਆ ਗਿਆਤ ਕਰੋ ।
ਹੱਲ :
H2O2 ਦਾ ਅਣਵੀਂ ਪੁੰਜ = 2 × H +2 × O
= 2 × 1 + 2 × 16
= 34g
34g H2O2 ਵਿੱਚ ਮੋਲਾਂ ਦੀ ਸੰਖਿਆ = 1
∴ 17g H2O2 ਵਿੱਚ ਮੋਲਾਂ ਦੀ ਸੰਖਿਆ = \(\frac{1 \times 17}{34}\)
= \(\frac{1}{2}\) = 0.5 ਮੋਲ
ਪ੍ਰਸ਼ਨ 8.
ਹੇਠ ਲਿਖਿਆਂ ਦੇ ਅਣਵੀਂ ਪੰਜ ਪਤਾ ਕਰੋ :
(i) PCl5
(ii) NH3
(iii) CH2Cl2
(iv) H2O2
(v) S8
ਹੱਲ:
(i) PCl5 ਦਾ ਅਣਵੀਂ ਪੰਜ = 1 × P + 5 × Cl
= 1 × 31 + 5 × 35.5
= 31 + 177.5
= 208.5 u
(ii) NH3 ਦਾ ਅਣਵੀਂ ਪੰਜ
= 1 × N + 3 × H
= 1 × 14 + 3 × 1
= 17 u
(iii) CH2 Cl2 ਦਾ ਅਣਵੀਂ ਪੁੰਜ = 1 × C + 2 × H + 2 × Cl
= 1 × 12 + 2 × 1 + 2 × 35.5
= 12 + 2 + 71
= 85 u
(iv) H2O2 ਦਾ ਅਣਵੀਂ ਪੁੰਜ 2 × H + 2 × 0
= 2 × 1 + 2 × 16
= 2 + 32
= 34 u
(v) S8 ਦਾ ਅਣਵੀ ਪੁੰਜ
= 8 × S
= 8 × 32
= 256 u
ਪ੍ਰਸ਼ਨ 9.
ਸੋਡੀਅਮ ਕਾਰਬੋਨੇਟ (Na2 CO3.10H2 O) ਇੱਕ ਉਦਯੋਗਿਕ ਰਸਾਇਣਿਕ ਪਦਾਰਥ ਹੈ । ਇਸਦਾ ਸੂਤਰ ਪੁੰਜ (Formula Mass) ਗਿਆਤ ਕਰੋ ।
ਹੱਲ:
ਸੋਡੀਅਮ ਕਾਰਬੋਨੇਟ (Na2 CO3·10H2 O) ਦਾ ਸੂਤਰ ਪੁੰਜ
= [2 × Na + 1 × C+ 3 × O] + 10 (2 × H + 1 × O)
= (2 × 23 + 1 × 12 + 3 × 16) + 10 (2 × 1 + 1 × 16)
= (46 + 12 + 48) + 10 (18)
= 106 + 180
= 286 u
ਪ੍ਰਸ਼ਨ 10.
ਗੁਲੂਕੋਜ਼ (C6 H12O6) ਦਾ ਅਣਵੀਂ ਪੰਜ ਪਰਿਕਲਿਤ ਕਰੋ ।
ਹੱਲ:
ਗੁਲੂਕੋਜ਼ (C6 H2O6) ਦਾ ਅਣਵੀਂ ਪੰਜ = 6 × C + 12 × H + 6 × 0
= 6 × 12 + 12 × 1+ 6 × 16
= 72 + 12 + 96
= 180 a.m.u.
![]()
ਬਹੁਤ ਛੋਟੇ ਉੱਤਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ (Very Short Answer Type Questions)
ਪ੍ਰਸ਼ਨ 1.
ਯੋਗਿਕ ਜਲ ਵਿੱਚ ਹਾਈਡ੍ਰੋਜਨ ਅਤੇ ਆਕਸੀਜਨ ਘਟਕਾਂ ਦੇ ਪੁੰਜਾਂ ਦਾ ਕੀ ਅਨੁਪਾਤ ਹੁੰਦਾ ਹੈ ?
ਉੱਤਰ-
1 : 8.
ਪ੍ਰਸ਼ਨ 2.
ਅਮੋਨੀਆ (NH3 ) ਵਿੱਚ ਨਾਈਟ੍ਰੋਜਨ ਅਤੇ ਹਾਈਡੋਜਨ ਦੇ ਨਾਂ ਦਾ ਕੀ ਅਨੁਪਾਤ ਹੁੰਦਾ ਹੈ ?
ਉੱਤਰ-
14 : 3.
ਪ੍ਰਸ਼ਨ 3.
ਸਭ ਤੋਂ ਪਹਿਲਾਂ ਤੱਤਾਂ ਲਈ ਪ੍ਰਤੀਕਾਂ ਦਾ ਉਪਯੋਗ ਕਿਸ ਵਿਗਿਆਨਿਕ ਨੇ ਕੀਤਾ ਸੀ ?
ਉੱਤਰ-
ਜਾਂਨ ਡਾਲਟਨ ਨੇ ।
ਪ੍ਰਸ਼ਨ 4.
ਕਿਸੇ ਤੱਤ ਜਾਂ ਯੌਗਿਕ ਦਾ ਸੂਖ਼ਮਤਮ ਕਣ ਕਿਹੜਾ ਸੁਤੰਤਰ ਰੂਪ ਵਿੱਚ ਰਹਿ ਸਕਦਾ ਹੈ, ਨੂੰ ਕੀ ਆਖਦੇ ਹਨ ?
ਉੱਤਰ-
ਅਣੂ ।
ਪ੍ਰਸ਼ਨ 5.
ਕਿਸੇ ਤੱਤ, ਦੇ ਇੱਕੋ ਜਿਹੇ ਪਰਮਾਣੂਆਂ ਤੋਂ ਕੀ ਬਣਦਾ ਹੈ ?
ਉੱਤਰ-
ਅਣੂ ।
ਪ੍ਰਸ਼ਨ 6.
ਆਕਸੀਜਨ ਦੇ ਅਣੂ ਵਿੱਚ ਕਿੰਨੇ ਪਰਮਾਣੂ ਹੁੰਦੇ ਹਨ ?
ਉੱਤਰ-
ਦੋ ਪਰਮਾਣੂ, ਅਰਥਾਤ ਇਹ ਦੋ ਪਰਮਾਣਵੀਂ ਹੁੰਦੀ ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 7.
ਦੋ ਪਰਮਾਣ ਅਣੂਆਂ ਦੇ ਚਾਰ ਉਦਾਹਰਨ ਦਿਓ ।
ਉੱਤਰ-
ਦੋ ਪਰਮਾਣਵੀਂ ਅਣੂ-ਹਾਈਡੋਜਨ, ਆਕਸੀਜਨ, ਨਾਈਟ੍ਰੋਜਨ ਅਤੇ ਕਲੋਰੀਨ ।
ਪ੍ਰਸ਼ਨ 8.
ਚਾਰ ਪਰਮਾਣਵੀਂ ਅਣੂ ਦੀ ਇਕ ਉਦਾਹਰਨ ਦਿਓ ।
ਉੱਤਰ-
ਫਾਸਫੋਰਸ ।
ਪ੍ਰਸ਼ਨ 9.
ਜਲ ਦੇ ਅਣੂ ਵਿੱਚ ਹਾਈਡ੍ਰੋਜਨ ਅਤੇ ਆਕਸੀਜਨ ਦੇ ਪਰਮਾਣੂਆਂ ਦੀ ਸੰਖਿਆ ਦਾ ਅਨੁਪਾਤ ਕੀ ਹੈ ?
ਉੱਤਰ-
H : O = 2 : 1 ਹੈ ।
ਪ੍ਰਸ਼ਨ 10.
ਆਇਨ ਕਿਸ ਨੂੰ ਆਖਦੇ ਹਨ ?
ਉੱਤਰ-
ਆਇਨ – ਧਾਤੁ ਅਤੇ ਅਧਾਤੁ ਦੇ ਚਾਰਜਿਤ ਕਣਾਂ ਨੂੰ ਆਇਨ ਆਖਦੇ ਹਨ ।
ਪ੍ਰਸ਼ਨ 11.
ਧਨ-ਆਇਨ ਕਿਸ ਨੂੰ ਕਹਿੰਦੇ ਹਨ ?
ਉੱਤਰ-
ਧਨ-ਚਾਰਜਿਤ ਕਣਾਂ ਨੂੰ ਧਨ-ਆਇਨ ਆਖਦੇ ਹਨ ।
ਪ੍ਰਸ਼ਨ 12.
ਰਿਣ-ਆਇਨ ਕਿਸਨੂੰ ਕਹਿੰਦੇ ਹਨ ?
ਉੱਤਰ-
ਰਿਣ-ਚਾਰਜਿਤ ਕਣਾਂ ਨੂੰ ਰਿਣ-ਆਇਨ ਕਹਿੰਦੇ ਹਨ ।
![]()
ਪ੍ਰਸ਼ਨ 13.
ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ ਵਿੱਚ ਸੋਡੀਅਮ ਅਤੇ ਕਲੋਰੀਨ ਦਾ ਪੁੰਜ ਅਨੁਪਾਤ ਕਿੰਨਾ ਹੁੰਦਾ ਹੈ ?
ਉੱਤਰ-
Na : Cl = 23 : 35.5.
ਪ੍ਰਸ਼ਨ 14.
ਰਸਾਇਣਿਕ ਸੂਤਰ ਕਿਸ ਨੂੰ ਕਹਿੰਦੇ ਹਨ ?
ਉੱਤਰ-
ਰਸਾਇਣਿਕ ਸੂਤਰ – ਸੰਘਟਕ ਤੱਤਾਂ ਦੇ ਪ੍ਰਤੀਕਾਂ ਅਤੇ ਸੰਯੋਜਕਤਾ ਦੀ ਮੱਦਦ ਨਾਲ ਯੌਗਿਕ ਦਾ ਪ੍ਰਤੀਕ ਦੇ ਰੂਪ ਵਿੱਚ ਨਿਰੂਪਣ ਰਸਾਇਣਿਕ ਸੂਤਰ ਕਹਾਉਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 15.
ਸੰਯੋਜਕਤਾ ਕਿਸ ਨੂੰ ਕਹਿੰਦੇ ਹਨ ?
ਉੱਤਰ-
ਸੰਯੋਜਕਤਾ – ਕਿਸੇ ਤੱਤ ਦੀ ਸੰਯੋਜਨ ਸਮਰੱਥਾ ਨੂੰ ਉਸ ਤੱਤ ਦੀ ਸੰਯੋਜਕਤਾ ਕਹਿੰਦੇ ਹਨ ।
ਪ੍ਰਸ਼ਨ 16.
ਕਿਸੇ ਪਦਾਰਥ ਦਾ ਅਣਵੀਂ ਪੰਜ ਕੀ ਹੁੰਦਾ ਹੈ ?
ਉੱਤਰ-
ਇਹ ਪਦਾਰਥ ਦੇ ਇੱਕ ਅਣੂ ਵਿੱਚ ਉਪਸਥਿਤ ਸਾਰੇ ਪਰਮਾਣੂਆਂ ਦੇ ਪੁੰਜ ਦਾ ਜੋੜ ਹੁੰਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 17.
ਪਾਣੀ ਕਿਹੜੇ-ਕਿਹੜੇ ਤੱਤਾਂ ਦੇ ਸੰਯੋਗ ਤੋਂ ਬਣਿਆ ਹੋਇਆ ਹੈ ?
ਉੱਤਰ-
ਹਾਈਡੋਜਨ ਅਤੇ ਆਕਸੀਜਨ ਦੀ ਸੰਯੋਜਨ ਕਿਰਿਆ ਤੋਂ ਪਾਣੀ ਬਣਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 18.
ਮੋਲ ਕਿਸਨੂੰ ਕਹਿੰਦੇ ਹਨ ?
ਉੱਤਰ-
ਮੋਲ- ਕਿਸੇ ਸਪੀਸੀਜ਼ (ਪਰਮਾਣੂ, ਅਣੂ, ਆਇਨ ਕਣ ਦੀ ਨਿਸਚਿਤ ਸੰਖਿਆ ਜਿਸਦਾ ਮਾਨ 6.022 × 1023 ਹੁੰਦਾ ਹੈ, ਨੂੰ ਮੋਲ ਆਖਦੇ ਹਨ ।
![]()
ਪ੍ਰਸ਼ਨ 19.
ਆਵੋਗਾਦਰੋ ਸੰਖਿਆ ਕਿਸਨੂੰ ਕਹਿੰਦੇ ਹਨ ?
ਉੱਤਰ-
ਆਵੇਗਾਦਰੋ ਸੰਖਿਆ-ਕਿਸੇ ਪਦਾਰਥ ਦੇ 1 ਮੋਲ ਵਿੱਚ ਕਣਾਂ ਦੀ ਸੰਖਿਆ ਨਿਸਚਿਤ ਹੁੰਦੀ ਹੈ ਜਿਸ ਦਾ ਮਾਨ 6.022 × 1023 ਹੁੰਦਾ ਹੈ । ਇਸ ਸੰਖਿਆ ਨੂੰ ਆਵੋਗਾਦਰੋ ਸੰਖਿਆ ਆਖਦੇ ਹਨ । ਇਸ ਨੂੰ NO ਨਾਲ ਨਿਰੂਪਿਤ ਕਰਦੇ ਹਨ ।
ਪ੍ਰਸ਼ਨ 20.
ਮੋਲਰ ਪੁੰਜ ਕੀ ਹੁੰਦਾ ਹੈ ?
ਉੱਤਰ-
ਪੋਲਰ ਪੰਜ – ਕਿਸੇ ਪਦਾਰਥ ਦੇ ਇੱਕ ਮੋਲ ਦਾ ਗ੍ਰਾਮ ਵਿੱਚ ਦਰਸਾਇਆ ਗਿਆ ਪੁੰਜ ਉਸਦਾ ਮੋਲਰ ਪੁੰਜ ਕਹਾਉਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 21.
ਮੋਲ ਸੰਕਲਪ ਦੇ ਅਨੁਰੂਪ ਤੱਤ ਦੇ ਗਾਮ ਪਰਮਾਣੂ ਪੰਚ ਨੂੰ ਪਰਿਭਾਸ਼ਿਤ ਕਰੋ ।
ਉੱਤਰ-
ਗ੍ਰਾਮ ਪਰਮਾਣੂ ਪੁੰਜ ਜਾਂ ਇੱਕ ਗ੍ਰਾਮ ਪਰਮਾਣੂ ਕਿਸੇ ਤੱਤ ਦੇ ਇੱਕ ਮੋਲ (6.022 × 1023 ਪਰਮਾਣੂਆਂ) ਦਾ ਪੁੰਜ ਹੁੰਦਾ ਹੈ ਜਿਸ ਨੂੰ ਗ੍ਰਾਮ ਵਿੱਚ ਪ੍ਰਦਰਸ਼ਿਤ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 22.
ਕਿਸੇ ਤੱਤ ਦੇ ਇਕ ਗ੍ਰਾਮ ਪਰਮਾਣੂਆਂ ਵਿੱਚ ਕਿੰਨੇ ਪਰਮਾਣੂ ਮੌਜੂਦ ਹੁੰਦੇ ਹਨ ?
ਉੱਤਰ-
6.022 × 1023 (ਆਵੋਗਾਦਰੋ ਸੰਖਿਆ ਦੇ ਬਰਾਬਰ ।
ਪ੍ਰਸ਼ਨ 23.
12 ਗਾਮ ਮੈਗਨੀਸ਼ੀਅਮ ਅਤੇ 16 ਗ੍ਰਾਮ ਆਕਸੀਜਨ ਦੇ ਰਸਾਇਣਿਕ ਸੰਯੋਗ ਤੋਂ 28 ਗ੍ਰਾਮ ਮੈਗਨੀਸ਼ੀਅਮ ਆਕਸਾਈਡ ਪ੍ਰਾਪਤ ਹੁੰਦਾ ਹੈ । ਇਨ੍ਹਾਂ ਆਂਕੜਿਆਂ ਤੋਂ ਰਸਾਇਣਿਕ ਸੰਯੋਜਕ ਦੇ ਕਿਸ ਨਿਯਮ ਦੀ ਪੁਸ਼ਟੀ ਹੁੰਦੀ ਹੈ ?
ਉੱਤਰ-
ਪੰਜ ਸੁਰੱਖਿਅਣ ਨਿਯਮ ਦੀ ।
ਪ੍ਰਸ਼ਨ 24.
ਕੀ 1 ਮੋਲ ਸੋਡੀਅਮ ਅਤੇ 1 ਮੋਲ ਆਕਸੀਜਨ ਦਾ ਪੁੰਜ ਬਰਾਬਰ ਹੋਵੇਗਾ ?
ਉੱਤਰ-
ਨਹੀਂ, 1 ਮੋਲ ਸੋਡੀਅਮ (6.023 × 1023 ਪਰਮਾਣੂ ਦਾ ਪੁੰਜ 23 ਗ੍ਰਾਮ (ਪਰਮਾਣੂ ਪੁੰਜ) ਅਤੇ 1 ਮੋਲ ਆਕਸੀਜਨ (6.022 × 1023 ਅਣੂ ਦਾ ਪੁੰਜ 32 ਗ੍ਰਾਮ (ਅਣੂ ਪੁੰਜ) ਹੁੰਦਾ ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 25.
1 ਮੋਲ ਕਿਸ ਸੰਖਿਆ ਨੂੰ ਪ੍ਰਦਰਸ਼ਿਤ ਕਰਦਾ ਹੈ ?
ਉੱਤਰ-
6.022 × 1023
ਪ੍ਰਸ਼ਨ 26.
ਪਾਣੀ ਦੇ 9g ਵਿੱਚ ਕਿੰਨੇ ਅਣੂ ਉਪਸਥਿਤ ਹੁੰਦੇ ਹਨ ?
ਉੱਤਰ-
\(\frac {1}{2}\) × 6.022 × 1023 = 3.011 × 1023 ਅਣੂ ।
ਪ੍ਰਸ਼ਨ 27.
HNO3 ਦਾ ਮੋਲਰ ਪੁੱਜ ਗਿਆਤ ਕਰੋ । ਪਰਮਾਣੂ ਪੁੰਜ ਦਿੱਤੇ ਗਏ ਹਨ H = 1u, N = 14u, 0 = 16u.
ਉੱਤਰ-
HNO3 ਦਾ ਮੋਲਰ ਪੁੰਜ = 1u + 14u + 3 × 16u
= 63u
