Punjab State Board PSEB 10th Class Science Important Questions Chapter 3 ਧਾਤਾਂ ਅਤੇ ਅਧਾਤਾਂ Important Questions and Answers.
PSEB 10th Class Science Important Questions Chapter 3 ਧਾਤਾਂ ਅਤੇ ਅਧਾਤਾਂ
ਵੱਡੇ ਉੱਚਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ (Long Answer Type Questions)
ਪ੍ਰਸ਼ਨ 1.
ਧਾਤਾਂ ਦੇ ਭੌਤਿਕ ਅਤੇ ਰਸਾਇਣਿਕ ਗੁਣਾਂ ਦਾ ਵਰਣਨ ਕਰੋ ।
ਉੱਤਰ-
ਧਾਤਾਂ ਦੇ ਭੌਤਿਕ ਗੁਣ-
(i) ਧਾਤਵੀ ਲਿਸ਼ਕ (ਚਮਕ) – ਸ਼ੁੱਧ ਧਾਤਾਂ ਦੀ ਸਤਹ ਚਮਕਦਾਰ ਹੁੰਦੀ ਹੈ | ਧਾਤਾਂ ਦੇ ਇਸ ਗੁਣ ਨੂੰ ਧਾੜਵੀ ਚਮਕ (metallic lusture) ਕਹਿੰਦੇ ਹਨ, ਜਿਵੇਂ-ਸੋਨੇ ਵਿੱਚ ਪੀਲੇ ਰੰਗ ਦੀ ਚਮਕ, ਕਾਪਰ ਦੀ ਲਾਲ-ਭੂਰੇ ਰੰਗ ਦੀ ਚਮਕ ਅਤੇ ਐਲੂਮੀਨੀਅਮ ਦੀ ਚਿੱਟੇ ਰੰਗ ਦੀ ਚਮਕ ਹੁੰਦੀ ਹੈ ।
(ii) ਕਠੋਰਤਾ ਕਰੜਾਈ) – ਆਮ ਤੌਰ ਤੇ ਧਾਤਾਂ ਕਠੋਰ ਹੁੰਦੀਆਂ ਹਨ । ਵਿਭਿੰਨ ਧਾਤਾਂ ਦੀ ਕਠੋਰਤਾ ਭਿੰਨ-ਭਿੰਨ ਹੁੰਦੀ ਹੈ । ਪਰ (ਤਾਂਬਾ, ਆਇਰਨ (ਲੋਹਾ), ਐਲੂਮੀਨੀਅਮ ਬਹੁਤ ਕਠੋਰ ਧਾਤਾਂ ਹਨ ਜਦਕਿ ਸੋਡੀਅਮ, ਪੋਟਾਸ਼ੀਅਮ ਆਦਿ ਨਰਮ ਹਨ ।
(iii) ਕੁਟੀਯੋਗਤਾ – ਜਿਹੜੀਆਂ ਧਾਤਾਂ ਹਥੌੜੇ ਨਾਲ ਕੁੱਟ-ਕੁੱਟ ਕੇ ਪਤਲੀ ਚਾਦਰਾਂ ਵਿੱਚ ਪਰਿਵਰਤਿਤ ਕੀਤੀਆਂ ਜਾ ਸਕਦੀਆਂ ਹਨ ਉਨ੍ਹਾਂ ਨੂੰ ਕੁਟੀਣਯੋਗ ਧਾਤਾਂ ਕਹਿੰਦੇ ਹਨ । ਧਾਤਾਂ ਦੇ ਇਸ ਗੁਣ ਨੂੰ ਕੁਟੀਯੋਗਤਾ ਕਿਹਾ ਜਾਂਦਾ ਹੈ । ਸੋਨਾ ਅਤੇ ਚਾਂਦੀ ਸਭ ਤੋਂ ਵੱਧ ਕੁਟੀਣਯੋਗ ਧਾਤਾਂ ਹਨ ।
(iv) ਖਿੱਚੀਣਯੋਗਤਾ – ਉਹ ਧਾਤਾਂ ਜਿਨ੍ਹਾਂ ਦੀਆਂ ਖਿੱਚ ਕੇ ਪਤਲੀਆਂ ਤਾਰਾਂ ਬਣਾਈਆਂ ਜਾ ਸਕਦੀਆਂ ਹਨ, ਨੂੰ ਖਿੱਚੀਣਯੋਗ ਧਾਤਾਂ ਕਹਿੰਦੇ ਹਨ । ਧਾਤਾਂ ਦੇ ਇਸ ਗੁਣ ਨੂੰ ਖਿੱਚੀਯੋਗਤਾ ਕਿਹਾ ਜਾਂਦਾ ਹੈ । ਸੋਨਾ ਅਤੇ ਚਾਂਦੀ ਸਭ ਤੋਂ ਵੱਧ ਖਿੱਚੀਣਯੋਗ ਧਾਤਾਂ ਹਨ ।
(v) ਤਾਪੀ ਚਾਲਕਤਾ – ਧਾਤਾਂ ਸਾਧਾਰਨ ਤੌਰ ‘ਤੇ ਤਾਪ ਦੀਆਂ ਸੁਚਾਲਕ ਹੁੰਦੀਆਂ ਹਨ ।
ਹੋਰ ਕੁੱਝ ਧਾਤਾਂ ਤਾਪ ਦੀਆਂ ਕੁਚਾਲਕ ਹਨ-
ਉਦਾਹਰਨ-ਕਾਪਰ, ਐਲੂਮੀਨੀਅਮ ਆਦਿ ਤਾਪ ਦੀਆਂ ਸੁਚਾਲਕ ਹਨ ।
(vi) ਬਿਜਲੀ ਚਾਲਕਤਾ-ਧਾਤਾਂ ਬਿਜਲੀ ਦੀਆਂ ਵਧੀਆ ਚਾਲਕ ਹੁੰਦੀਆਂ ਹਨ, ਜਿਵੇਂ-ਸਿਲਵਰ, ਕਾਪਰ ਆਦਿ ਬਿਜਲੀ ਦੀਆਂ ਸੁਚਾਲਕ ਹਨ ।
ਧਾਤਾਂ ਦੇ ਰਸਾਇਣਿਕ ਗੁਣ – ਧਾਤਾਂ ਆਪਣੇ ਇਲੈੱਕਟਾਂ ਗੁਆ ਕੇ ਧਨਾਤਮਕ ਆਇਨ ਬਣਾਉਂਦੀਆਂ ਹਨ । ਇਸ ਲਈ ਇਹ ਬਿਜਲਈ ਧਨਾਤਮਕ ਤੱਤ ਹਨ ।
(1) ਧਾਤਾਂ ਦੀ ਆਕਸੀਜਨ ਨਾਲ ਕਿਰਿਆ – ਸਾਰੀਆਂ ਧਾਤਾਂ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਧਾੜਵੀ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ । ਇਨ੍ਹਾਂ ਆਕਸਾਈਡਾਂ ਦੀ ਪ੍ਰਕਿਰਤੀ ਖਾਰੀ ਹੁੰਦੀ ਹੈ, ਕਿਉਂਕਿ ਸਾਰੀਆਂ ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਭਿੰਨਭਿੰਨ ਹੁੰਦੀ ਹੈ, ਇਸ ਲਈ ਉਹ ਵੱਖ-ਵੱਖ ਤਾਪਮਾਨ ਤੇ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਦੀਆਂ ਹਨ ।
(i) ਸਾਧਾਰਨ ਤਾਪਮਾਨ ਤੇ Na, K ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਆਪਣੇ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ, ਜਿਹੜੇ ਕਿ ਪਾਣੀ ਵਿੱਚ ਘੁਲਣਸ਼ੀਲ ਹਨ ।
4Na(s) + O(g) → 2Na2O (s)
Na2 O(s) + H2O → 2NaOH (aq)
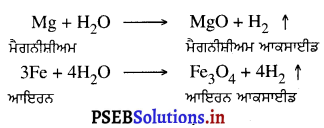
(ii) ਮੈਗਨੀਸ਼ੀਅਮ (Mg) ਦੇ ਰਿਬਨ ਨੂੰ ਬਾਲ ਕੇ ਜਦੋਂ ਹਵਾ ਵਿੱਚ ਰੱਖਿਆ ਜਾਂਦਾ ਹੈ, ਤਾਂ ਉਹ ਬਲਦਾ ਰਹਿੰਦਾ ਹੈ ਅਤੇ ਮੈਗਨੀਸ਼ੀਅਮ ਆਕਸਾਈਡ ਬਣਾਉਂਦਾ ਹੈ ।
![]()
(iii) ਤਾਂਬਾ (Cu) ਅਤੇ ਲੋਹਾ (Fe) ਖ਼ੁਸ਼ਕ ਹਵਾ ਵਿੱਚ ਉੱਚ ਤਾਪਮਾਨ ਤੇ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਦੇ ਹਨ ।

(2) ਧਾਤਾਂ ਦੀ ਹਲਕੇ ਤੇਜ਼ਾਬਾਂ ਨਾਲ ਕਿਰਿਆ – ਧਾਤਾਂ ਹਲਕੇ ਤੇਜ਼ਾਬਾਂ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਹਾਈਡਰੋਜਨ ਗੈਸ ਮੁਕਤ ਕਰਦੀਆਂ ਹਨ । ਵਿਭਿੰਨ ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਦੀ ਦਰ ਭਿੰਨ-ਭਿੰਨ ਹੁੰਦੀ ਹੈ ।
(i) Na, K, Zn, Mg, Fe ਆਦਿ ਘਟਦੇ ਕ੍ਰਮ ਵਿੱਚ ਕਿਰਿਆਸ਼ੀਲ ਹਨ-
2Na + 2HCl → 2NaCl +H2↑
Mg + 2HCl → MgCl2 + H2↑
Zn + H2SO4 → Zn SO4 + H2↑
(ii) ਪਤਲੇ ਨਾਈਟ੍ਰਿਕ ਤੇਜ਼ਾਬ Cu, Ag, Pb, Hg ਧਾਤਾਂ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ NO (ਨਾਈਟਰੋਜਨ ਆਕਸਾਈਡ) ਬਣਾਉਂਦਾ ਹੈ ।
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO +4H2O
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
(iii) Mg ਅਤੇ Mn ਨਾਲ ਪਤਲਾ ਨਾਈਟ੍ਰਿਕ ਤੇਜ਼ਾਬ, ਹਾਈਡਰੋਜਨ ਗੈਸ ਮੁਕਤ ਕਰਦਾ ਹੈ ।
Mg + 2HNO3 → Mg(NO3)2 + H2↑
(iv) ਸੋਨਾ ਅਤੇ ਪਲਾਟੀਨਮ ਪਤਲੇ ਤੇਜ਼ਾਬ ਨਾਲ ਕਿਰਿਆ ਨਹੀਂ ਕਰਦੇ ।
(3) ਧਾਤਾਂ ਦੀ ਕਲੋਰੀਨ ਨਾਲ ਕਿਰਿਆ – ਧਾਤਾਂ, ਕਲੋਰੀਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਬਿਜਲੀ ਸੰਯੋਜਕ ਕਲੋਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ ।
Ca + Cl2 → CaCl2
(4) ਧਾਤਾਂ ਦੀ ਹਾਈਡਰੋਜਨ ਨਾਲ ਕਿਰਿਆ – ਕਿਰਿਆਸ਼ੀਲ ਧਾਤਾਂ Na, K ਅਤੇ Ca ਆਦਿ ਹਾਈਡਰੋਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਆਪਣੇ ਹਾਈਡਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ ।

(5) ਧਾਤਾਂ ਦੀ ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ-
(i) ਜਦੋਂ ਪਾਣੀ ਸਾਧਾਰਨ ਤਾਪਮਾਨ ਤੇ ਹੋਵੇ ਤਾਂ Na, K, Ca ਆਦਿ ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਹਾਈਡਰੋਜਨ ਗੈਸ ਮੁਕਤ ਕਰਦੀਆਂ ਹਨ ।

(ii) ਜਦੋਂ ਪਾਣੀ ਉਬਲਦਾ ਹੋਵੇ ਤਾਂ Mg, Zn, Fe ਕਿਰਿਆ ਕਰਕੇ ਆਪਣੇ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ ।
![]()
ਪ੍ਰਸ਼ਨ 2.
ਅਧਾਤਾਂ ਦੇ ਭੌਤਿਕ ਅਤੇ ਰਸਾਇਣਿਕ ਗੁਣ ਲਿਖੋ ।
ਉੱਤਰ-
ਭੌਤਿਕ ਗੁਣ-
(i) ਭੌਤਿਕ ਅਵਸਥਾ – ਅਧਾਤਾਂ ਆਮ ਤੌਰ ‘ਤੇ ਗੈਸ ਜਾਂ ਠੋਸ ਅਵਸਥਾ ਵਿੱਚ ਹੁੰਦੀਆਂ ਹਨ, ਪਰੰਤੂ ਬਰੋਮੀਨ ਸਾਧਾਰਨ ਤਾਪਮਾਨ ਉੱਤੇ ਦਵ ਹੈ ।
(ii) ਚਾਲਕਤਾ – ਅਧਾਤਾਂ ਆਮ ਤੌਰ ਤੇ ਬਿਜਲੀ ਦੀਆਂ ਕੁਚਾਲਕ ਹੁੰਦੀਆਂ ਹਨ, ਪਰੰਤੂ ਗਰੇਫ਼ਾਈਟ ਬਿਜਲੀ ਦਾ ਸੂਚਾਲਕ ਹੈ ।
(iii) ਅਧਾਤਾਂ ਨਾ ਹੀ ਕੁਟੀਣਯੋਗ ਅਤੇ ਨਾ ਹੀ ਖਿੱਚੀਣਯੋਗ ਹਨ ।
(iv) ਧਾਤਵੀ ਚਮਕ – ਅਧਾਤਾਂ ਵਿੱਚ ਚਮਕ ਨਹੀਂ ਹੁੰਦੀ, ਪਰੰਤੂ ਆਇਓਡੀਨ ਵਿੱਚ ਚਮਕ ਹੁੰਦੀ ਹੈ । ਇਸਦਾ ਕਾਰਨ ਉਸਦੀ ਆਇਨਨ ਉਰਜਾ (lonisation Energy) ਦਾ ਘੱਟ ਹੋਣਾ ਹੈ ।
(v) ਨਰਮਈ – ਅਧਾਤਾਂ ਨਰਮ ਹੁੰਦੀਆਂ ਹਨ । ਸਿਵਾਏ ਹੀਰੇ ਦੇ, ਜੋ ਬਹੁਤ ਸਖ਼ਤ ਹੈ ।
ਅਧਾਤਾਂ ਦੇ ਰਸਾਇਣਿਕ ਗੁਣ-
ਅਧਾਤਾਂ ਦੇ ਮੁੱਖ ਰਸਾਇਣਿਕ ਗੁਣ ਇਹ ਹਨ-
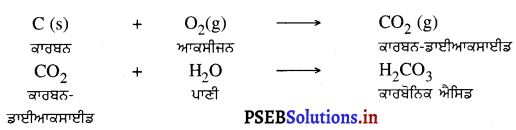
(i) ਕਾਰਬਨ ਦੀ ਆਕਸੀਜਨ ਨਾਲ ਕਿਰਿਆ – ਕਾਰਬਨ, ਆਕਸੀਜਨ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਤੇਜ਼ਾਬੀ ਆਕਸਾਈਡ ਬਣਾਉਂਦਾ ਹੈ । CO2 ਦਾ ਸੁਭਾਅ ਤੇਜ਼ਾਬੀ ਹੈ । ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਕਾਰਬੋਨਿਕ ਤੇਜ਼ਾਬ ਬਣਾਉਂਦੀ ਹੈ ।
(ii) ਨਾਈਟਰੋਜਨ ਅਤੇ ਸਲਫ਼ਰ ਦੀ ਹਾਈਡਰੋਜਨ ਨਾਲ ਕਿਰਿਆ – ਅਨੁਕੂਲ ਹਾਲਤਾਂ ਵਿੱਚ ਨਾਈਟਰੋਜਨ ਅਤੇ ਸਲਫ਼ਰ, ਹਾਈਡਰੋਜਨ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਅਮੋਨੀਆ ਅਤੇ ਹਾਈਡਰੋਜਨ ਸਲਫ਼ਾਈਡ ਬਣਾਉਂਦੀ ਹੈ ।

(iii) ਸਲਫਰ ਅਤੇ ਹਾਈਡਰੋਜਨ ਦੀ ਆਕਸੀਜਨ ਨਾਲ ਕਿਰਿਆ – ਸਲਫਰ, ਆਕਸੀਜਨ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਸਲਫਰ ਡਾਈਆਕਸਾਈਡ ਬਣਾਉਂਦਾ ਹੈ । ਹਾਈਡਰੋਜਨ, ਆਕਸੀਜਨ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਪਾਣੀ ਬਣਾਉਂਦੀ ਹੈ ਅਤੇ ਇਸ ਕਿਰਿਆ ਦੌਰਾਨ ਵੱਡੀ ਮਾਤਰਾ ਵਿੱਚ ਤਾਪ ਊਰਜਾ ਪੈਦਾ ਹੁੰਦੀ ਹੈ ।

(iv) ਫ਼ਾਸਫੋਰਸ ਦੀ ਕਲੋਰੀਨ ਨਾਲ ਕਿਰਿਆ-ਫ਼ਾਸਫੋਰਸ ਕਲੋਰੀਨ ਨਾਲ ਕਿਰਿਆ ਕਰ ਕੇ ਫ਼ਾਸਫੋਰਸ ਡ੍ਰਾਈਕਲੋਰਾਈਡ ਬਣਾਉਂਦੀ ਹੈ ।
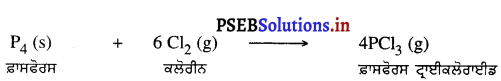
ਪ੍ਰਸ਼ਨ 3.
ਧਾਤ ਕੂਮ ਕੀ ਹੈ ? ਇਸ ਪ੍ਰਕਰਮ ਵਿੱਚ ਪ੍ਰਯੁਕਤ ਚਰਨਾਂ ਦਾ ਵਿਸਥਾਰ ਨਾਲ ਵਰਣਨ ਕਰੋ ।
ਜਾਂ
ਕੱਚੀ-ਧਾਤ ਤੋਂ ਧਾਤ ਨਿਸ਼ਕਰਸ਼ਨ ਵਿੱਚ ਵਰਤੇ ਜਾਣ ਵਾਲੇ ਚਰਨਾਂ ਦੇ ਬਾਰੇ ਲਿਖੋ ।
ਉੱਤਰ-
ਧਾਤ ਕੂਮ (Metallurgy) – ਕੱਚੀ-ਧਾਤ ਤੋਂ ਧਾਤ ਨਿਸ਼ਕਰਸ਼ਨ ਅਤੇ ਬਾਅਦ ਵਿੱਚ ਉਸਦੀ ਸੁਧਾਈ ਕਰਕੇ ਵਰਤੋਂ ਵਿਚ ਲਿਆਉਣ ਯੋਗ ਬਣਾਉਣ ਦੇ ਪ੍ਰਕਰਮ ਨੂੰ ਧਾਤ ਮ ਕਹਿੰਦੇ ਹਨ ।
ਧਾਤ ਕੂਮ ਵਿੱਚ ਆਉਣ ਵਾਲੇ ਚਰਨ – ਧਾਤਭੂਮ ਵਿੱਚ ਹੇਠ ਲਿਖੇ ਤਿੰਨ ਪ੍ਰਮੁੱਖ ਚਰਨ ਹੁੰਦੇ ਹਨ-
(i) ਕੱਚੀ-ਧਾਤ ਦਾ ਸੰਘਣਾਪਨ
(ii) ਲਘੂਕਰਨ
(iii) ਸੁਧਾਈ ।
(i) ਕੱਚੀ-ਧਾਤ ਦਾ ਸੰਘਣਾਪਨ (Enrichment of Ores) – ਧਰਤੀ ਤੋਂ ਕੱਢੀ ਗਈ ਕੱਚੀ ਧਾਤ ਵਿੱਚ ਆਮ ਕਰਕੇ ਬਹੁਤ ਮਾਤਰਾ ਵਿੱਚ ਅਸ਼ੁੱਧੀਆਂ ਜਿਵੇਂ ਕਿ ਮਿੱਟੀ, ਰੇਤ ਆਦਿ ਮਿਲੀਆਂ ਹੁੰਦੀਆਂ ਹਨ ਜਿਨ੍ਹਾਂ ਨੂੰ ਗੈਂਗ (Gangue) ਆਖਦੇ ਹਨ | ਧਾਤਾਂ ਦੇ ਨਿਸ਼ਕਰਸ਼ਨ ਤੋਂ ਪਹਿਲਾਂ ਕੱਚੀ ਧਾਤ ਵਿੱਚੋਂ ਅਸ਼ੁੱਧੀਆਂ ਨੂੰ ਹਟਾਉਣਾ ਬਹੁਤ ਜ਼ਰੂਰੀ ਹੈ । ਕੱਚੀ-ਧਾਤ ਤੋਂ ਗੈਂਗ ਨੂੰ ਵੱਖ ਕਰਨ ਦੀ ਪ੍ਰਕਿਰਿਆ ਨੂੰ ਕੱਚੀ-ਧਾਤ ਦਾ ਸੰਘਣਾਪਨ ਕਹਿੰਦੇ ਹਨ । ਜੇ ਕੱਚੀ-ਧਾਤ ਅਤੇ ਗੈਂਗ ਦੇ ਭੌਤਿਕ ਜਾਂ ਰਸਾਇਣਿਕ ਗੁਣਾਂ ਉੱਪਰ ਆਧਾਰਿਤ ਹੁੰਦੀਆਂ ਹਨ । ਇਸ ਮੰਤਵ ਲਈ ਹੇਠ ਲਿਖੀਆਂ ਵਿਧੀਆਂ ਵਰਤੀਆਂ ਜਾਂਦੀਆਂ ਹਨ ।
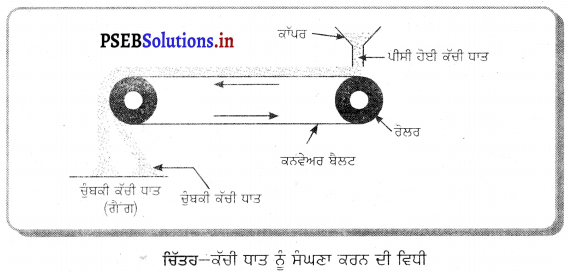
(1) ਚੁੰਬਕੀ ਵਖਰੇਵਾਂ ਵਿਧੀ (Magnetic Separation Process) – ਇਹ ਵਿਧੀ ਚੁੰਬਕੀ ਕਣਾਂ (ਲੋਹਾ, ਕੋਬਾਲਟ, ਨਿਕਲ ਨੂੰ ਵੱਖ ਕਰਨ ਲਈ ਵਰਤੀ ਜਾਂਦੀ ਹੈ । ਜਿਹੜੇ ਖਣਿਜ ਚੁੰਬਕੀ ਗੁਣ ਰੱਖਦੇ ਹਨ, ਉਹ ਚੁੰਬਕੀ ਖੇਤਰ ਵੱਲ ਆਕਰਸ਼ਿਤ ਹੁੰਦੇ ਹਨ, ਜਦਕਿ ਗੈਂਗ ਆਦਿ ਆਕਰਸ਼ਿਤ ਨਹੀਂ ਹੁੰਦੇ । ਝੋਮਾਈਟ ਅਤੇ ਪਾਇਰੋਲਿਉਸਾਈਟ ਕੱਚੀਆਂ ਧਾਤਾਂ ਇਸੇ ਵਿਧੀਆਂ ਦੁਆਰਾ ਸੰਘਣੀਆਂ ਕੀਤੀਆਂ ਜਾਂਦੀਆਂ ਹਨ । ਇਸ ਵਿਧੀ ਵਿੱਚ ਪੀਸੀ ਹੋਈ ਕੱਚੀ ਧਾਤ ਨੂੰ ਇੱਕ ਕਨਵੇਅਰ ਬੈਲਟ ਉੱਪਰ ਰੱਖਦੇ ਹਾਂ | ਕਨਵੇਅਰ ਬੈਲਟ ਦੋ ਰੋਲਰਾਂ ਉੱਪਰੋਂ ਗੁਜ਼ਰਦੀ ਹੈ, ਜਿਨ੍ਹਾਂ ਵਿੱਚੋਂ ਚੁੰਬਕੀ ਅਤੇ ਅਚੁੰਬਕੀ ਪਦਾਰਥ ਦੋ ਵੱਖ-ਵੱਖ ਢੇਰਾਂ ਵਜੋਂ ਇਕੱਠੇ ਹੋ ਜਾਂਦੇ ਹਨ । ਲੋਹੇ ਦੀ ਕੱਚੀ ਧਾਤ ਮੈਗਨੇਟਾਈਟ ਦਾ ਸੰਘਣਾਕਰਨ ਇਸੇ ਵਿਧੀ ਦੁਆਰਾ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
(2) ਵਚਾਲਿਤ ਧੋਣਾ (Hydraulic Washing) – ਇਸ ਵਿਧੀ ਵਿੱਚ ਬਾਰੀਕ ਜਾਂ ਪੀਸੀ ਹੋਈ ਕੱਚੀ ਧਾਤ ਨੂੰ ਪਾਣੀ ਦੀ ਤੇਜ਼ ਧਾਰਾ ਵਿੱਚ ਧੋਇਆ ਜਾਂਦਾ ਹੈ । ਇਸ ਤੇਜ਼ ਧਾਰਾ ਵਿੱਚ ਹਲਕੇ ਗੈਂਗ ਕਣ ਵਹਿ ਜਾਂਦੇ ਹਨ ਜਦਕਿ ਭਾਰੀ ਖਣਿਜੀ ਕਣ ਤਲੀ ਤੇ ਹੇਠਾਂ ਬੈਠ ਜਾਂਦੇ ਹਨ । ਟਿੱਨ ਅਤੇ ਲੈਂਡ ਦੀਆਂ ਕੱਚੀਆਂ ਧਾਤਾਂ ਨੂੰ ਇਸੇ ਵਿਧੀ ਦੁਆਰਾ ਸੰਘਣਾ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
(3) ਝੱਗ ਤਰਾਉ ਵਿਧੀ (Froth Floatation Process) – ਇਸ ਵਿਧੀ ਵਿੱਚ ਮਹੀਨ ਪੀਸੀ ਹੋਈ ਕੱਚੀ ਧਾਤ ਨੂੰ ਪਾਣੀ ਜਾਂ ਕਿਸੇ ਤੇਲ ਨਾਲ ਇੱਕ ਵੱਡੇ ਟੈਂਕ ਵਿੱਚ ਮਿਲਾਇਆ ਜਾਂਦਾ ਹੈ । ਖਣਿਜ ਕਣ ਪਹਿਲੇ ਹੀ ਤੇਲ ਨਾਲ ਭਿੱਜ ਜਾਂਦੇ ਹਨ, ਜਦਕਿ
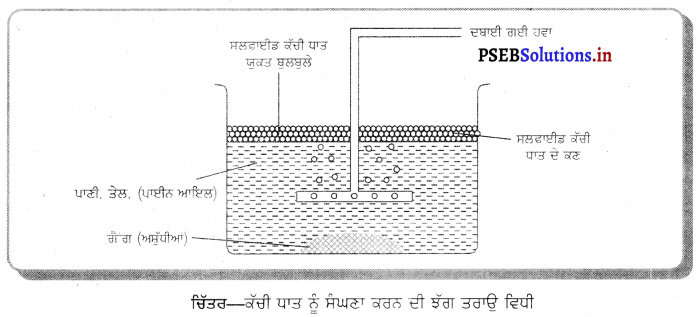
ਗੈਂਗ ਦੇ ਕਣ ਪਾਣੀ ਨਾਲ ਭਿੱਜ ਜਾਂਦੇ ਹਨ । ਇਸ ਮਿਸ਼ਰਨ ਵਿਚੋਂ ਹਵਾ ਗੁਜ਼ਾਰੀ ਜਾਂਦੀ ਹੈ, ਜਿਸ ਨਾਲ ਖਣਿਜੀ ਕਣ ਯੁਕਤ ਤੇਲ ਦੀ ਝੱਗ ਬਣ ਜਾਂਦੀ ਹੈ, ਜਿਹੜੀ ਪਾਣੀ ਦੀ ਸਤਾ ਤੇ ਤੈਰਨ ਲਗਦੀ ਹੈ ਜਿਸ ਨੂੰ ਬੜੀ ਸਹਿਜੇ ਪਾਣੀ ਉੱਪਰੋਂ ਕੱਢਿਆ ਜਾ ਸਕਦਾ ਹੈ । ਤਾਂਬੇ, ਲੈਂਡ, ਜ਼ਿੰਕ ਦੇ ਸਲਫਾਈਡਾਂ ਨੂੰ ਸੰਘਣਾ ਕਰਨ ਲਈ ਇਸੇ ਵਿਧੀ ਦੀ ਵਰਤੋਂ ਕੀਤੀ ਜਾਂਦੀ ਹੈ ।
(ii) ਰਸਾਇਣਿਕ ਵਿਧੀਆਂ (Chemical Methods) – ਰਸਾਇਣਿਕ ਵਿਧੀਆਂ ਵਿੱਚ ਖਣਿਜ ਅਤੇ ਗੈਂਗ ਵਿਚਲੇ ਰਸਾਇਣਿਕ ਗੁਣਾਂ ਦੀ ਭਿੰਨਤਾ ਨੂੰ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ । ਇਸ ਦੀ ਇੱਕ ਮੁੱਖ ਵਿਧੀ ਹੈ-ਬੇਅਰ ਦੀ ਵਿਧੀ ਜਿਸ ਦੁਆਰਾ ਬਾਕਸਾਈਟ ਤੋਂ ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ ਪ੍ਰਾਪਤ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
(1) ਬੇਅਰ ਵਿਧੀ ਦੁਆਰਾ ਐਲੂਮੀਨੀਅਮ ਦੀ ਕੱਚੀ ਧਾਤ ਨੂੰ ਸੰਘਣਾ ਕਰਨਾ – ਇਸ ਵਿਧੀ ਵਿੱਚ ਬਾਕਸਾਈਟ ਦਾ ਗਰਮ ਸੋਡੀਅਮ ਹਾਈਡਰੋਕਸਾਈਡ ਨਾਲ ਲਘੂਕਰਨ ਕੀਤਾ ਜਾਂਦਾ ਹੈ, ਜਿਹੜਾ ਕਿ ਪਾਣੀ ਵਿੱਚ ਘੁਲਣਸ਼ੀਲ ਹੈ । ਗੈਂਗ ਨੂੰ ਛਾਣ ਕੇ ਵੱਖ ਕਰ ਦਿੱਤਾ ਜਾਂਦਾ ਹੈ । ਐਲੂਮੀਨੀਅਮ ਦਾ ਅਵਖੇਪ ਐਲੂਮੀਨੀਅਮ ਹਾਈਡਰੋਕਸਾਈਡ ਦੇ ਰੂਪ ਵਿੱਚ ਬਣਦਾ ਹੈ । ਇਸ ਫਿਲਟ ਦੀ ਹਾਈਡਰੋਕਲੋਰਿਕ ਐਸਿਡ ਨਾਲ ਕਿਰਿਆ ਕੀਤੀ ਜਾਂਦੀ ਹੈ । ਇਸ ਤੋਂ ਬਾਅਦ ਐਲੂਮੀਨੀਅਮ ਹਾਈਡਰੋਕਸਾਈਡ ਨੂੰ ਗਰਮ ਕਰਕੇ ਸ਼ੁੱਧ ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ ਪ੍ਰਾਪਤ ਹੁੰਦਾ ਹੈ । ਭਿੰਨ-ਭਿੰਨ ਕਿਰਿਆਵਾਂ ਇਸ ਪ੍ਰਕਾਰ ਹਨ-

(2) ਸੰਘਣਤ ਕੱਚੀ-ਧਾਤ ਦਾ ਧਾਤ ਆਕਸਾਈਡ ਵਿੱਚ ਬਦਲਣਾ-
ਭੰਨਣ- ਇਸ ਕਿਰਿਆ ਵਿੱਚ ਕੱਚੀ-ਧਾਤ ਨੂੰ ਹਵਾ ਦੀ ਹੋਂਦ ਵਿੱਚ ਗਰਮ ਕਰਕੇ ਧਾਤ ਆਕਸਾਈਡ ਪ੍ਰਾਪਤ ਕਰਦੇ ਹਨ ਜੋ ਆਸਾਨੀ ਨਾਲ ਲਘੂਸ਼ਿਤ ਹੋ ਕੇ ਧਾਤ ਨੂੰ ਵੱਖ ਕਰ ਦਿੰਦਾ ਹੈ ।
ਜ਼ਿੰਕ ਬੈਲੰਡੀ ਵਿੱਚ ਜ਼ਿੰਕ ਸਲਫਾਈਡ ਹੁੰਦਾ ਹੈ । ਜਦੋਂ ਸੰਘਣਤ ਜ਼ਿੰਕ ਸਲਫਾਈਡ ਨੂੰ ਹਵਾ ਵਿੱਚ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ਤਾਂ ਇਹ ਆਕਸੀਕ੍ਰਿਤ ਹੋ ਕੇ ਜ਼ਿੰਕ ਆਕਸਾਈਡ ਬਣਾ ਦਿੰਦਾ ਹੈ ।
![]()
ਭਸਮੀਕਰਨ – ਇਸ ਕਿਰਿਆ ਵਿੱਚ ਕੱਚੀ-ਧਾਤ ਨੂੰ ਹਵਾ ਦੀ ਅਣਹੋਂਦ ਵਿੱਚ ਗਰਮ ਕਰਕੇ ਸਿਲ ਅਤੇ ਵਾਸ਼ਪਸ਼ੀਲ ਅਸ਼ੁੱਧੀਆਂ ਵੱਖ ਕਰ ਦਿੰਦਾ ਹੈ ।
ਜਦੋਂ ਕਿਸੇ ਕਾਰਬੋਨੇਟ ਕੱਚੀ-ਧਾਤ ਨੂੰ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ਤਾਂ ਉਹ ਵਿਘਟਿਤ ਹੋ ਕੇ ਧਾਤ ਆਕਸਾਈਡ ਬਣਾ ਦਿੰਦਾ ਹੈ ।
![]()
(3) ਧਾਤ ਆਕਸਾਈਡ ਤੋਂ ਧਾਤ ਪ੍ਰਾਪਤ ਕਰਨਾ – ਧਾਤ ਆਕਸਾਈਡ ਤੋਂ ਧਾਤ ਪ੍ਰਾਪਤ ਕਰਨ ਲਈ ਉਸਨੂੰ ਕਿਸੇ ਲਘੂਕਾਰਕ ਦੇ ਨਾਲ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਜ਼ਿੰਕ, ਟਿੱਨ ਅਤੇ ਨਿੱਕਲ ਜਿਹੀਆਂ ਧਾਤਾਂ ਦੇ ਆਕਸਾਈਡਾਂ ਦਾ ਲਘੂਕਰਨ ਕਰਕੇ ਧਾਤਾਂ ਪ੍ਰਾਪਤ ਕਰਨ ਲਈ ਕਾਰਬਨ ਲਘੂਕਾਰਕ ਦੇ ਰੂਪ ਵਜੋਂ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ ।
ZnO (s) +C (s) → Zn (s) + CO (g)
ਮੱਧਮ ਕਿਰਿਆਸ਼ੀਲਤਾ ਵਾਲੀ ਧਾਤਾਂ ਦੇ ਆਕਸਾਈਡਾਂ ਦਾ ਲਘੂਕਰਨ ਕਰਨ ਲਈ ਸੋਡੀਅਮ, ਕੈਲਸ਼ੀਅਮ ਅਤੇ ਐਲੂਮੀਨੀਅਮ ਜਿਹੀਆਂ ਕਿਰਿਆਸ਼ੀਲ ਧਾਤਾਂ ਵੀ ਲਘੂਕਾਰਕ ਦੇ ਰੂਪ ਵਜੋਂ ਪ੍ਰਯੋਗ ਕੀਤੀਆਂ ਜਾ ਸਕਦੀਆਂ ਹਨ ।
3MnO2 (s) +4Al(s) → 3Mn (s) + 2A l2O3(s) + ਤਾਪ
(iii) ਧਾਤਾਂ ਦਾ ਸ਼ੁੱਧੀਕਰਨ (Refining of Metals) – ਧਾਤਵੀ ਆਕਸਾਈਡਾਂ ਦੇ ਲਘੂਕਰਨ ਤੋਂ ਬਾਅਦ ਪ੍ਰਾਪਤ ਹੋਈਆਂ ਧਾਤਾਂ ਵਿੱਚ ਕਈ ਅਸ਼ੁੱਧੀਆਂ ਹੁੰਦੀਆਂ ਹਨ । ਸ਼ੁੱਧ ਧਾਤਾਂ ਲੈਣ ਲਈ ਇਨ੍ਹਾਂ ਅਸ਼ੁੱਧੀਆਂ ਨੂੰ ਕੱਢਣਾ ਬਹੁਤ ਜ਼ਰੂਰੀ ਹੈ । ਸ਼ੁੱਧੀਕਰਨ ਲਈ ਵਰਤੀ ਜਾਣ ਵਾਲੀ ਵਿਧੀ ਅਸ਼ੁੱਧੀਆਂ ਅਤੇ ਧਾਤਾਂ ਦੋਹਾਂ ਦੀ ਪ੍ਰਕਿਰਤੀ ‘ਤੇ ਨਿਰਭਰ ਕਰਦੀ ਹੈ ।
(1) ਕਸ਼ੀਦਣ ਵਿਧੀ (Distillation Method) – ਨੀਵੇਂ ਉਬਾਲ ਅੰਕ ਵਾਲੀਆਂ ਧਾਤਾਂ ਨੂੰ ਇਸ ਵਿਧੀ ਰਾਹੀਂ ਸ਼ੁੱਧ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਜ਼ਿੰਕ, ਕੈਡਮੀਅਮ ਅਤੇ ਮਰਕਰੀ ਆਦਿ ਧਾਤਾਂ ਬਹੁਤ ਛੇਤੀ ਵਾਸ਼ਪ ਵਿੱਚ ਬਦਲਦੀਆਂ ਹਨ । ਇਸ ਲਈ ਇਨ੍ਹਾਂ ਨੂੰ ਕਸ਼ੀਦਣ ਵਿਧੀ ਰਾਹੀਂ ਸ਼ੁੱਧ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
(2) ਗਲਣ ਵਿਧੀ, ਪਿਘਲਾਓ ਵਿਧੀ (Liquation) – ਇਸ ਕਿਰਿਆ ਵਿੱਚ ਢਲਾਨ ਯੁਕਤ ਭੱਠੀ ਦੀ ਵਰਤੋਂ ਕੀਤੀ ਜਾਂਦੀ ਹੈ । ਭੱਠੀ ਦਾ ਤਾਪਮਾਨ ਧਾਤ ਦੇ ਪਿਘਲਾਓ ਅੰਕ ਤੋਂ ਕੁੱਝ ਵੱਧ ਰੱਖਿਆ ਜਾਂਦਾ ਹੈ । ਅਸ਼ੁੱਧ ਧਾਤ ਨੂੰ ਭੱਠੀ ਦੇ ਸਭ ਤੋਂ ਉੱਪਰਲੇ ਸਿਰੇ ਤੇ ਰੱਖਿਆ ਜਾਂਦਾ ਹੈ । ਗਰਮ ਹੋਣ ਤੇ ਧਾਤਾਂ ਪਿਘਲ ਕੇ ਹੇਠਾਂ ਆ ਜਾਂਦੀਆਂ ਹਨ, ਜਦਕਿ ਠੋਸ ਅਸ਼ੁੱਧੀਆਂ ਉੱਥੇ ਹੀ ਰਹਿ ਜਾਂਦੀਆਂ ਹਨ । ਇਸ ਵਿਧੀ ਦੁਆਰਾ ਟਿੱਨ, ਲੈਂਡ ਅਤੇ ਬਿਸਮਥ ਦਾ ਸ਼ੁੱਧੀਕਰਨ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
(3) ਬਿਜਲਈ ਸ਼ੁੱਧੀਕਰਨ (Electrolytic Refining) – ਧਾਤਾਂ ਦੀ ਸਫ਼ਾਈ ਹੀ ਧਾਤਾਂ ਦਾ ਸ਼ੁੱਧੀਕਰਨ ਅਖਵਾਉਂਦਾ ਹੈ ਤਾਂਬਾ, ਟਿਨ, ਲੈਂਡ, ਸੋਨਾ, ਜ਼ਿੰਕ, ਕੋਮੀਅਮ ਅਤੇ ਨਿਕਲ ਜਿਹੀਆਂ ਅਨੇਕਾਂ ਧਾਤਾਂ ਦਾ ਸ਼ੁੱਧੀਕਰਨ ਬਿਜਲਈ ਅਪਘਟਨ ਦੁਆਰਾ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਸ਼ੁੱਧ ਧਾਤ ਦੀ ਪੱਟੀ ਨੂੰ ਕੈਥੋਡ ਅਤੇ ਅਸ਼ੁੱਧ ਧਾਤ ਦੀ ਪੱਟੀ ਨੂੰ ਐਨੋਡ ਵਜੋਂ ਲਿਆ ਜਾਂਦਾ ਹੈ । ਬਿਜਲਈ ਅਪਘਟਨ ਲਈ ਧਾਤ ਦਾ ਕੋਈ ਯੋਗਿਕ ਲਿਆ ਜਾਂਦਾ ਹੈ । ਜਦੋਂ ਬਿਜਲਈ ਅਪਘਟਨ ਦੌਰਾਨ
ਐਨੋਡ ਬਿਜਲਈ ਧਾਰਾ ਪ੍ਰਵਾਹਿਤ ਕਰਦੇ ਹਾਂ ਤਾਂ ਧਾਤ ਕੈਥੋਡ ਤੇ ਜਮਾਂ ਹੋ ਜਾਂਦੀ ਹੈ ਅਤੇ ਐਨੋਡ ਤੇ ਸਥਿਤ ਹੋਰ ਕਿਰਿਆਸ਼ੀਲ ਘੋਲ (ਸ਼ੁੱਧ ਤਾਂਬੇ ਦੀ ਪੱਟੀ) ਧਾਤਾਂ ਅਪਘਟਨ ਦੇ ਘੋਲ ਵਿੱਚ ਚਲੀਆਂ ਜਾਂਦੀਆਂ ਹਨ । ਘੱਟ ਕਿਰਿਆਸ਼ੀਲ ਧਾਤਾਂ ਜਿਵੇਂ ਸੋਨਾ ਅਤੇ ਚਾਂਦੀ ਬਿਜਲਈ ਚਿੱਤਰ-ਧਾਤਾਂ ਦਾ ਬਿਜਲਈ ਸ਼ੁੱਧੀਕਰਨ ਅਪਘਟਨ ਸੈੱਲ ਦੀ ਤਲੀ ਤੇ ਜਾ ਡਿੱਗਦੀਆਂ ਹਨ ।
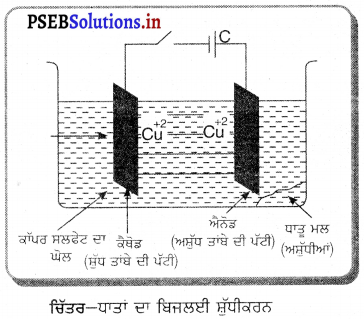
ਜੇਕਰ ਤਾਂਬੇ ਦੀ ਸੁਧਾਈ ਕਰਨੀ ਹੋਵੇ ਤਾਂ ਬਿਜਲਈ ਅਪਘਟਨ ਵਜੋਂ ਕਾਪਰ ਸਲਫੇਟ ਦਾ ਤੇਜ਼ਾਬੀ ਘੋਲ ਲਿਆ ਜਾਂਦਾ ਹੈ ਅਤੇ ਸੈੱਲ ਵਿੱਚ ਹੋਣ ਵਾਲੀਆਂ ਕਿਰਿਆਵਾਂ ਹੇਠ ਲਿਖੇ ਅਨੁਸਾਰ ਹੁੰਦੀਆਂ ਹਨ-
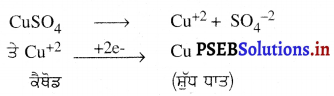
![]()
ਪ੍ਰਸ਼ਨ 4.
ਧਾਤਾਂ ਅਤੇ ਅਧਾਤਾਂ ਦੇ ਗੁਣਾਂ ਵਿੱਚ ਅੰਤਰ ਲਿਖੋ ।
ਉੱਤਰ-
ਧਾਤਾਂ ਅਤੇ ਅਧਾਤਾਂ ਵਿੱਚ ਅੰਤਰ-
| ਧਾਤਾਂ (Metals) | ਅਧਾਤਾਂ (Non-Metals) |
| ਭੌਤਿਕ ਗੁਣਾਂ ਦੀ ਤੁਲਨਾ-
(1) ਧਾਤਾਂ ਸਾਧਾਰਨ ਤਾਪਮਾਨ ‘ਤੇ ਠੋਸ ਹੁੰਦੀਆਂ ਹਨ, ਸਿਰਫ਼ ਪਾਰਾ ਹੀ ਸਾਧਾਰਨ ਤਾਪਮਾਨ ‘ਤੇ ਤਰਲ ਅਵਸਥਾ ਵਿਚ ਹੁੰਦਾ ਹੈ । |
(1) ਅਧਾਤਾਂ ਸਾਧਾਰਨ ਤਾਪਮਾਨ ਤੇ ਤਿੰਨੇ ਅਵਸਥਾਵਾਂ ਵਿੱਚ ਮਿਲਦੀਆਂ ਹਨ । ਫ਼ਾਸਫੋਰਸ ਅਤੇ ਸਲਫਰ ਠੋਸ ਰੂਪ ਵਿੱਚ, H2, O2, N2 ਗੈਸ ਰੂਪ ਵਿੱਚ ਅਤੇ ਬੋਮੀਨ ਤਰਲ ਰੂਪ ਵਿੱਚ ਮਿਲਦੀ ਹੈ । |
| (2) ਧਾਤਾਂ ਖਿੱਚੀਣਯੋਗ ਅਤੇ ਕੁਟੀਣਯੋਗ ਹੁੰਦੀਆਂ ਹਨ । | (2) ਇਹ ਆਮ ਤੌਰ ‘ਤੇ ਭੁਰਭੁਰੀਆਂ ਹੁੰਦੀਆਂ ਹਨ । |
| (3) ਧਾਤਾਂ ਆਮ ਤੌਰ ‘ਤੇ ਚਮਕਦਾਰ ਹੁੰਦੀਆਂ ਹਨ ਅਰਥਾਤ ਇਨ੍ਹਾਂ ਦੀ ਧਾਤਵੀ ਚਮਕ ਹੁੰਦੀ ਹੈ । | (3) ਅਧਾਤਾਂ ਵਿੱਚ ਧਾਤਵੀ ਚਮਕ ਨਹੀਂ ਹੁੰਦੀ ਪਰ ਹੀਰਾ, ਗ੍ਰੇਫਾਈਟ ਅਤੇ ਆਇਓਡੀਨ ਇਸ ਦੇ ਅਪਵਾਦ ਹਨ । |
| (4) ਧਾਤਾਂ ਤਾਪ ਅਤੇ ਬਿਜਲੀ ਦੀਆਂ ਸੂਚਾਲਕ ਹੁੰਦੀਆਂ ਹਨ, ਪਰ ਬਿਸਮਥ ਇਸ ਦਾ ਅਪਵਾਦ ਹੈ । | (4) ਗੇਫਾਈਟ ਤੋਂ ਇਲਾਵਾ ਬਾਕੀ ਸਾਰੀਆਂ ਅਧਾਤਾਂ ਕੁਚਾਲਕ ਹੁੰਦੀਆਂ ਹਨ । |
| (5) ਧਾਤਾਂ ਦੇ ਪਿਘਲਾਓ ਅਤੇ ਉਬਾਲ ਅੰਕ ਕਾਫ਼ੀ ਵੱਧ ਹੁੰਦੇ ਹਨ । | (5) ਅਧਾਤਾਂ ਦੇ ਪਿਘਲਾਓ ਅਤੇ ਉਬਾਲ ਅੰਕ ਕਾਫ਼ੀ ਘੱਟ ਹੁੰਦੇ ਹਨ । |
| (6) ਧਾਤਾਂ ਆਮ ਤੌਰ ‘ਤੇ ਕਠੋਰ ਹੁੰਦੀਆਂ ਹਨ, ਪਰ ਸੋਡੀਅਮ ਅਤੇ ਪੋਟਾਸ਼ੀਅਮ ਚਾਕੂ ਨਾਲ ਕੱਟੀਆਂ ਜਾ ਸਕਦੀਆਂ ਹਨ । | (6) ਇਨ੍ਹਾਂ ਦੀ ਕਠੋਰਤਾ ਭਿੰਨ-ਭਿੰਨ ਹੁੰਦੀ ਹੈ । ਹੀਰਾ ਸਭ ਤੋਂ ਕਠੋਰ ਪਦਾਰਥ ਹੈ । |
| (7) ਧਾਤਾਂ ਦੀ ਸਾਪੇਖ ਘਣਤਾ ਵੱਧ ਹੁੰਦੀ ਹੈ ਪਰ Na ਅਤੇ K ਇਸਦੇ ਅਪਵਾਦ ਹਨ । | (7) ਅਧਾਤਾਂ ਦੀ ਸਾਪੇਖ ਘਣਤਾ ਆਮ ਤੌਰ ‘ਤੇ ਘੱਟ ਹੁੰਦੀ ਹੈ । |
| (8) ਧਾਤਾਂ ਅਪਾਰਦਰਸ਼ੀ ਹੁੰਦੀਆਂ ਹਨ । | (8) ਗੈਸੀ ਅਧਾਤਾਂ ਪਾਰਦਰਸ਼ੀ ਹੁੰਦੀਆਂ ਹਨ । |
| ਰਸਾਇਣਿਕ ਗੁਣਾਂ ਦੀ ਤੁਲਨਾ-
(1) ਧਾਤਾਂ ਖਾਰੇ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ ਜਿਨ੍ਹਾਂ ਤੋਂ ਕੁੱਝ ਖਾਰ ਬਣਦੇ ਹਨ । |
(1) ਅਧਾਤਾਂ, ਤੇਜ਼ਾਬੀ ਅਤੇ ਉਦਾਸੀਨ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ । |
| (2) ਧਾਤਾਂ ਤੇਜ਼ਾਬ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਹਾਈਡਰੋਜਨ ਗੈਸ ਵਿਸਥਾਪਿਤ ਕਰਦੀਆਂ ਹਨ ਅਤੇ ਉਸ ਅਨੁਸਾਰ ਲੂਣ ਬਣਾਉਂਦੀਆਂ ਹਨ । | (2) ਅਧਾਤਾਂ, ਤੇਜ਼ਾਬਾਂ ਵਿਚੋਂ ਹਾਈਡਰੋਜਨ ਗੈਸ ਨੂੰ ਵਿਸਥਾਪਿਤ ਨਹੀਂ ਕਰਦੀਆਂ । |
| (3) ਧਾਤਾਂ ਧਨਾਤਮਕ ਚਾਰਜ ਯੁਕਤ ਹੁੰਦੀਆਂ ਹਨ । | (3) ਅਧਾਤਾਂ ਰਿਣਾਤਮਕ ਚਾਰਜ ਯੁਕਤ ਹੁੰਦੀਆਂ ਹਨ । |
| (4) ਧਾਤਾਂ ਕਲੋਰੀਨ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਕਲੋਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ, ਜਿਹੜੇ ਬਿਜਲੀ ਸੰਯੋਜਕ ਹੁੰਦੇ ਹਨ । | (4) ਅਧਾਤਾਂ ਕਲੋਰੀਨ ਨਾਲ ਮਿਲ ਕੇ ਕਲੋਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ, ਜਿਹੜੇ ਸਹਿ-ਸੰਯੋਜਕ ਹੁੰਦੇ ਹਨ । |
| (5) ਕੁੱਝ ਧਾਤਾਂ ਹਾਈਡਰੋਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਹਾਈਡਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ, ਜਿਹੜੇ ਬਿਜਲੀ ਸੰਯੋਜਕ ਹੁੰਦੇ ਹਨ । | (5) ਅਧਾਤਾਂ ਹਾਈਡਰੋਜਨ ਨਾਲ ਕਈ ਤਰ੍ਹਾਂ ਦੇ ਸਥਾਈ ਹਾਈਡਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ, ਜਿਹੜੇ ਸਹਿ-ਸੰਯੋਜਕ ਹੁੰਦੇ ਹਨ । |
| (6) ਧਾਤਾਂ ਲਘੂਕਾਰਕ ਹਨ । | (6) ਅਧਾਤਾਂ ਆਕਸੀਕਾਰਕ ਹਨ । |
| (7) ਧਾਤਾਂ ਜਲੀ ਘੋਲ ਵਿੱਚ ਧਨ-ਆਇਨ ਬਣਾਉਂਦੀਆਂ ਹਨ । | (7) ਅਧਾਤਾਂ ਜਲੀ ਘੋਲ ਵਿੱਚ ਰਿਣ-ਆਇਨ ਬਣਾਉਂਦੀਆਂ ਹਨ । |
ਪ੍ਰਸ਼ਨ 5.
ਖੋਰਨ ਤੋਂ ਕੀ ਭਾਵ ਹੈ ? ਧਾਤਾਂ ਨੂੰ ਖੋਰਨ ਤੋਂ ਬਚਾਉਣ ਲਈ ਤੁਸੀਂ ਕੀ ਕਰੋਗੇ ? (ਮਾਂਡਲ ਪੇਪਰ)
ਉੱਤਰ-
ਖੋਰਨ (Corrosion) – ਕੱਚੀ ਧਾਤ ਤੋਂ ਪ੍ਰਾਪਤ ਕੀਤੀ ਧਾਤ ਕੁਦਰਤੀ ਰੂਪ ਵਿੱਚ ਸ਼ੁੱਧ ਅਤੇ ਸੁੰਦਰ ਹੁੰਦੀ ਹੈ । ਕੁਦਰਤ ਇਸ ਨੂੰ ਮੁੜ ਉਸੇ ਰੂਪ ਵਿੱਚ ਬਦਲਣ ਦੀ ਕੋਸ਼ਿਸ਼ ਕਰਦੀ ਹੈ ਜਿਸ ਵਿੱਚ ਇਸ ਨੂੰ ਕੁਦਰਤ ਵਿੱਚੋਂ ਪ੍ਰਾਪਤ ਕੀਤਾ ਹੁੰਦਾ ਹੈ। ਧਾਤਾਂ ਦੀ ਸਤਹਿ ਉੱਤੇ ਵਾਤਾਵਰਨ ਦੀਆਂ ਗੈਸਾਂ ਆਦਿ ਦੀ ਕਿਰਿਆ ਕਾਰਨ ਧਾਤਾਂ ਦੇ ਆਕਸਾਈਡ, ਸਲਫਾਈਡ, ਕਾਰਬੋਨੇਟ ਅਤੇ ਸਲਫ਼ੇਟ ਆਦਿ ਬਣਦੇ ਹਨ ਤੇ ਇਸ ਤਰ੍ਹਾਂ ਧਾਤ ਹੌਲੀ-ਹੌਲੀ ਖੁਰਦੀ ਰਹਿੰਦੀ ਹੈ | ਧਾਤਾਂ ਦੇ ਇਸ ਤਰ੍ਹਾਂ ਘੁਲਣ ਨੂੰ ਖੋਰਨ ਆਖਦੇ ਹਨ । ਆਇਰਨ ਅਤੇ ਸਟੀਲ ਦੇ ਖੋਰਨ ਨੂੰ ਜੰਗ ਜਾਂ ਜੰਗਾਲ ਲੱਗਣਾ ਵੀ ਆਖਦੇ ਹਨ । ਜੰਗ ਲੱਗਣਾ ਗੰਭੀਰ ਆਰਥਿਕ ਸਮੱਸਿਆ ਹੈ । ਜੰਗ ਲਾਲ ਭੂਰੇ ਰੰਗ ਦਾ ਪਾਊਡਰ ਹੁੰਦਾ ਹੈ ਜਿਸ ਨੂੰ ਜਲੀ ਆਇਰਨ ਆਕਸਾਈਡ (Fe2O3.4H2O) ਕਹਿੰਦੇ ਹਨ । ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣ ਲਈ ਪਾਣੀ ਅਤੇ ਆਕਸੀਜਨ ਦੀ ਲੋੜ ਹੁੰਦੀ ਹੈ । ਇਸ ਤੱਥ ਨੂੰ ਹੇਠ ਲਿਖੀ ਕਿਰਿਆ ਰਾਹੀਂ ਸਮਝਿਆ ਜਾ ਸਕਦਾ ਹੈ ।

ਧਾਤਾਂ ਨੂੰ ਖੋਰਨ ਤੋਂ ਬਚਾਉਣ ਦੇ ਉਪਾਅ-
- ਧਾਤ ਨੂੰ ਸਿੱਲ੍ਹ ਤੋਂ ਬਚਾਅ ਕੇ ਰੱਖਣਾ ਚਾਹੀਦਾ ਹੈ ।
- ਧਾਤ ਦੀ ਉੱਪਰਲੀ ਸਤਹਿ ‘ਤੇ ਪੇਂਟ ਕਰ ਦੇਣਾ ਚਾਹੀਦਾ ਹੈ ਤਾਂ ਜੋ ਇਸ ਦੀ ਸਤਹਿ ਦਾ ਆਕਸੀਜਨ ਅਤੇ ਸਿੱਲ੍ਹ ਨਾਲੋਂ ਸੰਪਰਕ ਟੁੱਟ ਜਾਵੇ ।
- ਧਾਤ ਦੀ ਸਤਹਿ ‘ਤੇ ਸ੍ਰੀਸ ਜਾਂ ਤੇਲ ਲਗਾਉਣਾ ਚਾਹੀਦਾ ਹੈ ।
- ਧਾਤ ਉੱਪਰ ਕਿਸੇ ਹੋਰ ਖੋਰਨ ਰੋਧੀ ਧਾਤ ਦੀ ਪਰਤ ਚੜ੍ਹਾ ਦੇਣੀ ਚਾਹੀਦੀ ਹੈ ।
- ਧਾਤ ਨੂੰ ਪਿਘਲੇ ਹੋਏ ਜ਼ਿੰਕ ਵਿੱਚ ਡੁਬੋ ਕੇ ਬਾਹਰ ਕੱਢ ਲੈਣਾ ਚਾਹੀਦਾ ਹੈ ਜਿਸ ਤੋਂ ਇਸ ਉੱਪਰ ਜ਼ਿੰਕ ਦੀ ਪਰਤ ਜੰਮ ਜਾਵੇ ਅਰਥਾਤ ਗੈਲਵਨੀਕਰਨ ਕਰ ਦੇਣਾ ਚਾਹੀਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 6.
ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣ ਦੀ ਕਿਰਿਆ ਦਾ ਵੇਰਵਾ ਦਿਓ ਅਤੇ ਇਸ ਤੋਂ ਬਚਾਅ ਦੇ ਕੋਈ ਦੋ ਢੰਗ ਦੱਸੋ ।
ਜਾਂ
ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣ (Rusting of Iron) ਤੋਂ ਬਚਾਉਣ ਦੇ ਕੋਈ ਪੰਜ ਢੰਗ ਸੰਖੇਪ ਵਿੱਚ ਵਰਣਨ ਕਰੋ ।
ਜਾਂ
ਜੰਗ ਲੱਗਣਾ ਕੀ ਹੈ ? ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣ ਤੋਂ ਰੋਕਣ ਦੇ ਉਪਾਅ ਦੱਸੋ ।
ਉੱਤਰ-
ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣਾ (Rusting of Iron) – ਇਹ ਉਹ ਕਿਰਿਆ ਹੈ ਜੋ ਹੇਠ ਲਿਖੇ ਢੰਗ ਨਾਲ ਹੁੰਦੀ ਹੈ
(ੳ) ਆਇਰਨ ਇਲੈਂਕਨ ਛੱਡ ਕੇ ਫੈਰਸ (Fe+2) ਆਇਨ ਬਣਾਉਂਦਾ ਹੈ ।

(ਅ) ਇਹ ਫੈਰਸ ਆਇਨ ਆਕਸੀਜਨ ਅਤੇ ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਫੈਰਿਕ ਆਕਸਾਈਡ ਦੀ ਭੂਰੀ ਪਰਤ ਬਣਾਉਂਦੇ ਹਨ । ਇਸਦੇ ਨਾਲ ਹੀ ਅੱਠ ਹਾਈਡਰੋਜਨ ਆਇਨ ਵੀ ਬਣਦੇ ਹਨ ।

(ੲ) ਫੈਰਿਕ ਆਕਸਾਈਡ Fe3O3 ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਜੰਗ ਬਣਾਉਂਦਾ ਹੈ ।

(ਸ) ਹਾਈਡਰੋਜਨ ਦੇ ਆਇਨ ਇਲੈਂਕਨ ਪ੍ਰਾਪਤ ਕਰਦੇ ਹਨ ਅਤੇ ਹਾਈਡਰੋਜਨ ਗੈਸ ਬਣਦੀ ਹੈ ।
8H+ + 8e– → 4H2
ਜੰਗ ਇਕ ਚਿਪਚਿਪਾਹਟ ਰਹਿਤ ਯੌਗਿਕ ਹੈ । ਇਹ ਪਰਤ ਤੋਂ ਬਾਅਦ ਪਰਤ ਬਣ ਕੇ ਉੱਡਦਾ ਰਹਿੰਦਾ ਹੈ ਤੇ ਲੋਹੇ ਦੀ ਨਵੀਂ ਸਤਹਿ ਨੂੰ ਜੰਗ ਲੱਗਣ ਲਈ ਖੁੱਲਾ ਛੱਡ ਦਿੱਤਾ ਜਾਂਦਾ ਹੈ ।
ਜੰਗ ਲੱਗਣ ਦੀ ਰੋਕਥਾਮ – ਕੁੱਝ ਬਚਾਓ ਕਾਰਜਾਂ ਨੂੰ ਅਪਣਾ ਕੇ ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣ ਤੋਂ ਬਚਾਇਆ ਜਾ ਸਕਦਾ ਹੈ , ਜਿਵੇਂ-
(ੳ) ਪੇਂਟ ਲਗਾ ਕੇ ਬਚਾਅ ਕਰਨਾ – ਲੋਹੇ ਦੀਆਂ ਵਸਤਾਂ ਨੂੰ ਪੇਂਟ ਕਰਕੇ ਜਾਂ ਗ੍ਰਸ ਲਗਾਉਣ ਨਾਲ ਪਾਣੀ ਅਤੇ ਆਕਸੀਜਨ ਦਾ ਲੋਹੇ ਨਾਲੋਂ ਸੰਪਰਕ ਟੁੱਟ ਜਾਂਦਾ ਹੈ ।
(ਅ) ਧਾਤਵੀ ਪਰਤ ਚੜ੍ਹਾਉਣਾ – ਉਹ ਧਾਤ ਜਿਹੜੀ ਲੋਹੇ ਨਾਲੋਂ ਵਧੇਰੇ ਆਸਾਨੀ ਨਾਲ ਇਲੈੱਕਨ ਛੱਡ ਸਕੇ, ਲੋਹੇ ਨੂੰ ਜੰਗਾਲ ਤੋਂ ਬਚਾਉਣ ਲਈ ਵਰਤੀ ਜਾ ਸਕਦੀ ਹੈ । ਜ਼ਿੰਕ ਧਾਤ ਲੋਹੇ ਤੋਂ ਵਧੇਰੇ ਆਸਾਨੀ ਨਾਲ ਇਲੈੱਕਵਾਂਨ ਛੱਡਦੀ ਹੈ । ਇਸ ਲਈ ਲੋਹੇ ਨੂੰ ਜੰਗ ਤੋਂ ਬਚਾਉਣ ਲਈ ਇਸ ਉੱਤੇ ਜ਼ਿੰਕ ਦੀ ਪਰਤ ਚੜਾਈ ਜਾਂਦੀ ਹੈ । ਇਸ ਲਈ ਇਸ ਵਿਧੀ ਨੂੰ ਜਿਸਤ ਚੜ੍ਹਾਉਣਾ ਜਾਂ ਗੈਲਵੇਨੀਕਰਨ (Galvanization) ਆਖਦੇ ਹਨ ।
(ੲ) ਬਿਜਲਈ ਬਚਾਅ – ਲੋਹੇ ਤੋਂ ਪ੍ਰਾਪਤ ਹੋਣ ਵਾਲੇ ਫੈਰਸ ਆਇਨਾਂ Fe+2 ਨੂੰ ਬਿਜਲਈ ਧਾਰਾ ਨਾਲ ਉਦਾਸੀਨ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਲੋਹੇ ਦੀ ਜਿਸ ਵਸਤੂ ਨੂੰ ਜੰਗ ਤੋਂ ਬਚਾਉਣਾ ਹੋਵੇ, ਉਸਨੂੰ ਕੈਥੋਡ ਨਾਲ ਜੋੜਿਆ ਜਾਂਦਾ ਹੈ ।
(ਸ) ਜੰਗ-ਰੋਧੀ ਘੋਲ ਵਰਤ ਕੇ – ਇਹ ਘੋਲ ਫ਼ਾਸਫੇਟ ਅਤੇ ਕਰੋਮੇਟ ਦੇ ਐਲਕਲੀ ਹੁੰਦੇ ਹਨ । ਐਲਕਲੀਪਨ ਕਾਰਨ ਹਾਈਡਰੋਜਨ ਆਇਨ (H+) ਬਣਦੇ ਹਨ ਤੇ ਇਹ ਆਇਨ ਵਸਤੂ ਦਾ ਆਕਸੀਕਰਨ ਨਹੀਂ ਹੋਣ ਦਿੰਦੇ । ਇਸ ਤਰ੍ਹਾਂ ਹਰ ਵਸਤੁ ਜੰਗ ਤੋਂ ਬਚੀ ਰਹਿੰਦੀ ਹੈ । ਇਹ ਘੋਲ ਕਾਰ ਰੇਡੀਏਟਰਾਂ ਵਿੱਚ ਅਤੇ ਇੰਜਣ ਦੇ ਪੁਰਜ਼ਿਆਂ ਨੂੰ ਜੰਗ ਤੋਂ ਬਚਾਉਣ ਲਈ ਵਰਤੇ ਜਾਂਦੇ ਹਨ ।
(ਹ) ਨਿਕਲ ਅਤੇ ਕ੍ਰੋਮੀਅਮ ਨਾਲ ਮਿਸ਼ਰਿਤ ਧਾਤ ਬਣਾ ਕੇ – ਜਦੋਂ ਲੋਹੇ ਨੂੰ ਨਿਕਲ ਅਤੇ ਸ਼੍ਰੋਮੀਅਮ ਨਾਲ ਮਿਲਾ ਕੇ ਮਿਸ਼ਰਿਤ ਧਾਤ ਬਣਾਈ ਜਾਂਦੀ ਹੈ ਤਾਂ (Fe = 74%, Cr = 18%, Ni = 8%) ਸਟੇਨਲੈਸ ਸਟੀਲ ਬਣ ਜਾਂਦੀ ਹੈ । ਸਟੇਨਲੈਸ ਸਟੀਲ ਜੰਗਰੋਧੀ ਹੁੰਦੀ ਹੈ । ਇਸ ਤਰ੍ਹਾਂ ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣ ਤੋਂ ਬਚਾਇਆ ਜਾ ਸਕਦਾ ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 7.
ਆਇਨੀ ਯੌਗਿਕਾਂ ਦੇ ਸਾਧਾਰਨ ਗੁਣਾਂ ਦਾ ਵਰਣਨ ਕਰੋ ।
ਉੱਤਰ-
ਆਇਨੀ ਯੌਗਿਕਾਂ ਦੇ ਗੁਣ – ਆਇਨੀ ਯੌਗਿਕਾਂ ਦੇ ਸਾਧਾਰਨ ਗੁਣ ਹੇਠ ਲਿਖੇ ਹਨ :
(1) ਭੌਤਿਕ ਪ੍ਰਕਿਰਤੀ – ਧਨਾਤਮਕ ਅਤੇ ਰਿਣਾਤਮਕ ਆਇਨਾਂ ਵਿਚਕਾਰ ਪ੍ਰਬਲ ਆਕਰਸ਼ਣ ਬਲ ਦੇ ਕਾਰਨ ਆਇਨੀ ਯੋਗਿਕ ਠੋਸ ਹੁੰਦੇ ਹਨ । ਇਹ ਯੌਗਿਕ ਆਮ ਤੌਰ ਤੇ ਭੁਰਭੁਰੇ ਹੁੰਦੇ ਹਨ ਅਤੇ ਦਬਾਓ ਪਾਉਣ ਨਾਲ ਟੁੱਟ ਜਾਂਦੇ ਹਨ ।
(2) ਪਿਘਲਣ ਅੰਕ ਅਤੇ ਉਬਾਲ ਅੰਕ – ਆਇਨੀ ਯੌਗਿਕਾਂ ਦਾ ਪਿਘਲਣ ਅੰਕ ਅਤੇ ਉਬਾਲ ਅੰਕ ਬਹੁਤ ਅਧਿਕ ਹੁੰਦਾ ਹੈ ਕਿਉਂਕਿ ਇਸਦੇ ਮਜ਼ਬੂਤ ਅੰਤਰ ਆਇਨੀ ਆਕਰਸ਼ਣ ਨੂੰ ਤੋੜਨ ਲਈ ਊਰਜਾ ਦੀ ਬਹੁਤ ਵੱਡੀ ਮਾਤਰਾ ਦੀ ਲੋੜ ਹੁੰਦੀ ਹੈ ।
(3) ਘੁਲਣਸ਼ੀਲਤਾ – ਸੰਯੋਜਕ ਯੋਗਿਕ ਆਮ ਤੌਰ ਤੇ ਪਾਣੀ ਵਿੱਚ ਘੁਲਣਸ਼ੀਲ ਹਨ, ਪਰੰਤੂ ਕੈਰੋਸੀਨ, ਪੈਟਰੋਲ ਆਦਿ ਜਿਹੇ ਘੋਲਕਾਂ ਵਿੱਚ ਅਣ-ਘੁਲ ਹੁੰਦੇ ਹਨ ।
(4) ਬਿਜਲਈ ਚਾਲਕਤਾ – ਕਿਸੇ ਘੋਲ ਵਿੱਚ ਬਿਜਲਈ ਧਾਰਾ ਦੇ ਪ੍ਰਵਾਹ ਲਈ ਚਾਰਜਿਤ ਕਣਾਂ ਦੀ ਗਤੀਸ਼ੀਲਤਾ ਦਾ ਹੋਣਾ ਜ਼ਰੂਰੀ ਹੁੰਦਾ ਹੈ । ਆਇਨੀ ਯੌਗਿਕਾਂ ਦੇ ਜਲੀ ਘੋਲ ਵਿੱਚ ਆਇਨ ਮੌਜੂਦ ਹੁੰਦੇ ਹਨ । ਜਦੋਂ ਘੋਲ ਵਿੱਚੋਂ ਬਿਜਲਈ ਧਾਰਾ ਗੁਜ਼ਾਰੀ ਜਾਂਦੀ ਹੈ ਤਾਂ ਆਇਨ ਉਲਟੇ ਇਲੈੱਕਟੋਡ ਵੱਲ ਗਤੀ ਕਰਨ ਲਗਦੇ ਹਨ | ਠੋਸ ਅਵਸਥਾ ਵਿੱਚ ਆਇਨੀ ਯੋਗਿਕ ਬਿਜਲੀ ਦਾ ਚਾਲਨ ਨਹੀਂ ਕਰਦੇ ਹਨ ਕਿਉਂਕਿ ਠੋਸ ਅਵਸਥਾ ਦੀ ਦ੍ਰਿੜ ਸੰਰਚਨਾ ਕਾਰਨ ਆਇਨਾਂ ਦੀ ਗਤੀ ਸੰਭਵ ਨਹੀਂ ਹੁੰਦੀ ਹੈ । ਪਰੰਤੂ ਆਇਨੀ ਯੌਗਿਕ ਤਰਲ ਅਵਸਥਾ ਵਿੱਚ ਬਿਜਲਈ ਚਾਲਨ ਕਰਦੇ ਹਨ ਕਿਉਂਕਿ ਵਿਤ ਅਵਸਥਾ ਵਿੱਚ ਵਿਪਰੀਤ ਆਇਨਾਂ ਵਿਚਕਾਰ ਬਿਜਲਈ ਸਥਿਤਿਕ ਆਕਰਸ਼ਣ ਬਲ ਉਸ਼ਮਾ ਹੋਣ ਕਾਰਨ ਕਮਜ਼ੋਰ ਹੋ ਜਾਂਦੀ ਹੈ । ਇਸ ਲਈ ਆਇਨ ਸੁਤੰਤਰ ਰੂਪ ਵਿੱਚ ਗਮਨ ਕਰਦੇ ਹਨ ਅਤੇ ਬਿਜਲੀ ਦਾ ਚਾਲਨ ਹੁੰਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 8.
ਮਿਸ਼ਰਤ ਧਾਤ ਕਿਸ ਨੂੰ ਆਖਦੇ ਹਨ ? ਇਨ੍ਹਾਂ ਨੂੰ ਬਣਾਉਣ ਦੇ ਕੀ ਉਦੇਸ਼ ਹਨ ?
ਉੱਤਰ-
ਮਿਸ਼ਰਤ ਧਾਤ (Alloy) – ਕਿਸੇ ਧਾਤ ਨੂੰ ਕਿਸੇ ਹੋਰ ਧਾਤ ਜਾਂ ਅਧਾਤ ਨਾਲ ਮਿਲਾ ਕੇ ਬਣਾਏ ਗਏ ਸਮ-ਅੰਗੀ ਮਿਸ਼ਰਨ ਨੂੰ ਮਿਸ਼ਰਤ ਧਾਤ ਆਖਦੇ ਹਨ । ਉਦਾਹਰਨ ਵਜੋਂ ਸਟੇਨਲੈਸ ਸਟੀਲ, ਟਾਂਕਾ, ਪਿੱਤਲ, ਕਾਂਸਾ, ਬੈਂ-ਮੈਟਲ ਆਦਿ ਸਾਰੀਆਂ ਮਿਸ਼ਰਤ ਧਾਤਾਂ ਹਨ ।
ਮਿਸ਼ਰਿਤ ਧਾਤਾਂ ਦੀ ਵਰਤੋਂ-
- ਕਠੋਰਤਾ ਵਧਾਉਣ ਲਈ – ਲੋਹੇ ਵਿੱਚ ਕਾਰਬਨ ਦੀ ਮਾਤਰਾ ਮਿਲਾ ਕੇ ਸਟੇਨਲੈਸ ਸਟੀਲ ਬਣਾਇਆ ਜਾਂਦਾ ਹੈ, ਜਿਹੜਾ ਲੋਹੇ ਤੋਂ ਵੱਧ ਕਠੋਰ ਹੁੰਦਾ ਹੈ ।
- ਸ਼ਕਤੀ ਵਧਾਉਣ ਲਈ – ਇਸਪਾਤ, ਡਿਊਰਐਲੁਮਿਨ ਆਦਿ ਮਿਸ਼ਰਿਤ ਧਾਤਾਂ ਕਠੋਰ ਹੋਣ ਕਾਰਨ ਸ਼ਕਤੀਸ਼ਾਲੀ ਵੀ ਹੁੰਦੀਆਂ ਹਨ ।
- ਖੁਰਨ ਤੋਂ ਬਚਾਉਣ ਲਈ – ਜਿਵੇਂ ਸਟੇਨਲੈਸ ਸਟੀਲ, ਲੋਹੇ ਅਤੇ ਜ਼ਿੰਕ ਤੋਂ ਬਣੀ ਮਿਸ਼ਰਿਤ ਧਾਤ ਨੂੰ ਜੰਗ ਨਹੀਂ ਲਗਦਾ
- ਧੁਨੀ ਉਤਪੰਨ ਕਰਨ ਲਈ – ਤਾਂਬੇ ਅਤੇ ਟਿੱਨ ਤੋਂ ਬਣਾਈ ਗਈ ਮਿਸ਼ਰਿਤ ਧਾਤ ਬਿੱਲ ਮੈਟਲ ਹੈ । ਇਸ ਤੋਂ ਧੁਨੀ ਉਤਪੰਨ ਕੀਤੀ ਜਾਂਦੀ ਹੈ ।
- ਪਿਘਲਾਓ ਦਰਜਾ ਘੱਟ ਕਰਨ ਲਈ – ਜਿਵੇਂ ਰੋਜ਼ ਮੈਟਲ ਇਕ ਮਿਸ਼ਰਿਤ ਧਾਤ ਹੈ । ਇਸਦਾ ਪਿਘਲਾਓ ਅੰਕ ਘੱਟ ਹੁੰਦਾ ਹੈ ।
- ਉੱਚਿਤ ਸਾਂਚੇ ਵਿੱਚ ਢਲਾਈ ਲਈ – ਕਾਂਸਾ ਅਤੇ ਟਾਈਪ ਮੈਟਲ ।
- ਰੰਗ ਬਦਲਣ ਲਈ – ਤਾਂਬੇ ਅਤੇ ਐਲੂਮੀਨੀਅਮ ਤੋਂ ਬਣੀ ਐਲੂਮੀਨੀਅਮ ਜ਼ ਮਿਸ਼ਰਿਤ ਧਾਤ ਦਾ ਰੰਗ ਸੁਨਹਿਰੀ ਹੁੰਦਾ ਹੈ ।
- ਘਰੇਲੂ ਲੋੜਾਂ ਲਈ – ਘਰਾਂ, ਕਾਰਖ਼ਾਨਿਆਂ, ਦਫ਼ਤਰਾਂ ਆਦਿ ਦੀਆਂ ਸਾਰੀਆਂ ਜਗਾ ‘ਤੇ ਮਿਸ਼ਰਿਤ ਧਾਤ ਦੀ ਵਰਤੋਂ ਕੀਤੀ ਜਾਂਦੀ ਹੈ, ਜਿਵੇਂ-ਘਰ ਵਿਚ ਅਲਮਾਰੀ, ਪੱਖੇ, ਫਰਿਜ, ਗਹਿਣੇ ਆਦਿ ।
ਪ੍ਰਸ਼ਨ 9.
ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਦੀ ਲੜੀ ਕੀ ਹੁੰਦੀ ਹੈ ?
ਉੱਤਰ-
ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਦੀ ਲੜੀ (Reactivity Series of Metals) – ਸਾਰੀਆਂ ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਵੱਖ-ਵੱਖ ਹੁੰਦੀ ਹੈ । ਧਾਤਾਂ ਦੀ ਘਟਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਅਨੁਸਾਰ ਪ੍ਰਾਪਤ ਕੀਤੀ ਗਈ ਤਰਤੀਬ ਨੂੰ ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਲੜੀ ਆਖਦੇ ਹਨ ।
ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਦੀ ਲੜੀ-
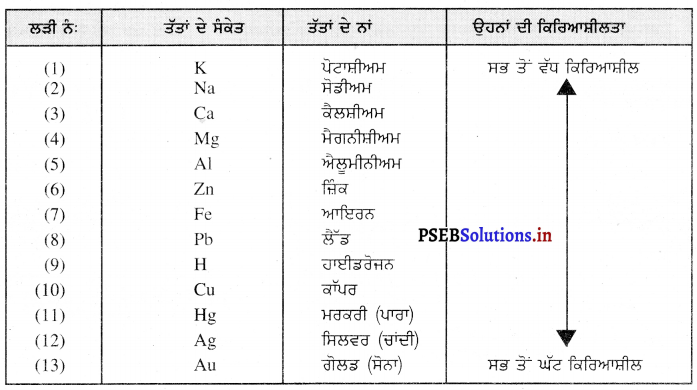
ਸਾਰੀਆਂ ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਵੱਖ-ਵੱਖ ਹੁੰਦੀ ਹੈ । ਕੁੱਝ ਧਾਤਾਂ ਜਿਵੇਂ ਸੋਡੀਅਮ, ਪੋਟਾਸ਼ੀਅਮ, ਕੈਲਸ਼ੀਅਮ ਆਦਿ ਜ਼ਿਆਦਾ ਕਿਰਿਆਸ਼ੀਲ ਹਨ । ਇਹ ਧਾਤਾਂ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਆਕਸਾਈਡ ਅਤੇ ਹਾਈਡਰੋਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਹਾਈਡਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ | ਕੁਝ ਧਾਤਾਂ ਜਿਵੇਂ ਲੋਹਾ, ਜ਼ਿੰਕ ਆਦਿ ਕਿਰਿਆਸ਼ੀਲ ਹਨ, ਪਰੰਤੂ ਕੁਝ ਧਾਤਾਂ ਜਿਵੇਂ ਸੋਨਾ, ਪਲਾਟੀਨਮ ਆਦਿ ਅਕਿਰਿਆਸ਼ੀਲ ਹਨ । ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਉਨ੍ਹਾਂ ਦੇ ਇਲੈੱਕਟ੍ਰਾਨਾਂ ਦੇਣ ਦੇ ਗੁਣ ’ਤੇ ਨਿਰਭਰ ਕਰਦੀ ਹੈ । ਜਿਹੜੀਆਂ ਧਾਤਾਂ ਕਿਰਿਆਸ਼ੀਲਤਾ ਲੜੀ ਵਿੱਚ ਹਾਈਡਰੋਜਨ ਤੋਂ ਉੱਪਰ ਸਥਿਤ ਹਨ ਵੱਧ ਕਿਰਿਆਸ਼ੀਲ ਹਨ । ਹਾਈਡਰੋਜਨ ਤੋਂ ਥੱਲੇ ਵਾਲੀਆਂ ਧਾਤਾਂ ਘੱਟ ਕਿਰਿਆਸ਼ੀਲ ਹਨ ।
ਪ੍ਰਸ਼ਨ 10.
ਧਾਤਾਂ ਦੇ ਤਿੰਨ ਭੌਤਿਕ ਅਤੇ ਦੋ ਰਸਾਇਣਿਕ ਗੁਣ ਲਿਖੋ ।
ਉੱਤਰ-
ਧਾਤਾਂ ਦੇ ਭੌਤਿਕ ਗੁਣ-
(i) ਧਾਤਵੀ ਲਿਸ਼ਕ (ਚਮਕ) – ਸ਼ੁੱਧ ਧਾਤਾਂ ਦੀ ਸਤਹ ਚਮਕਦਾਰ ਹੁੰਦੀ ਹੈ | ਧਾਤਾਂ ਦੇ ਇਸ ਗੁਣ ਨੂੰ ਧਾੜਵੀ ਚਮਕ (metallic lusture) ਕਹਿੰਦੇ ਹਨ, ਜਿਵੇਂ-ਸੋਨੇ ਵਿੱਚ ਪੀਲੇ ਰੰਗ ਦੀ ਚਮਕ, ਕਾਪਰ ਦੀ ਲਾਲ-ਭੂਰੇ ਰੰਗ ਦੀ ਚਮਕ ਅਤੇ ਐਲੂਮੀਨੀਅਮ ਦੀ ਚਿੱਟੇ ਰੰਗ ਦੀ ਚਮਕ ਹੁੰਦੀ ਹੈ ।
(ii) ਕਠੋਰਤਾ ਕਰੜਾਈ) – ਆਮ ਤੌਰ ਤੇ ਧਾਤਾਂ ਕਠੋਰ ਹੁੰਦੀਆਂ ਹਨ । ਵਿਭਿੰਨ ਧਾਤਾਂ ਦੀ ਕਠੋਰਤਾ ਭਿੰਨ-ਭਿੰਨ ਹੁੰਦੀ ਹੈ । ਪਰ (ਤਾਂਬਾ, ਆਇਰਨ (ਲੋਹਾ), ਐਲੂਮੀਨੀਅਮ ਬਹੁਤ ਕਠੋਰ ਧਾਤਾਂ ਹਨ ਜਦਕਿ ਸੋਡੀਅਮ, ਪੋਟਾਸ਼ੀਅਮ ਆਦਿ ਨਰਮ ਹਨ ।
(iii) ਕੁਟੀਯੋਗਤਾ – ਜਿਹੜੀਆਂ ਧਾਤਾਂ ਹਥੌੜੇ ਨਾਲ ਕੁੱਟ-ਕੁੱਟ ਕੇ ਪਤਲੀ ਚਾਦਰਾਂ ਵਿੱਚ ਪਰਿਵਰਤਿਤ ਕੀਤੀਆਂ ਜਾ ਸਕਦੀਆਂ ਹਨ ਉਨ੍ਹਾਂ ਨੂੰ ਕੁਟੀਣਯੋਗ ਧਾਤਾਂ ਕਹਿੰਦੇ ਹਨ । ਧਾਤਾਂ ਦੇ ਇਸ ਗੁਣ ਨੂੰ ਕੁਟੀਯੋਗਤਾ ਕਿਹਾ ਜਾਂਦਾ ਹੈ । ਸੋਨਾ ਅਤੇ ਚਾਂਦੀ ਸਭ ਤੋਂ ਵੱਧ ਕੁਟੀਣਯੋਗ ਧਾਤਾਂ ਹਨ ।
(iv) ਖਿੱਚੀਣਯੋਗਤਾ – ਉਹ ਧਾਤਾਂ ਜਿਨ੍ਹਾਂ ਦੀਆਂ ਖਿੱਚ ਕੇ ਪਤਲੀਆਂ ਤਾਰਾਂ ਬਣਾਈਆਂ ਜਾ ਸਕਦੀਆਂ ਹਨ, ਨੂੰ ਖਿੱਚੀਣਯੋਗ ਧਾਤਾਂ ਕਹਿੰਦੇ ਹਨ । ਧਾਤਾਂ ਦੇ ਇਸ ਗੁਣ ਨੂੰ ਖਿੱਚੀਯੋਗਤਾ ਕਿਹਾ ਜਾਂਦਾ ਹੈ । ਸੋਨਾ ਅਤੇ ਚਾਂਦੀ ਸਭ ਤੋਂ ਵੱਧ ਖਿੱਚੀਣਯੋਗ ਧਾਤਾਂ ਹਨ ।
(v) ਤਾਪੀ ਚਾਲਕਤਾ – ਧਾਤਾਂ ਸਾਧਾਰਨ ਤੌਰ ‘ਤੇ ਤਾਪ ਦੀਆਂ ਸੁਚਾਲਕ ਹੁੰਦੀਆਂ ਹਨ ।
ਹੋਰ ਕੁੱਝ ਧਾਤਾਂ ਤਾਪ ਦੀਆਂ ਕੁਚਾਲਕ ਹਨ-
ਉਦਾਹਰਨ-ਕਾਪਰ, ਐਲੂਮੀਨੀਅਮ ਆਦਿ ਤਾਪ ਦੀਆਂ ਸੁਚਾਲਕ ਹਨ ।
(vi) ਬਿਜਲੀ ਚਾਲਕਤਾ-ਧਾਤਾਂ ਬਿਜਲੀ ਦੀਆਂ ਵਧੀਆ ਚਾਲਕ ਹੁੰਦੀਆਂ ਹਨ, ਜਿਵੇਂ-ਸਿਲਵਰ, ਕਾਪਰ ਆਦਿ ਬਿਜਲੀ ਦੀਆਂ ਸੁਚਾਲਕ ਹਨ ।
ਧਾਤਾਂ ਦੇ ਰਸਾਇਣਿਕ ਗੁਣ – ਧਾਤਾਂ ਆਪਣੇ ਇਲੈੱਕਟਾਂ ਗੁਆ ਕੇ ਧਨਾਤਮਕ ਆਇਨ ਬਣਾਉਂਦੀਆਂ ਹਨ । ਇਸ ਲਈ ਇਹ ਬਿਜਲਈ ਧਨਾਤਮਕ ਤੱਤ ਹਨ ।
(1) ਧਾਤਾਂ ਦੀ ਆਕਸੀਜਨ ਨਾਲ ਕਿਰਿਆ – ਸਾਰੀਆਂ ਧਾਤਾਂ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਧਾੜਵੀ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ । ਇਨ੍ਹਾਂ ਆਕਸਾਈਡਾਂ ਦੀ ਪ੍ਰਕਿਰਤੀ ਖਾਰੀ ਹੁੰਦੀ ਹੈ, ਕਿਉਂਕਿ ਸਾਰੀਆਂ ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਭਿੰਨਭਿੰਨ ਹੁੰਦੀ ਹੈ, ਇਸ ਲਈ ਉਹ ਵੱਖ-ਵੱਖ ਤਾਪਮਾਨ ਤੇ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਦੀਆਂ ਹਨ ।
(i) ਸਾਧਾਰਨ ਤਾਪਮਾਨ ਤੇ Na, K ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਆਪਣੇ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ, ਜਿਹੜੇ ਕਿ ਪਾਣੀ ਵਿੱਚ ਘੁਲਣਸ਼ੀਲ ਹਨ ।
4Na(s) + O(g) → 2Na2O (s)
Na2 O(s) + H2O → 2NaOH (aq)
(ii) ਮੈਗਨੀਸ਼ੀਅਮ (Mg) ਦੇ ਰਿਬਨ ਨੂੰ ਬਾਲ ਕੇ ਜਦੋਂ ਹਵਾ ਵਿੱਚ ਰੱਖਿਆ ਜਾਂਦਾ ਹੈ, ਤਾਂ ਉਹ ਬਲਦਾ ਰਹਿੰਦਾ ਹੈ ਅਤੇ ਮੈਗਨੀਸ਼ੀਅਮ ਆਕਸਾਈਡ ਬਣਾਉਂਦਾ ਹੈ ।
![]()
(iii) ਤਾਂਬਾ (Cu) ਅਤੇ ਲੋਹਾ (Fe) ਖ਼ੁਸ਼ਕ ਹਵਾ ਵਿੱਚ ਉੱਚ ਤਾਪਮਾਨ ਤੇ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਦੇ ਹਨ ।

(2) ਧਾਤਾਂ ਦੀ ਹਲਕੇ ਤੇਜ਼ਾਬਾਂ ਨਾਲ ਕਿਰਿਆ – ਧਾਤਾਂ ਹਲਕੇ ਤੇਜ਼ਾਬਾਂ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਹਾਈਡਰੋਜਨ ਗੈਸ ਮੁਕਤ ਕਰਦੀਆਂ ਹਨ । ਵਿਭਿੰਨ ਧਾਤਾਂ ਦੀ ਕਿਰਿਆਸ਼ੀਲਤਾ ਦੀ ਦਰ ਭਿੰਨ-ਭਿੰਨ ਹੁੰਦੀ ਹੈ ।
(i) Na, K, Zn, Mg, Fe ਆਦਿ ਘਟਦੇ ਕ੍ਰਮ ਵਿੱਚ ਕਿਰਿਆਸ਼ੀਲ ਹਨ-
2Na + 2HCl → 2NaCl +H2↑
Mg + 2HCl → MgCl2 + H2↑
Zn + H2SO4 → Zn SO4 + H2↑
(ii) ਪਤਲੇ ਨਾਈਟ੍ਰਿਕ ਤੇਜ਼ਾਬ Cu, Ag, Pb, Hg ਧਾਤਾਂ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ NO (ਨਾਈਟਰੋਜਨ ਆਕਸਾਈਡ) ਬਣਾਉਂਦਾ ਹੈ ।
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO +4H2O
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
(iii) Mg ਅਤੇ Mn ਨਾਲ ਪਤਲਾ ਨਾਈਟ੍ਰਿਕ ਤੇਜ਼ਾਬ, ਹਾਈਡਰੋਜਨ ਗੈਸ ਮੁਕਤ ਕਰਦਾ ਹੈ ।
Mg + 2HNO3 → Mg(NO3)2 + H2↑
(iv) ਸੋਨਾ ਅਤੇ ਪਲਾਟੀਨਮ ਪਤਲੇ ਤੇਜ਼ਾਬ ਨਾਲ ਕਿਰਿਆ ਨਹੀਂ ਕਰਦੇ ।
(3) ਧਾਤਾਂ ਦੀ ਕਲੋਰੀਨ ਨਾਲ ਕਿਰਿਆ – ਧਾਤਾਂ, ਕਲੋਰੀਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਬਿਜਲੀ ਸੰਯੋਜਕ ਕਲੋਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ ।
Ca + Cl2 → CaCl2
(4) ਧਾਤਾਂ ਦੀ ਹਾਈਡਰੋਜਨ ਨਾਲ ਕਿਰਿਆ – ਕਿਰਿਆਸ਼ੀਲ ਧਾਤਾਂ Na, K ਅਤੇ Ca ਆਦਿ ਹਾਈਡਰੋਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਆਪਣੇ ਹਾਈਡਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ ।

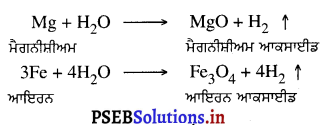
(5) ਧਾਤਾਂ ਦੀ ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ-
(i) ਜਦੋਂ ਪਾਣੀ ਸਾਧਾਰਨ ਤਾਪਮਾਨ ਤੇ ਹੋਵੇ ਤਾਂ Na, K, Ca ਆਦਿ ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਹਾਈਡਰੋਜਨ ਗੈਸ ਮੁਕਤ ਕਰਦੀਆਂ ਹਨ ।

(ii) ਜਦੋਂ ਪਾਣੀ ਉਬਲਦਾ ਹੋਵੇ ਤਾਂ Mg, Zn, Fe ਕਿਰਿਆ ਕਰਕੇ ਆਪਣੇ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ ।
![]()
ਛੋਟੇ ਉੱਤਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ (Short Answer Type Questions)
ਪ੍ਰਸ਼ਨ 1.
ਦੋ ਧਾਤਾਂ ਦੇ ਨਾਂ ਦੱਸੋ ਜਿਹੜੀਆਂ ਤਾਪ ਅਤੇ ਬਿਜਲੀ ਦੀਆਂ ਸੂਚਾਲਕ ਹੋਣ । ਤਾਪ ਦੀਆਂ ਸਭ ਤੋਂ ਵੱਧ ਅਤੇ ਸਭ ਤੋਂ ਘੱਟ ਚਾਲਕ ਧਾਤਾਂ ਦੇ ਨਾਂ ਲਿਖੋ ।
ਉੱਤਰ-
ਕਾਪਰ ਅਤੇ ਐਲੂਮੀਨੀਅਮ ਦੋਨੋਂ ਧਾਤਾਂ ਤਾਪ ਅਤੇ ਬਿਜਲੀ ਦੀਆਂ ਸੂਚਾਲਕ ਹਨ । ਚਾਂਦੀ ਤਾਪ ਦੀ ਸਭ ਤੋਂ ਉੱਤਮ ਚਾਲਕ ਹੈ ਜਦਕਿ ਲੈਂਡ ਸਾਰੀਆਂ ਧਾਤਾਂ ਵਿੱਚੋਂ ਤਾਪ ਦੀ ਘੱਟ ਚਾਲਕ ਹੈ ।
ਪ੍ਰਸ਼ਨ 2.
ਧਾਤਾਂ ਦੇ ਖਿੱਚੀਣਸ਼ੀਲਤਾ ਗੁਣ ਦੀ ਉਦਾਹਰਨ ਸਹਿਤ ਪਰਿਭਾਸ਼ਾ ਦਿਓ ।
ਉੱਤਰ-
ਖਿੱਚੀਣਸ਼ੀਲਤਾ-ਧਾਤ ਦੇ ਪਤਲੇ ਤਾਰ ਖਿੱਚਣ ਦੀ ਸਮਰੱਥਾ ਨੂੰ ਖਿੱਚੀਣਸ਼ੀਲਤਾ ਕਹਿੰਦੇ ਹਨ । ਸੋਨਾ ਸਭ ਤੋਂ ਵੱਧ ਖਿੱਚੀਣਸ਼ੀਲ ਧਾਤ ਹੈ । ਸਿਰਫ਼ 1 ਗ੍ਰਾਮ ਸੋਨੇ ਦੀ ਲਗਭਗ 2 km ਲੰਬੀ ਤਾਰ ਬਣਾਈ ਜਾ ਸਕਦੀ ਹੈ ।
ਪ੍ਰਸ਼ਨ 3.
ਧਾਤਾਂ ਦਾ ਕਿਹੜਾ ਗੁਣ ਉਨ੍ਹਾਂ ਨੂੰ ਲੱਛਣ ਵਾਲਾ ਰਸਾਇਣਿਕ ਗੁਣ ਪ੍ਰਦਾਨ ਕਰਦਾ ਹੈ ?
ਉੱਤਰ-
ਧਾਤਾਂ ਆਪਣੇ ਇਲੈਕਟ੍ਰਾਨ ਨੂੰ ਗੁਆ ਕੇ ਧਨਾਤਮਕ ਆਇਨ ਬਣਾਉਂਦੀਆਂ ਹਨ, ਇਸ ਲਈ ਇਹ ਬਿਜਲੀ ਧਨਾਤਮਕ ਤੱਤ ਹਨ ! ਧਾਤਾਂ ਦਾ ਇਹ ਆਇਨੀਕਰਨ ਗੁਣ ਉਨ੍ਹਾਂ ਨੂੰ ਰਸਾਇਣਿਕ ਗੁਣ ਪ੍ਰਦਾਨ ਕਰਦਾ ਹੈ । ਜਿਵੇਂ Mg ਧਾਤ ਨੂੰ ਇਲੈੱਕਟ੍ਰਾਨ ਗੁਆ ਕੇ Mg2+ ਬਣਾਉਂਦਾ ਹੈ ।
Mg → Mg2+ + 2e,
ਪ੍ਰਸ਼ਨ 4.
ਆਇਨੀ ਯੌਗਿਕ ਕਿਸ ਅਵਸਥਾ ਵਿਚ ਮਿਲਦੇ ਹਨ ? ਆਇਨੀ ਯੌਗਿਕਾਂ ਦੇ ਉਬਾਲ ਅੰਕ ਅਤੇ ਪਿਘਲਣ ਅੰਕ ਤੇ ਟਿੱਪਣੀ ਕਰੋ !
ਉੱਤਰ-
ਧਾਤ ਤੋਂ ਅਧਾਤ ਵੱਲ ਹੋਏ ਇਲੈੱਕਟਾਂਨ ਦੇ ਸਥਾਨਾਂ ਤੋਂ ਬਣੇ ਯੌਗਿਕਾਂ ਨੂੰ ਆਇਨੀ ਯੋਗਿਕ ਜਾਂ ਬਿਜਲਈ ਸੰਯੋਜਕ ਯੌਗਿਕ ਕਹਿੰਦੇ ਹਨ ।
ਉਦਾਹਰਨ – NaCl, CaCl2, CaO, MgCl2.
ਆਇਨੀ ਯੌਗਿਕਾਂ ਦਾ ਉਬਾਲ ਅੰਕ ਅਤੇ ਪਿਘਲਣ ਅੰਕ ਉੱਚੇ ਹੁੰਦੇ ਹਨ ਕਿਉਂਕਿ ਇਸਦੇ ਪ੍ਰਬਲ ਅੰਤਰ-ਆਇਨੀ ਆਕਰਸ਼ਣ ਬਲ ਨੂੰ ਸਮਾਪਤ ਕਰਨ ਲਈ ਉਰਜਾ ਦੀ ਬਹੁਤ ਵੱਧ ਮਾਤਰਾ ਦੀ ਲੋੜ ਹੁੰਦੀ ਹੈ ।
ਪ੍ਰਸ਼ਨ 5.
ਖਣਿਜ ਅਤੇ ਕੱਚੀ ਧਾਤ ਵਿੱਚ ਅੰਤਰ ਲਿਖੋ ।
ਉੱਤਰ-
ਖਣਿਜ ਅਤੇ ਕੱਚੀ ਧਾਤ ਵਿੱਚ ਅੰਤਰ-
| ਖਣਿਜ (Minerals) | ਕੱਚੀ ਧਾਤ (Ores) |
| (1) ਜਿਨ੍ਹਾਂ ਕਿਰਿਤਕ ਪਦਾਰਥਾਂ ਵਿੱਚ ਧਾਤਾਂ ਦੇ ਯੌਗਿਕ ਉਪਸਥਿਤ ਹੁੰਦੇ ਹਨ, ਖਣਿਜ ਕਹਾਉਂਦੇ ਹਨ । | (1) ਜਿਨ੍ਹਾਂ ਖਣਿਜਾਂ ਤੋਂ ਲਾਭਦਾਇਕ ਅਤੇ ਸੌਖ ਨਾਲ ਧਾਤਾਂ ਪ੍ਰਾਪਤ ਕੀਤੀਆਂ ਜਾ ਸਕਦੀਆਂ ਹਨ, ਉਨ੍ਹਾਂ ਨੂੰ ਕੱਚੀ ਧਾਤ ਕਹਿੰਦੇ ਹਨ । |
| (2) ਕਈ ਖਣਿਜਾਂ ਵਿੱਚ ਧਾਤ ਦੀ ਪ੍ਰਤੀਸ਼ਤ ਮਾਤਰਾ ਬਹੁਤ ਜ਼ਿਆਦਾ ਹੁੰਦੀ ਹੈ, ਜਦਕਿ ਹੋਰਾਂ ਵਿੱਚ ਧਾਤ ਦੀ ਪ੍ਰਤੀਸ਼ਤ ਮਾਤਰਾ ਬਹੁਤ ਘੱਟ ਹੁੰਦੀ ਹੈ । | (2) ਸਾਰੀਆਂ ਕੱਚੀਆਂ ਧਾਤਾਂ ਵਿੱਚ ਧਾਤ ਦੀ ਕਾਫ਼ੀ ਮਾਤਰਾ ਹੁੰਦੀ ਹੈ । |
| (3) ਕੁੱਝ ਖਣਿਜਾਂ ਵਿੱਚ ਅਸ਼ੁੱਧੀਆਂ ਦੀ ਬਹੁਤ ਵੱਧ ਮਾਤਰਾ ਹੁੰਦੀ ਹੈ, ਜੋ ਧਾਤ ਨਿਸ਼ਕਰਸ਼ਨ ਵਿਚ ਰੁਕਾਵਟ ਪਾਉਂਦੀ ਹੈ । | (3) ਕੱਚੀਆਂ ਧਾਤਾਂ ਵਿੱਚ ਕੋਈ ਵੀ ਰੁਕਾਵਟ ਪਾਉਣ ਵਾਲੀਆਂ ਅਸ਼ੁੱਧੀਆਂ ਨਹੀਂ ਹੁੰਦੀਆਂ ਹਨ । |
| (4) ਸਾਰੇ ਖਣਿਜਾਂ ਨੂੰ ਧਾਤ ਨਿਸ਼ਕਰਸ਼ਨ ਲਈ ਉਪਯੋਗ ਨਹੀਂ ਕੀਤਾ ਜਾ ਸਕਦਾ ਹੈ । ਸਾਰੇ ਖਣਿਜ ਕੱਚੀ ਧਾਤ ਨਹੀਂ ਹੁੰਦੇ ਹਨ । | (4) ਸਾਰੀਆਂ ਕੱਚੀਆਂ ਧਾਤਾਂ ਨੂੰ ਧਾਤ ਨਿਸ਼ਕਰਸ਼ਨ ਦੇ ਲਈ ਉਪਯੋਗ ਕੀਤਾ ਜਾ ਸਕਦਾ ਹੈ । |
![]()
ਪ੍ਰਸ਼ਨ 6.
ਵਿਭਿੰਨ ਧਾਤਾਂ ਦੀ ਪਾਣੀ ਨਾਲ ਪ੍ਰਤੀਕਿਰਿਆ ਵਰਣਨ ਕਰੋ ।
ਉੱਤਰ-
ਧਾਤਾਂ, ਪਾਣੀ ਨਾਲ ਪ੍ਰਤੀਕਿਰਿਆ ਕਰਕੇ ਧਾਤ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ । ਇਹ ਪਾਣੀ ਵਿੱਚ ਘੁਲ ਕੇ ਧਾਤ ਹਾਈਡਰੋਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ । ਪਰੰਤੁ ਸਾਰੀਆਂ ਧਾਤਾਂ, ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ ਨਹੀਂ ਕਰਦੀਆਂ ਹਨ । ਸੋਡੀਅਮ ਅਤੇ ਪੋਟਾਸ਼ੀਅਮ ਜਿਹੀਆਂ ਧਾਤਾਂ ਠੰਡੇ ਪਾਣੀ ਨਾਲ ਤੇਜ਼ੀ ਨਾਲ ਕਿਰਿਆ ਕਰਦੀਆਂ ਹਨ । ਸੋਡੀਅਮ ਅਤੇ ਪੋਟਾਸ਼ੀਅਮ ਦੀ । ਕਿਰਿਆ ਬਹੁਤ ਤੇਜ਼ ਅਤੇ ਤਾਪ-ਨਿਕਾਸੀ ਹੈ ਕਿ ਇਸ ਤੋਂ ਬਣੀ ਹਾਈਡਰੋਜਨ ਨੂੰ ਇੱਕ ਦਮ ਅੱਗ ਲੱਗ ਜਾਂਦੀ ਹੈ ।
2K (s) + 2H2O (l) → 2KOH (aq) + H2 (g) + ਤਾਪ ਊਰਜਾ
2Na (s) + 2H2O (l) → 2NaOH (aq) + H2 (g) + ਤਾਪ ਊਰਜਾ
ਪਾਣੀ ਨਾਲ ਕੈਲਸ਼ੀਅਮ ਦੀ ਪ੍ਰਤੀਕਿਰਿਆ ਧੀਮੀ ਹੁੰਦੀ ਹੈ ।
Ca (s) + 2H2 O (l) → Ca (OH)2 (aq) + H2 (g)
ਐਲੂਮੀਨੀਅਮ, ਜ਼ਿੰਕ ਅਤੇ ਆਇਰਨ ਧਾਤਾਂ ਨਾ ਤਾਂ ਠੰਡੇ ਅਤੇ ਨਾ ਹੀ ਗਰਮ ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ ਕਰਦੀਆਂ ਹਨ । ਪਰੰਤੂ ਭਾਫ਼ ਦੇ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਧਾਤ ਆਕਸਾਈਡ ਅਤੇ ਹਾਈਡਰੋਜਨ ਦਿੰਦੀਆਂ ਹਨ ।
2Al (S) + 3H2 O (g) → Al2O3 (s) + 3H2 (g).
3Fe (s) + 4H2O (g) → Fe3O4 (s) + 4H2(g)
ਲੈਂਡ, ਕਾਪਰ ਅਤੇ ਗੋਲਡ (ਸੋਨੇ) ਜਿਹੀਆਂ ਧਾਤਾਂ ਪਾਣੀ ਨਾਲ ਕਿਰਿਆ ਨਹੀਂ ਕਰਦੀਆਂ ਹਨ ।
ਪ੍ਰਸ਼ਨ 7.
ਅਧਾਤਾਂ ਦੀ ਹੇਠ ਲਿਖਿਆਂ ਨਾਲ ਰਿਕਿਆ ਲਿਖੋ ।
ਉੱਤਰ-
(a) ਆਕਸੀਜਨ
(b) ਤੇਜ਼ਾਬ
(c) ਕਲੋਰੀਨ
(d) ਹਾਈਡਰੋਜਨ ।
ਉੱਤਰ-
ਅਧਾਤਾਂ ਬਿਜਲੀ ਰਿਣਾਤਮਕ ਹੁੰਦੀਆਂ ਹਨ । ਇਹ ਇਲੈੱਕਟ੍ਰਾਂਨਾਂ ਨੂੰ ਆਸਾਨੀ ਨਾਲ ਪ੍ਰਾਪਤ ਕਰਕੇ ਰਿਣਾਤਮਕ ਰੂਪ ਨਾਲ ਚਾਰਜ ਯੁਕਤ ਆਇਨ ਬਣਾਉਂਦੀਆਂ ਹਨ ।
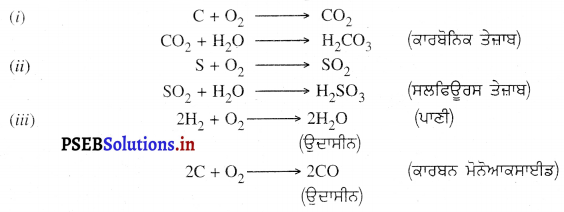
(a) ਅਧਾਤਾਂ ਦੀ ਆਕਸੀਜਨ ਨਾਲ ਕਿਰਿਆ – ਅਧਾਤਾਂ ਆਕਸੀਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਸਹਿ-ਸੰਯੋਜਕ ਆਕਸਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ, ਜੋ ਪਾਣੀ ਵਿਚ ਘੁਲ ਕੇ ਤੇਜ਼ਾਬ ਬਣਾਉਂਦੀਆਂ ਹਨ ।
(b) ਤੇਜ਼ਾਬਾਂ ਨਾਲ ਕਿਰਿਆ – ਅਧਾਤਾਂ, ਤੇਜ਼ਾਬਾਂ ਵਿਚੋਂ ਹਾਈਡਰੋਜਨ ਨੂੰ ਵਿਸਥਾਪਿਤ ਨਹੀਂ ਕਰਦੀਆਂ ਹਨ । ਇਸ ਕਿਰਿਆ ਦੇ ਪੂਰਾ ਹੋਣ ਲਈ ਤੇਜ਼ਾਬ ਦੇ H+ ਇਲੈੱਕਟ੍ਰਾਨ ਪ੍ਰਾਪਤ ਹੋਣੇ ਚਾਹੀਦੇ ਹਨ ਜੋ ਅਧਾਤਾਂ ਨਹੀਂ ਕਰਦੀਆਂ ਹਨ । ਇਸ ਲਈ ਅਧਾਤਾਂ ਦੀ ਤੇਜ਼ਾਬਾਂ ਨਾਲ ਕੋਈ ਕਿਰਿਆ ਨਹੀਂ ਹੁੰਦੀ ਅਤੇ ਹਾਈਡਰੋਜਨ ਨਹੀਂ ਮੁਕਤ ਹੁੰਦੀ ਹੈ ।
(c) ਕਲੋਰੀਨ ਨਾਲ ਕਿਰਿਆ – ਅਧਾਤਾਂ, ਕਲੋਰੀਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਸਹਿ-ਸੰਯੋਜਕ ਬੰਧਨ ਵਾਲੇ ਕਲੋਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ ।

(d) ਹਾਈਡਰੋਜਨ ਨਾਲ ਕਿਰਿਆ – ਅਧਾਤਾਂ ਹਾਈਡਰੋਜਨ ਨਾਲ ਸੰਯੋਗ ਕਰਕੇ ਆਪਣੇ ਹਾਈਡਰਾਈਡ ਬਣਾਉਂਦੀਆਂ ਹਨ ।
H2 + S → H2S (ਹਾਈਡਰੋਜਨ ਸਲਫਾਈਡ)
H2 + Cl2 → 2HCl (ਹਾਈਡਰੋਜਨ ਕਲੋਰਾਈਡ)
C + 2H2 → CH4 (ਮੀਥੇਨ)
ਇਹ ਹਾਈਡਰਾਈਡ ਇਲੈੱਕਨਾਂ ਦੀ ਸਾਂਝੇਦਾਰੀ ਹੋਣ ਕਾਰਨ ਸਹਿ-ਸੰਯੋਜਨ ਬੰਧਨ ਬਣਦੇ ਹਨ ।
ਪ੍ਰਸ਼ਨ 8.
ਕੁੰਨਣ ਕਿਰਿਆ ਕੀ ਹੈ ? ਇਸ ਦਾ ਉਪਯੋਗ ਕਦੋਂ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ? ਇਸ ਵਿੱਚ ਹੋਣ ਵਾਲੇ ਪਰਿਵਰਤਨਾਂ ਲਈ ਰਸਾਇਣਿਕ ਸਮੀਕਰਨਾਂ ਲਿਖੋ !
ਉੱਤਰ-
ਭੁੰਨਣ ਕਿਰਿਆ (Roasting) – ਸੰਘਣਾਪਨ ਤੋਂ ਬਾਅਦ ਕੱਚੀ ਧਾਤ ਨੂੰ ਹਵਾ ਦੀ ਉਪਸਥਿਤੀ ਵਿਚ ਗਰਮ ਕਰਨਾ ਭੁੰਨਣ ਤੀਕਿਰਿਆ ਕਹਾਉਂਦਾ ਹੈ | ਜ਼ਿੰਕ ਅਤੇ ਲੈਂਡ ਦੇ ਕਾਰਬੋਨੇਟਾਂ ਅਤੇ ਸਲਫਾਈਡਾਂ ਨੂੰ ਉਨ੍ਹਾਂ ਦੇ ਆਕਸਾਈਡਾਂ ਵਿੱਚ ਬਦਲਣ ਲਈ ਭੈਣਨ ਕਿਰਿਆ ਦਾ ਉਪਯੋਗ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
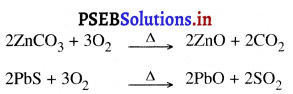
ਪ੍ਰਸ਼ਨ 9.
ਜੇਕਰ ਸਿਲਵਰ ਨਾਈਟਰੇਟ ਦੇ ਘੋਲ ਵਿੱਚ ਕਾਪਰ ਦੀ ਪੱਤੀ ਕੁੱਝ ਸਮੇਂ ਲਈ ਡੁਬੋ ਕੇ ਰੱਖਿਆ ਜਾਵੇ ਤਾਂ ਕੀ ਹੁੰਦਾ ਹੈ ? ਹੋ ਰਹੀ ਕਿਰਿਆ ਲਈ ਸਮੀਕਰਨ ਲਿਖੋ ।
ਉੱਤਰ-
ਕਾਪਰ, ਸਿਲਵਰ ਦੀ ਤੁਲਨਾ ਵਿੱਚ ਜ਼ਿਆਦਾ ਕਿਰਿਆਸ਼ੀਲ ਹੈ । ਜਦੋਂ ਕਾਪਰ ਦੀ ਪੱਤੀ ਨੂੰ ਕੁੱਝ ਸਮੇਂ ਲਈ ਸਿਲਵਰ ਨਾਈਟਰੇਟ ਦੇ ਘੋਲ ਵਿੱਚ ਡੁਬੋ ਕੇ ਰੱਖਿਆ ਜਾਂਦਾ ਹੈ ਤਾਂ ਸਿਲਵਰ ਜਮਾ ਹੋ ਜਾਂਦੀ ਹੈ ਅਤੇ ਘੋਲ ਦਾ ਰੰਗ ਨੀਲਾ ਹੋ ਜਾਂਦਾ ਹੈ ।

ਪ੍ਰਸ਼ਨ 10.
ਕਾਪਰ ਸਲਫੇਟ ਦੇ ਘੋਲ ਨੂੰ ਲੋਹੇ ਦੇ ਬਰਤਨ ਵਿੱਚ ਪਾ ਕੇ ਰੱਖਣ ਨਾਲ ਕੁੱਝ ਦਿਨਾਂ ਮਗਰੋਂ ਬਰਤਨ ਵਿੱਚ ਛੇਕ ਹੋ ਗਏ । ਇਸ ਕਿਰਿਆ ਨੂੰ ਲਿਖੋ । ਇਸ ਕਿਰਿਆ ਨੂੰ ਕਿਰਿਆਸ਼ੀਲਤਾ ਦੇ ਆਧਾਰ ‘ ਤੇ ਸਪੱਸ਼ਟ ਕਰੋ ।
ਉੱਤਰ-
ਕਿਰਿਆਸ਼ੀਲਤਾ ਲੜੀ ਵਿੱਚ ਕ੍ਰਮ ਅਨੁਸਾਰ ਲੋਹਾ ਪਹਿਲਾਂ ਆਉਂਦਾ ਹੈ ਅਰਥਾਤ ਲੋਹਾ, ਕਾਪਰ ਦੀ ਤੁਲਨਾ । ਵਿਚ ਜ਼ਿਆਦਾ ਕਿਰਿਆਸ਼ੀਲ ਹੈ । ਇਸ ਲਈ CusO4 ਦੇ ਘੋਲ ਤੋਂ ਲੋਹਾ, ਕਾਪਰ ਨੂੰ ਵਿਸਥਾਪਤ ਕਰ ਦਿੰਦਾ ਹੈ । ਜਿਸ ਕਾਰਨ ਲੋਹੇ ਦੇ ਬਰਤਨ ਵਿੱਚ ਛੇਕ ਹੋ ਜਾਂਦੇ ਹਨ ।
ਰਸਾਇਣਿਕ ਕਿਰਿਆ-
CuSO4 + Fe → FeSO4 + Cu
Cu2+ (aq) + Fe (s) → Fe+2(aq) + Cu (s)
![]()
ਪ੍ਰਸ਼ਨ 11.
ਕਾਪਰ ਨੂੰ ਹਵਾ ਵਿੱਚ ਖੁੱਲ੍ਹਾ ਛੱਡਣ ਨਾਲ ਉਸਦਾ ਰੰਗ ਹਰਾ ਹੋ ਜਾਂਦਾ ਹੈ । ਕਿਉਂ ?
ਉੱਤਰ-
ਕਾਪਰ, ਹਵਾ ਵਿੱਚ ਉਪਸਥਿਤ ਸਿੱਲੀ ਕਾਰਬਨ-ਡਾਈਆਕਸਾਈਡ ਦੇ ਨਾਲ ਕਿਰਿਆ ਕਰਦਾ ਹੈ ਜਿਸ ਕਰਕੇ ਇਸ ਦੀ ਭੂਰੇ ਰੰਗ ਦੀ ਲਿਸ਼ਕ ਹੌਲੀ-ਹੌਲੀ ਸਮਾਪਤ ਹੋ ਜਾਂਦੀ ਹੈ ਅਤੇ ਇਸ ਉੱਪਰ ਹਰੇ ਰੰਗ ਦੀ ਪਰਤ ਜੰਮ ਜਾਂਦੀ ਹੈ । ਇਹ ਹਰਾ ਪਦਾਰਥ ਬੇਸਿਕ ਕਾਪਰ ਕਾਰਬੋਨੇਟ ਹੈ ।

ਪ੍ਰਸ਼ਨ 12.
24 ਕੈਰਟ ਸੋਨਾ ਕੀ ਹੁੰਦਾ ਹੈ ?
ਉੱਤਰ-
24 ਕੈਰਟ ਮੋਨਾ – ਸ਼ੁੱਧ ਸੋਨੇ ਨੂੰ 24 ਕੈਰਟ ਸੋਨਾ ਕਹਿੰਦੇ ਹਨ । ਇਹ ਬਹੁਤ ਹੀ ਨਰਮ ਹੁੰਦਾ ਹੈ । ਇਸ ਨੂੰ ਸਖ਼ਤ (ਕਰਤਾ) ਬਣਾਉਣ ਲਈ ਇਸ ਵਿੱਚ ਚਾਂਦੀ ਜਾਂ ਕੱਪਰ ਮਿਸ਼ਰਤ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਸਾਡੇ ਦੇਸ਼ ਵਿੱਚ ਗਹਿਣੇ ਬਣਾਉਣ ਲਈ ਆਮ ਤੌਰ ਤੇ 22 ਕੈਰਟ ਸੋਨੇ ਦੀ ਵਰਤੋਂ ਹੁੰਦੀ ਹੈ । ਇਸਦਾ ਅਰਥ ਹੈ ਕਿ 22 ਭਾਗ ਸ਼ੁੱਧ ਸੋਨੇ ਵਿੱਚ 2 ਭਾਗ ਕਾਪਰ ਜਾਂ ਚਾਂਦੀ ਮਿਸ਼ਰਤ ਕੀਤੀ ਜਾਂਦੀ ਹੈ ।
ਪ੍ਰਸ਼ਨ 13.
ਸਲਫਾਈਡ ਦੀ ਕੱਚੀ-ਧਾਤ ਨੂੰ ਸੰਘਣਾ ਕਰਨ ਲਈ ਪ੍ਰਯੋਗ ਕੀਤੀ ਜਾਣ ਵਾਲੀ ਪ੍ਰਕਿਰਿਆ ਦਾ ਨਾਂ ਦੱਸੋ । ਸੰਘਣਿਤ ਸਲਫਾਈਡ ਕੱਚੀ ਧਾਤ ਨੂੰ ਧਾਤ ਵਿੱਚ ਬਦਲਣ ਲਈ ਪ੍ਰਯੋਗ ਕੀਤੀ ਗਈ ਵਿਧੀ ਦਾ ਦੋ ਚਰਣਾਂ ਵਿੱਚ ਸੰਖੇਪ ਨਾਲ ਵਰਣਨ ਕਰੋ ।
ਉੱਤਰ-
ਸਲਫਾਈਡ ਕੱਚੀ ਧਾਤ ਦੇ ਵੱਡੇ ਟੁੱਕੜਿਆਂ ਨੂੰ ਬਰੀਕ ਪੀਸ ਕੇ ਪਾਊਡਰ ਬਣਾ ਲਿਆ ਜਾਂਦਾ ਹੈ । ਹੁਣ ਇਸਨੂੰ ‘ਝੱਗ ਤਰਾਓ ਵਿਧੀ’ ਦੁਆਰਾ ਸੰਘਣਾ ਕਰ ਲਿਆ ਜਾਂਦਾ ਹੈ । ਸੰਘਣੀ ਕੀਤੀ ਹੋਈ ਸਲਫਾਈਡ ਕੱਚੀ ਧਾਤ ਨੂੰ ਧਾਤ ਵਿੱਚ ਬਦਲਣ ਲਈ ਹੇਠਾਂ ਦਿੱਤੇ ਗਏ ਦੋ ਚਰਣ ਹਨ-
(1) ਭੰਨਣਾ (Roasting) – ਸੰਘਣੀ ਕੱਚੀ ਧਾਤ ਨੂੰ ਹਵਾ ਦੀ ਉਪਸਥਿਤੀ ਵਿਚ ਗਰਮ ਕਰਕੇ ਆਕਸਾਈਡ ਵਿਚ ਬਦਲ ਲਿਆ ਜਾਂਦਾ ਹੈ । ਇਸ ਵਿਧੀ ਨੂੰ ਭੰਨਣ ਆਖਦੇ ਹਨ ।
![]()
(2) ਲਘੂਕਰਨ (Reduction) – ਕੱਚੀ-ਧਾਤ ਤੋਂ ਬਣਾਏ ਗਏ ਆਕਸਾਈਡ ਨੂੰ ਲਘੂਕਾਰਕ ਨਾਲ ਗਰਮ ਕਰਨ ਤੇ ਆਕਸੀਜਨ ਮੁਕਤ ਹੋਈ ਧਾਤੂ ਬਾਕੀ ਬੱਚ ਜਾਂਦੀ ਹੈ ।
ZnO + C → Zn + CO
ਪ੍ਰਸ਼ਨ 14.
ਕੋਈ ਕੱਚੀ ਧਾਤ ਗਰਮ ਕਰਨ ਨਾਲ ਸਲਫਰ ਡਾਈਆਕਸਾਈਡ (SO2) ਗੈਸ ਦਿੰਦੀ ਹੈ । ਇਸ ਕੱਚੀ-ਧਾਤ ਤੋਂ ਧਾਤ ਪ੍ਰਾਪਤ ਕਰਨ ਲਈ ਸ਼ਾਮਿਲ ਨਿਯਮ ਨੂੰ ਸੰਖੇਪ ਵਿੱਚ ਲਿਖੋ ।
ਉੱਤਰ-
ਕਾਪਰ ਦੀ ਕੱਚੀ-ਧਾਤ ਕਾਪਰ ਪਾਈਰਾਈਟ (CuS) ਨੂੰ ਗਰਮ ਕਰਨ ‘ਤੇ SO2 ਗੈਸ ਬਣਦੀ ਹੈ । ਇਸ ਕੱਚੀ ਧਾਤ ਤੋਂ ਧਾਤ ਪ੍ਰਾਪਤ ਕਰਨ ਲਈ ਹੇਠ ਦਿੱਤੇ ਗਏ ਚਰਨ ਹਨ-
(i) ਕੱਚੀ ਧਾਤ ਨੂੰ ਬਾਰੀਕ ਚਰਣ ਕਰਕੇ ਪਾਣੀ ਅਤੇ ਪਾਇਨ ਆਇਲ ਮਿਲਾ ਕੇ ਇਸ ਵਿਚੋਂ ਉੱਚ ਦਾਬ ਵਾਲੀ ਹਵਾ ਲੰਘਾਈ ਜਾਂਦੀ ਹੈ ਤਾਂ ਜੋ ਇਸ ਦੀਆਂ ਅਸ਼ੁੱਧੀਆਂ ਹੋ ਜਾਣ । ਇਸ ਤਰ੍ਹਾਂ ਕੱਚੀ-ਧਾਤ ਸੰਘਣੀ ਹੋ ਜਾਂਦੀ ਹੈ । ਇਸ ਵਿਧੀ ਨੂੰ ਝੱਗ ਤਰਾਓ ਵਿਧੀ ਆਖਦੇ ਹਨ ।
(ii) ਹੁਣ ਸੰਘਣਿਤ ਕੱਚੀ-ਧਾਤ ਨੂੰ ਹਵਾ ਦੀ ਹੋਂਦ ਵਿੱਚ ਭੰਨਣ ਦੁਆਰਾ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ, ਜਿਸ ਤੋਂ Cus ਦਾ ਕੁੱਝ ਭਾਗ Cu0 ਵਿੱਚ ਪਰਿਵਰਤਿਤ ਹੋ ਜਾਂਦਾ ਹੈ ।

ਕੁੱਝ ਸਮੇਂ ਬਾਅਦ ਹਵਾ ਦੀ ਸਪਲਾਈ ਬੰਦ ਕਰ ਦਿੱਤੀ ਜਾਂਦੀ ਹੈ ।

ਇਸ ਤਰ੍ਹਾਂ ਕਾਪਰ ਤਰਲ ਅਵਸਥਾ ਵਿੱਚ ਮਿਲਦਾ ਹੈ । ਹੁਣ ਇਸਨੂੰ ਬਿਜਲਈ ਸ਼ੁੱਧੀਕਰਨ ਵਿਧੀ ਦੁਆਰਾ ਸ਼ੁੱਧ ਕਰ ਲਿਆ ਜਾਂਦਾ ਹੈ ।
(iii) ਬਿਜਲਈ ਸ਼ੁੱਧੀਕਰਨ – ਇਸ ਪ੍ਰਕਿਰਿਆ ਵਿੱਚ ਅਸ਼ੁੱਧ ਕਾਪਰ ਦੀ ਛੜ ਨੂੰ ਐਨੋਡ ਅਤੇ ਸ਼ੁੱਧ ਕਾਪਰ ਪਲੇਟ ਨੂੰ ਕੈਥੋਡ ਬਣਾ ਕੇ ਤੇਜ਼ਾਬ ਦੀ ਉਪਸਥਿਤੀ ਵਿੱਚ ਕਾਪਰ ਸਲਫੇਟ ਦੇ ਘੋਲ ਵਿਚੋਂ ਬਿਜਲਈ ਧਾਰਾ ਲੰਘਾਈ ਜਾਂਦੀ ਹੈ ।

ਪ੍ਰਸ਼ਨ 15.
ਧਰਮਿਟ (Thermite) ਕਿਰਿਆ ਤੋਂ ਕੀ ਭਾਵ ਹੈ ? ਲਿਖੋ ।
ਉੱਤਰ-
ਥਰਮਿਟ (Thermite) – ਕੁੱਝ ਵਿਸਥਾਪਨ ਕਿਰਿਆਵਾਂ ਬਹੁਤ ਤਾਪ ਨਿਕਾਸੀ ਹਨ । ਇਨ੍ਹਾਂ ਵਿੱਚ ਉਤਸਰਜਿਤ ਹੋਈ ਤਾਪ ਉਰਜਾ ਇੰਨੀ ਜ਼ਿਆਦਾ ਹੁੰਦੀ ਹੈ ਕਿ ਧਾਤਾਂ ਤਰਲ ਅਵਸਥਾ ਵਿਚ ਪ੍ਰਾਪਤ ਹੁੰਦੀਆਂ ਹਨ । ਜਦੋਂ ਆਇਰਨ (III) ਆਕਸਾਈਡ (Fe203) ਦੇ ਨਾਲ ਐਲੂਮੀਨੀਅਮ ਦੀ ਕਿਰਿਆ ਕੀਤੀ ਜਾਂਦੀ ਹੈ ਤਾਂ ਬਹੁਤ ਜ਼ਿਆਦਾ ਤਾਪ ਉਤਸਰਜਿਤ ਹੁੰਦਾ ਹੈ ।
Fe2O3(s) + 2Al (s) → 2Fe(l) + Al2O3 (s) + ਤਾਪ ਊਰਜਾ
ਇਸ ਕਿਰਿਆ ਨੂੰ ਥਰਮਿਟ ਕਿਰਿਆ ਕਹਿੰਦੇ ਹਨ । ਇਸਦਾ ਉਪਯੋਗ ਰੇਲ ਦੀਆਂ ਪਟੜੀਆਂ ਅਤੇ ਮਸ਼ੀਨੀ ਪੁਰਜ਼ਿਆਂ ਦੀਆਂ ਦਰਾੜਾਂ ਨੂੰ ਜੋੜਨ ਲਈ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 16.
ਅਧਾਤਾਂ ਦੇ ਪੰਜ ਪ੍ਰਮੁੱਖ ਉਪਯੋਗ ਲਿਖੋ ।
ਉੱਤਰ-
ਅਧਾਤਾਂ ਦੇ ਉਪਯੋਗ-
- ਹਾਈਡਰੋਜਨ ਨੂੰ ਬਨਸਪਤੀ ਤੇਲਾਂ ਤੋਂ ਬਨਸਪਤੀ-ਘਿਓ ਬਣਾਉਣ ਲਈ ਪ੍ਰਯੋਗ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
- ਕਾਰਬਨ ਪ੍ਰਮੁੱਖ ਅਧਾਤ ਹੈ ਜਿਹੜੀ ਸਾਨੂੰ ਵਿਟਾਮਿਨ, ਪ੍ਰੋਟੀਨ ਅਤੇ ਕਾਰਬੋਹਾਈਡੇਟ ਪ੍ਰਦਾਨ ਕਰਦੀ ਹੈ । ਗ੍ਰੇਫਾਈਟ ਵਿਭਿੰਨ ਪ੍ਰਕਾਰ ਦੇ ਸੈੱਲਾਂ ਵਿੱਚ ਇਲੈੱਕਟ੍ਰਡ ਵਜੋਂ ਪ੍ਰਯੋਗ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
- ਨਾਈਟਰੋਜਨ ਦਾ ਉਪਯੋਗ ਅਮੋਨੀਆ, ਨਾਈਟ੍ਰਿਕ ਐਸਿਡ ਅਤੇ ਰਸਾਇਣਿਕ ਖਾਦ ਬਣਾਉਣ ਲਈ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਹਵਾ ਵਿੱਚ ਇਸ ਦੀ ਉਪਸਥਿਤੀ ਦਹਿਨ ਦੀ ਦਰ ਨੂੰ ਕੰਟਰੋਲ ਕਰਦੀ ਹੈ ।
- ਆਕਸੀਜਨ ਸਾਡੇ ਜੀਵਨ ਦਾ ਆਧਾਰ ਹੈ । ਦਹਿਨ ਕਿਰਿਆ ਇਸ ਦੀ ਉਪਸਥਿਤੀ ਦੇ ਕਾਰਨ ਹੀ ਸੰਭਵ ਹੁੰਦੀ ਹੈ ।
- ਸਲਫਰ (ਗੰਧਕ) ਕਈ ਪ੍ਰਕਾਰ ਦੀਆਂ ਦਵਾਈਆਂ ਅਤੇ ਬਾਰੂਦ ਬਣਾਉਣ ਵਿਚ ਕੰਮ ਆਉਂਦੀ ਹੈ ।
ਪ੍ਰਸ਼ਨ 17.
ਭੰਨਣ ਅਤੇ ਭਸਮੀਕਰਣ ਵਿੱਚ ਅੰਤਰ ਲਿਖੋ ।
ਉੱਤਰ-
ਭੰਨਣ ਅਤੇ ਭਸਮੀਕਰਣ ਵਿੱਚ ਅੰਤਰ-
| ਭੁੰਨਣ (Roasting) | ਭਸਮੀਕਰਨ (Calcination) |
| (1) ਭੰਨਣ ਪ੍ਰਕਿਰਿਆ ਦਾ ਉਪਯੋਗ ਸਲਫਾਈਡ ਕੱਚੀਆਂ ਧਾਤਾਂ ਨੂੰ ਆਕਸਾਈਡ ਵਿੱਚ ਪਰਿਵਰਤਿਤ ਕਰਨ ਲਈ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । | (1) ਭਸਮੀਕਰਨ ਪ੍ਰਕਿਰਿਆ ਦਾ ਉਪਯੋਗ ਕਾਰਬੋਨੇਟ ਅਤੇ ਹਾਈਟਿਡ ਕੱਚੀਆਂ ਧਾਤਾਂ ਦੇ ਲਈ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । |
| (2) ਭੰਨਣ ਪ੍ਰਕਿਰਿਆ ਵਿਚ ਕੱਚੀ-ਧਾਤ ਨੂੰ ਆਕਸੀਜਨ ਦੀ ਹੋਂਦ ਵਿਚ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । | (2) ਭਸਮੀਕਰਨ ਪ੍ਰਕਿਰਿਆ ਵਿੱਚ ਕੱਚੀ-ਧਾਤ ਨੂੰ ਹਵਾ ਦੀ ਅਣਹੋਂਦ ਵਿੱਚ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । |
| (3) ਇਸ ਵਿੱਚ SO2 ਗੈਸ ਉਤਪੰਨ ਹੁੰਦੀ ਹੈ । | (3) ਇਸ ਵਿੱਚ CO2 ਗੈਸ ਉਤਪੰਨ ਹੁੰਦੀ ਹੈ । |
| (4) ਉਦਾਹਰਨ – ਸੰਘਣਤ ਜ਼ਿੰਕ ਦੀ ਕੱਚੀ ਧਾਤ ਜ਼ਿੰਕ ਬਲੈਂਡੀ ਨੂੰ ਹਵਾ ਦੀ ਹੋਂਦ ਵਿਚ ਗਰਮ ਕਰਕੇ ਜ਼ਿੰਕ ਆਕਸਾਈਡ ਵਿਚ ਬਦਲਿਆ ਜਾਂਦਾ ਹੈ । | (4) ਉਦਾਹਰਨ – ਜ਼ਿੰਕ ਕਾਰਬੋਨੇਟ ਕੱਚੀ ਧਾਤ ਨੂੰ ਹਵਾ ਦੀ ਅਣਹੋਂਦ ਵਿਚ ਗਰਮ ਕਰਕੇ ਜ਼ਿੰਕ ਆਕਸਾਈਡ ਵਿਚ ਬਦਲਿਆ ਜਾਂਦਾ ਹੈ । |
ਪ੍ਰਸ਼ਨ 18.
ਆਇਨੀ ਯੌਗਿਕ ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ, ਸੋਡੀਅਮ ਅਤੇ ਕਲੋਰੀਨ ਤੋਂ ਮਿਲ ਕੇ ਕਿਵੇਂ ਬਣਦਾ ਹੈ ?
ਉੱਤਰ-
ਸੋਡੀਅਮ ਅਤੇ ਕਲੋਰਾਈਡ ਆਇਨ ਉਲਟ (ਵਿਪਰੀਤ) ਚਾਰਜਿਤ ਹੋਣ ਕਾਰਨ ਪਰਸਪਰ ਇੱਕ-ਦੂਜੇ ਵੱਲ ਖਿੱਚੇ ਜਾਂਦੇ ਹਨ ਅਤੇ ਮਜ਼ਬੂਤ ਸਥਿਰ ਬਿਜਲਈ ਬਲ ਨਾਲ ਬੰਨ੍ਹੇ ਜਾਣ ਕਾਰਨ ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ ਦੇ ਰੂਪ ਵਿੱਚ ਉਪਸਥਿਤ ਰਹਿੰਦੇ ਹਨ । ਸੋਡੀਅਮ ਕਲੋਰਾਈਡ ਅਣੂ ਦੇ ਰੂਪ ਵਿੱਚ ਨਹੀਂ ਮਿਲਦਾ, ਪਰੰਤੂ ਵਿਪਰੀਤ ਆਇਨਾਂ ਦੇ ਸਮੂਹ ਵਜੋਂ ਹੁੰਦਾ ਹੈ ।

ਪ੍ਰਸ਼ਨ 19.
ਬਿਜਲਈ ਵਿਘਟਨੀ ਸ਼ੁੱਧੀਕਰਨ ਤੋਂ ਤੁਸੀਂ ਕੀ ਸਮਝਦੇ ਹੋ ?
ਉੱਤਰ-
ਬਿਜਲਈ ਵਿਘਟਨੀ ਸ਼ੁੱਧੀਕਰਨ – ਕਾਪਰ, ਜ਼ਿੰਕ, ਟਿੱਨ, ਨਿੱਕਲ, ਚਾਂਦੀ ਅਤੇ ਸੋਨਾ ਆਦਿ ਅਜਿਹੀਆਂ ਕਈ ਧਾਤਾਂ ਦਾ ਸ਼ੁੱਧੀਕਰਨ ਬਿਜਲਈ ਵਿਘਟਨੀ ਵਿਧੀ ਦੁਆਰਾ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਇਸ ਪ੍ਰਕਿਰਿਆ ਵਿੱਚ ਸ਼ੁੱਧ ਧਾਤ ਦਾ ਐਨੋਡ ਅਤੇ ਅਸ਼ੁੱਧ ਧਾਤ ਦੀ ਪਤਲੀ ਪੱਤੀ ਨੂੰ ਕੈਥੋਡ ਬਣਾਇਆ ਜਾਂਦਾ ਹੈ ।
ਧਾਤ ਦੇ ਲੁਣ ਦਾ ਘੋਲ ਬਿਜਲਈ ਵਿਘਟਨ ਵਜੋਂ ਹੁੰਦਾ ਹੈ । ਜਦੋਂ ਬਿਜਲਈ ਵਿਘਟਨ (ਇਲੈੱਕਟੋਲਾਈਟ) ਵਿਚੋਂ ਬਿਜਲਈ ਧਾਰਾ ਪ੍ਰਵਾਹਿਤ ਕੀਤੀ ਜਾਂਦੀ ਹੈ ਤਾਂ ਐਨੋਡ ਤੋਂ ਅਸ਼ੁੱਧ ਧਾਤ ਘੋਲ ਵਿੱਚ ਘੁਲ ਜਾਂਦਾ ਹੈ ਅਤੇ ਇੰਨੀ ਹੀ ਸ਼ੁੱਧ ਧਾਤ ਦੀ ਮਾਤਰਾ ਘੋਲ ਵਿਚੋਂ ਕੈਥੋਡ ਤੇ ਜਮਾ ਹੋ ਜਾਂਦੀ ਹੈ । ਘੁਲਣਸ਼ੀਲ ਅਸ਼ੁੱਧੀਆਂ ਘੋਲ ਵਿੱਚ ਚਲੀਆਂ ਜਾਂਦੀਆਂ ਹਨ ਅਤੇ ਅਣ-ਘੁਲ ਅਸ਼ੁੱਧੀਆਂ ਐਨੋਡ ਦੇ ਹੇਠਾਂ ਗਾਰ ਵਜੋਂ ਇਕੱਠੀਆਂ ਹੋ ਜਾਂਦੀਆਂ ਹਨ ।
ਪ੍ਰਸ਼ਨ 20.
ਲਘੂਕਰਨ ਕਿਰਿਆ ਤੋਂ ਕੀ ਭਾਵ ਹੈ ? ਇਸ ਕਿਰਿਆ ਦੌਰਾਨ ਕਿਹੜੀਆਂ-ਕਿਹੜੀਆਂ ਵਿਧੀਆਂ ਅਪਣਾਈਆਂ ਜਾਂਦੀਆਂ ਹਨ ?
ਉੱਤਰ-
ਲਘੂਕਰਨ (Reduction) – ਧਾਤਾਂ ਦੇ ਯੌਗਿਕਾਂ ਤੋਂ ਧਾਤਾਂ ਪ੍ਰਾਪਤ ਕਰਨ ਵਾਲੀ ਕਿਰਿਆ ਨੂੰ ਲਘੂਕਰਨ ਆਖਦੇ ਹਨ | ਧਾਤਾਂ ਦੇ ਕਿਰਿਆਸ਼ੀਲਤਾ ਮ ਅਨੁਸਾਰ ਭਿੰਨ-ਭਿੰਨ ਧਾਤਾਂ ਦੇ ਲਈ ਹੇਠ ਲਿਖੇ ਅਨੁਸਾਰ ਵਿਧੀ ਵਰਤੀ ਜਾਂਦੀ ਹੈ-
(1) ਕਿਰਿਆਸ਼ੀਲਤਾ ਲੜੀ ਵਿੱਚ ਹੇਠਾਂ ਆਉਣ ਵਾਲੀਆਂ ਧਾਤਾਂ ਨੂੰ ਸਿਰਫ਼ ਹਵਾ ਦੀ ਹੋਂਦ ਵਿੱਚ ਗਰਮ ਕਰਨ ਤੇ ਹੀ ਧਾਤ ਪ੍ਰਾਪਤ ਹੋ ਜਾਂਦੀ ਹੈ, ਜਿਵੇਂ-ਪਾਰੇ ਦੀ ਕੱਚੀ ਧਾਤ ਸਿਨੇਬਾਰ ਨੂੰ ਹਵਾ ਵਿੱਚ ਗਰਮ ਕਰਨ ਨਾਲ ਅਰਥਾਤ ਭੁੰਨਣ ਤੇ ਪਾਰਾ ਮੁਕਤ ਰੂਪ ਵਿੱਚ ਪ੍ਰਾਪਤ ਹੋ ਜਾਂਦਾ ਹੈ ।

(2) ਕਿਰਿਆਸ਼ੀਲਤਾ ਲੜੀ ਦੇ ਵਿਚਕਾਰ ਆਉਣ ਵਾਲੀਆਂ ਧਾਤਾਂ ਦੇ ਯੌਗਿਕਾਂ ਦਾ ਮੁੱਖ ਤੌਰ ‘ਤੇ ਕੋਕ ਨਾਲ ਗਰਮ ਕਰਕੇ ਲਘੂਕਰਨ ਕੀਤਾ ਜਾਂਦਾ ਹੈ, ਜਿਵੇਂ-ਲੋਹਾ, ਜ਼ਿੰਕ, ਨਿੱਕਲ, ਟਿੱਨ, ਧਾਤਾਂ ਆਦਿ ।
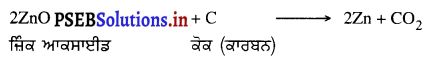
(3) ਕੁਝ ਧਾਤਾਂ ਦਾ ਲਘੂਕਰਨ ਜ਼ਿਆਦਾ ਕਿਰਿਆਸ਼ੀਲ ਧਾਤ ਨਾਲ ਕੀਤਾ ਜਾਂਦਾ ਹੈ । ਅਤਿ-ਕਿਰਿਆਸ਼ੀਲ ਧਾਤਾਂ ਜਿਵੇਂ K, Na, Ca ਆਦਿ ਲਈ ਵੀ ਲਘੂਕਰਨ ਵਿਧੀ ਵਰਤੋਂ ਵਿੱਚ ਲਿਆਈ ਜਾਂਦੀ ਹੈ, ਜਿਵੇਂ-ਮੈਂਗਨੀਜ਼ ਆਕਸਾਈਡ ਦਾ ਐਲੂਮੀਨੀਅਮ ਦੁਆਰਾ ਲਘੂਕਰਨ ਕਰਕੇ ਮੈਂਗਨੀਜ਼ ਪ੍ਰਾਪਤ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
3MnO2 + 4Al → 3Mn + 2Al2O3
![]()
ਪ੍ਰਸ਼ਨ 21.
ਸੋਡੀਅਮ ਹਾਈਡਰੋਕਸਾਈਡ ਦੇ ਭੰਡਾਰਨ ਲਈ ਐਲੂਮੀਨੀਅਮ ਦੇ ਬਰਤਨ ਕਿਉਂ ਵਰਤੇ ਨਹੀਂ ਜਾਂਦੇ ਹਨ ?
ਉੱਤਰ-
ਸੋਡੀਅਮ ਹਾਈਡਰੋਕਸਾਈਡ ਦੇ ਭੰਡਾਰਨ ਲਈ ਐਲੂਮੀਨੀਅਮ ਦੇ ਬਰਤਨ ਇਸ ਲਈ ਉਪਯੋਗ ਨਹੀਂ ਕੀਤੇ ਜਾਂਦੇ ਕਿਉਂਕਿ ਐਲੂਮੀਨੀਅਮ, ਸੋਡੀਅਮ ਹਾਈਡਰੋਕਸਾਈਡ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ ਘੁਲਣਸ਼ੀਲ ਲੂਣ ਬਣਾਉਂਦਾ ਹੈ ।
2Al + 2NaOH +2H2O → 2NaAlO2 + 3H2
ਪ੍ਰਸ਼ਨ 22.
ਐਲੂਮੀਨੀਅਮ ਦੇ ਉਪਯੋਗ ਦੱਸੋ ।
ਉੱਤਰ-
ਐਲੂਮੀਨੀਅਮ ਦੇ ਉਪਯੋਗ-
- ਐਲੂਮੀਨੀਅਮ ਹਲਕੀ ਧਾਤ ਹੋਣ ਕਾਰਨ ਹਵਾਈ ਜਹਾਜ਼ਾਂ ਦੀ ਬਾਡੀ ਅਤੇ ਮੋਟਰ ਇੰਜਣ ਬਣਾਉਣ ਦੇ ਕੰਮ ਆਉਂਦੀ ਹੈ ।
- ਇਹ ਬਰਤਨ, ਫੋਟੋਫੇਮ ਅਤੇ ਘਰੇਲੂ ਵਰਤੋਂ ਦੀਆਂ ਹੋਰ ਵਸਤਾਂ ਬਣਾਉਣ ਦੇ ਕੰਮ ਆਉਂਦੀ ਹੈ ।
- ਇਹ ਬਿਜਲੀ ਦੀ ਸੁਚਾਲਕ ਹੈ, ਇਸ ਲਈ ਅੱਜ-ਕਲ੍ਹ ਬਿਜਲੀ ਦੇ ਸੰਚਾਰ ਲਈ ਵਰਤੀਆਂ ਜਾਣ ਵਾਲੀਆਂ ਬਿਜਲੀ ਦੀਆਂ ਤਾਰਾਂ ਬਣਾਉਣ ਦੇ ਕੰਮ ਆਉਂਦੀ ਹੈ ।
- ਐਲੂਮੀਨੀਅਮ ਦੀਆਂ ਪੱਤੀਆਂ, ਖਾਣ ਦਾ ਸਾਮਾਨ, ਦਵਾਈਆਂ ਅਤੇ ਦੁੱਧ ਦੀਆਂ ਬੋਤਲਾਂ ਆਦਿ ਨੂੰ ਪੈਕ ਕਰਨ ਲਈ ਵਰਤੀਆਂ ਜਾਂਦੀਆਂ ਹਨ ।
- ਐਲੂਮੀਨੀਅਮ ਪਾਊਡਰ ਸਿਲਵਰ ਪੇਂਟ ਬਣਾਉਣ ਦੇ ਕੰਮ ਆਉਂਦਾ ਹੈ ।
- ਐਲੂਮੀਨੀਅਮ ਪਾਉਡਰ ਐਲੁਮੀਨੋ-ਥਰੈਮੀ ਵਿੱਚ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ । ਇਹ ਕਿਰਿਆ ਲੋਹੇ ਦੀਆਂ ਪਟੜੀਆਂ ਅਤੇ ਮਸ਼ੀਨਾਂ ਦੇ ਟੁੱਟੇ ਭਾਗ ਜੋੜਨ ਦੇ ਕੰਮ ਆਉਂਦੀ ਹੈ ।
ਪ੍ਰਸ਼ਨ 23.
ਕੀ ਹੁੰਦਾ ਹੈ, ਜਦੋਂ-
(i) ਲੋਹੇ ਦੇ ਆਕਸਾਈਡ ਨੂੰ ਕੋਕ ਨਾਲ ਮਿਲਾ ਕੇ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ।
(ii) ਮੈਗਨੀਸ਼ੀਅਮ ਨੂੰ ਪਤਲੇ ਲੂਣ ਦੇ ਤੇਜ਼ਾਬ ਨਾਲ ਮਿਲਾਇਆ ਜਾਂਦਾ ਹੈ ।
(iii) ਨੀਲੇ ਥੋਥੇ ਦੇ ਘੋਲ ਵਿੱਚ ਜ਼ਿੰਕ ਪਾਇਆ ਜਾਂਦਾ ਹੈ । (ਮਾਂਡਲ ਪੇਪਰ)
ਉੱਤਰ-
(i) ਲੋਹੇ ਦੇ ਆਕਸਾਈਡ ਨੂੰ ਕੋਕ ਨਾਲ ਮਿਲਾ ਕੇ ਜਦੋਂ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ਤਾਂ ਲੋਹੇ ਦਾ ਆਕਸਾਈਡ ਲਘੁਕ੍ਰਿਤ ਹੋ ਕੇ ਲੋਹੇ ਦੀ ਧਾਤ ਵਿੱਚ ਬਦਲ ਜਾਂਦਾ ਹੈ ।
C + O2 → CO2
CO2 + C → 2CO
Fe2O3 + 3CO → 2Fe + 3CO2
(ii) ਜਦੋਂ ਮੈਗਨੀਸ਼ੀਅਮ ਨੂੰ ਹਲਕੇ ਲੂਣ ਦੇ ਤੇਜ਼ਾਬ (ਹਾਈਡਰੋਕਲੋਰਿਕ ਤੇਜ਼ਾਬ) ਵਿੱਚ ਮਿਲਾਇਆ ਜਾਂਦਾ ਹੈ, ਤਾਂ ਹਾਈਡਰੋਜਨ ਗੈਸ ਉਤਪੰਨ ਹੁੰਦੀ ਹੈ ।

(iii) ਜਦੋਂ ਨੀਲੇ ਥੋਥੇ (CuSO4) ਦੇ ਘੋਲ ਵਿੱਚ ਜ਼ਿੰਕ ਨੂੰ ਡੁਬੋਇਆ ਜਾਂਦਾ ਹੈ, ਤਾਂ ਜ਼ਿੰਕ ਧਾਤ, ਕਾਪਰ ਸਲਫੇਟ ਦੇ ਘੋਲ ਵਿਚੋਂ ਕੱਪਰ ਨੂੰ ਵਿਸਥਾਪਤ ਕਰ ਦਿੰਦੀ ਹੈ ਜਿਸ ਕਰਕੇ ਨੀਲੇ ਥੋਥੇ (CuSO4) ਦਾ ਨੀਲਾ ਰੰਗ ਖ਼ਤਮ ਹੋ ਜਾਂਦਾ ਹੈ ।

ਪ੍ਰਸ਼ਨ 24.
ਇੱਕ ਕਿਰਿਆ-ਕਲਾਪ ਰਾਹੀਂ ਇਹ ਦੱਸੋ ਕਿ ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣ ਲਈ ਪਾਣੀ ਅਤੇ ਆਕਸੀਜਨ ਦੀ ਲੋੜ ਹੁੰਦੀ ਹੈ ?
ਜਾਂ
ਪ੍ਰਯੋਗ ਰਾਹੀਂ ਸਿੱਧ ਕਰੋ ਕਿ ਲੋਹੇ ਨੂੰ ਜੰਗ ਲੱਗਣ ਲਈ ਹਵਾ/ਆਕਸੀਜਨ ਅਤੇ ਨਮੀ ਦਾ ਹੋਣਾ ਜ਼ਰੂਰੀ ਹੈ ? ਚਿੱਤਰ ਵੀ ਬਣਾਓ ।
ਉੱਤਰ-
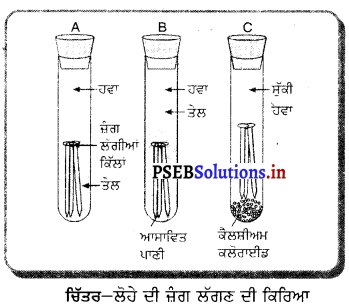
ਕਿਰਿਆ-ਕਲਾਪ – ਤਿੰਨ ਪਰਖਨਲੀਆਂ A, B ਅਤੇ C ਲਵੋ । A ਨਲੀ ਵਿੱਚ ਕੁੱਝ ਲੋਹੇ ਦੀਆਂ ਕਿੱਲਾਂ ਪਾਓ ਅਤੇ ਉਸ ਨੂੰ ਪਾਣੀ ਨਾਲ ਭਰੋ । C ਪਰਖਨਲੀ ਵਿੱਚ ਕਿੱਲਾਂ ਪਾ ਕੇ ਉਸ ਵਿੱਚ ਕੈਲਸ਼ੀਅਮ ਕਲੋਰਾਈਡ ਪਾਓ । ਕੈਲਸ਼ੀਅਮ ਕਲੋਰਾਈਡ ਪਾਣੀ ਸੋਖਣ ਵਾਲਾ ਪਦਾਰਥ ਹੈ । B ਨਲੀ ਵਿਚ ਕੁੱਝ ਕਿੱਲਾਂ ਰੱਖੋ । ਇਸ ਵਿੱਚ ਪਾਣੀ ਅਤੇ ਇਕ-ਦੋ ਬੂੰਦਾਂ ਤੇਲ ਦੀਆਂ ਪਾਓ । ਕੁੱਝ ਦਿਨਾਂ ਬਾਅਦ ਅਸੀਂ ਦੇਖਦੇ ਹਾਂ ਕਿ A ਨਲੀ ਵਿਚ ਪਈਆਂ ਕਿੱਲਾਂ ਨੂੰ ਜੰਗ ਲੱਗ ਗਿਆ ਹੈ ਕਿਉਂਕਿ ਇਨ੍ਹਾਂ ਨੂੰ ਸਿਲ੍ਹ ਅਤੇ ਆਕਸੀਜਨ ਦੋਵੇਂ ਮਿਲ ਗਏ । B ਨਲੀ ਵਿੱਚ ਕਿੱਲਾਂ ਨੂੰ ਆਕਸੀਜਨ ਅਤੇ C ਵਾਲੇ ਨੂੰ ਸਿਲ ਪ੍ਰਾਪਤ ਨਹੀਂ ਹੋਈ ।
ਪ੍ਰਸ਼ਨ 25.
ਮਿਸ਼ਰਤ ਧਾਤਾਂ ਕੀ ਹੁੰਦੀਆਂ ਹਨ ? ਇਹ ਕਿਉਂ ਬਣਾਈਆਂ ਜਾਂਦੀਆਂ ਹਨ ?
ਉੱਤਰ-
ਮਿਸ਼ਰਤ-ਧਾਤਾਂ (Alloys) – ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਧਾਤਾਂ ਜਾਂ ਇੱਕ ਧਾਤ ਅਤੇ ਇੱਕ ਅਧਾਤ ਦੇ ਸੰਯੋਗ ਤੋਂ ਪ੍ਰਾਪਤ ਸਮਅੰਗੀ ਮਿਸ਼ਰਨ ਨੂੰ ਮਿਸ਼ਰਤ-ਧਾਤ ਆਖਦੇ ਹਨ । ਮਿਸ਼ਰਤ ਧਾਤ ਦੇ ਗੁਣ ਮੂਲ ਧਾਤਾਂ ਤੋਂ ਭਿੰਨ ਹੁੰਦੇ ਹਨ | ਸ਼ੁੱਧ ਧਾਤ ਦੀ ਤੁਲਨਾ ਵਿੱਚ ਮਿਸ਼ਰਤ-ਧਾਤਾਂ ਦੀ ਬਿਜਲੀ ਚਾਲਕਤਾ ਘੱਟ ਹੁੰਦੀ ਹੈ ।
ਮਿਸ਼ਰਤ ਧਾਤਾਂ ਬਣਾਉਣ ਦਾ ਉਦੇਸ਼ – ਦੇਖੋ ਵੱਡੇ ਉੱਤਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ” ਸਿਰਲੇਖ ਅਧੀਨ ਪ੍ਰਸ਼ਨ 8 ਸਫ਼ਾ 72.
![]()
ਪ੍ਰਸ਼ਨ 26.
ਮੁੱਖ ਮਿਸ਼ਰਤ ਧਾੜਾਂ ਦੇ ਨਾਂ, ਉਨ੍ਹਾਂ ਦੇ ਅੰਸ਼ ਅਤੇ ਉਪਯੋਗ ਲਿਖੋ ।
ਉੱਤਰ-
ਮੁੱਖ ਮਿਸ਼ਰਤ ਧਾਤਾਂ, ਉਨ੍ਹਾਂ ਦੇ ਅੰਸ਼ ਅਤੇ ਉਪਯੋਗ-
| ਮਿਸ਼ਰਤ ਧਾਤ | ਅੰਸ਼ | ਉਪਯੋਗ |
| (1) ਸਟੀਲ | ਲੋਹਾ, ਕਾਰਬਨ | ਜਹਾਜ਼ਾਂ, ਬਿਲਡਿੰਗਾਂ ਅਤੇ ਆਵਾਜਾਈ ਦੇ ਸਾਧਨਾਂ ਦੇ ਨਿਰਮਾਣ ਵਿੱਚ । |
| (2) ਸਟੇਨਲੈਸ ਸਟੀਲ | ਲੋਹਾ, ਕੋਮੀਅਮ, ਨਿਕਲ, ਕਾਰਬਨ | ਬਰਤਨ, ਮਸ਼ੀਨਾਂ ਦੇ ਪੁਰਜ਼ੇ, ਚਾਕੂ, ਬਲੇਡ ਅਤੇ ਦੁੱਧ ਉਦਯੋਗਾਂ ਲਈ ਉਪਕਰਨ । |
| (3) ਪਿੱਤਲ | ਤਾਂਬਾ, ਜ਼ਿੰਕ | ਬਰਤਨ, ਮੂਰਤੀਆਂ, ਜਹਾਜ਼, ਤਗਮੇ (ਮੈਂਡਲ), ਭਾਫ਼ ਵਾਲੀ ਗੱਡੀਆਂ ਦੇ ਪੁਰਜ਼ੇ । |
| (4) ਟਾਂਕਾ (ਸੋਲਡਰ) | ਲੈਂਡ, ਟਿੱਨ. | ਜੋੜਾਂ ਵਿੱਚ ਟਾਂਕਾ ਲਗਾਉਣ ਲਈ । |
| (5) ਜਰਮਨ ਸਿਲਵਰ | ਤਾਂਬਾ, ਨਿੱਕਲ, ਜ਼ਿੰਕ | ਬਰਤਨ ਅਤੇ ਹੋਰ ਉਪਕਰਨ । |
| (6) ਬੈੱਲ ਮੈਟਲ | ਕਾਪਰ, ਟਿੱਨ | ਘੰਟੀਆਂ ਆਦਿ ਲਈ । |
| (7) ਡਿਊਰਐਲੂਮਿਨ | ਐਲੂਮੀਨੀਅਮ, ਕਾਪਰ, ਮੈਗਨੀਸ਼ੀਅਮ | ਹਵਾਈ ਜਹਾਜ਼ ਦੇ ਪੰਖ, ਹਵਾਈ ਜਹਾਜ਼ ਦੀ ਰਸੋਈ ਦੇ ਬਰਤਨ । |
ਪ੍ਰਸ਼ਨ 27.
ਹੇਠ ਲਿਖੀਆਂ ਮਿਸ਼ਰਤ ਧਾਤਾਂ ਦੀ ਰਚਨਾ ਅਤੇ ਉਪਯੋਗ ਲਿਖੋ । .
(i) ਪਿੱਤਲ
(ii) ਐਲਨਿਕੋ
(iii) ਡਿਊਰਾਲਊਮਿਨ
(iv) ਜਰਮਨ ਸਿਲਵਰ
(v) ਗੰਨ-ਮੈਟਲ ।
ਉੱਤਰ-
(i) ਪਿੱਤਲ (Brass) – ਇਸ ਵਿੱਚ 701 ਕੱਪਰ (Cu) ਅਤੇ 30% ਜ਼ਿੰਕ (Zn) ਹੁੰਦਾ ਹੈ । ਪਿੱਤਲ ਦੇ ਬਰਤਨ ਬਣਾਏ ਜਾਂਦੇ ਹਨ ।
(ii) ਐਲਨਿਕੋ (Alnico) – ਇਸ ਵਿੱਚ 63% ਆਇਰਨ (Fe), 20 ਨਿੱਕਲ (Ni), 12% ਐਲੂਮੀਨੀਅਮ (Al) ਅਤੇ 5% ਕੋਬਾਲਟ (Co) ਹੁੰਦਾ ਹੈ । ਇਸ ਨੂੰ ਸਥਾਈ ਚੁੰਬਕ ਬਣਾਉਣ ਲਈ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ ।
(iii) ਡਿਊਰਾਲਊਮਿਨ – ਇਸ ਵਿੱਚ 4% ਤਾਂਬਾ (Cu), 95.5% ਐਲੂਮੀਨੀਅਮ (Al) ਅਤੇ 5% ਮੈਂਗਨੀਜ਼ (Mn) ਹੁੰਦਾ ਹੈ । ਇਸ ਨੂੰ ਹਵਾਈ ਜਹਾਜ਼ਾਂ ਦੇ ਪੁਰਜ਼ੇ ਬਣਾਉਣ ਲਈ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ ।
(iv) ਜਰਮਨ ਸਿਲਵਰ – ਇਸ ਵਿੱਚ 55-65% ਕਾਪਰ (C), 13-27% ਜ਼ਿੰਕ (Zn) ਅਤੇ 10-30% ਨਿਕਲ (Ni) ਹੁੰਦਾ ਹੈ । ਇਸ ਨੂੰ ਛੁਰੀਆਂ ਕਾਂਟੇ, ਖਾਣੇ ਵਾਲੇ ਬਰਤਨ ਅਤੇ ਪ੍ਰਤੀਰੋਧੀ ਤਾਰਾਂ ਬਣਾਉਣ ਲਈ ਵਰਤਿਆ ਜਾਂਦਾ ਹੈ ।
(v) ਗੰਨ-ਮੈਟਲ – ਇਹ 88% ਕਾਪਰ (Cu), 10% ਟਿਨ (Sn), 2% ਜ਼ਿੰਕ (Zn) ਤੋਂ ਬਣਦੀ ਹੈ । ਇਸ ਦੀ ਵਰਤੋਂ ਬੰਦੂਕਾਂ ਬਣਾਉਣ, ਗੀਅਰਾਂ ਦੇ ਬੇਅਰਿੰਗ ਆਦਿ ਬਣਾਉਣ ਲਈ ਕੀਤੀ ਜਾਂਦੀ ਹੈ ।
ਬਹੁਤ ਛੋਟੇ ਉੱਤਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ (Very Short Answer Type Question)
ਪ੍ਰਸ਼ਨ 1.
ਕਿਸੇ ਇੱਕ ਧਾਤ ਦੀ ਉਦਾਹਰਨ ਦਿਓ ਜਿਹੜੀ ਕਮਰੇ ਦੇ ਤਾਪਮਾਨ ‘ਤੇ ਤਰਲ ਹੁੰਦੀ ਹੈ ।
ਉੱਤਰ-
ਪਾਰਾ (ਮਰਕਰੀ) ।
ਪ੍ਰਸ਼ਨ 2.
ਇੱਕ ਅਧਾਤ ਦਾ ਨਾਂ ਲਿਖੋ ਜਿਹੜੀ ਸਾਧਾਰਨ ਤਾਪਮਾਨ ਤੇ ਤਰਲ ਅਵਸਥਾ ਵਿਚ ਮਿਲਦੀ ਹੈ ?
ਉੱਤਰ-
ਅਧਾਤ : ਬੋਮੀਨ ।
ਪ੍ਰਸ਼ਨ 3.
ਹੇਠ ਲਿਖਿਆਂ ਵਿਚੋਂ ਕਿਹੜੀ ਧਾਤ ਸਰੀਰ ਤੇ ਤਾਪ (37) ਤੇ ਪਿਘਲ ਜਾਂਦੀ ਹੈ ?
ਗੋਲੀਅਮ, ਮੈਗਨੀਸ਼ੀਅਮ, ਸੀਜ਼ੀਅਮ, ਐਲੂਮੀਨੀਅਮ ।
ਉੱਤਰ-
ਗੈਲੀਅਮ ਅਤੇ ਸੀਜ਼ੀਅਮ ।
ਪ੍ਰਸ਼ਨ 4.
ਇੱਕ ਅਜਿਹੀ ਅਧਾਤ ਦਾ ਨਾਂ ਦੱਸੋ ਜਿਹੜੀ ਬਿਜਲੀ ਦੀ ਸੁਚਾਲਕ ਹੈ ।
ਉੱਤਰ-
ਫਾਈਟ (ਕਾਰਬਨ ਦਾ ਭਿੰਨ ਰੂਪ) ।
ਪ੍ਰਸ਼ਨ 5.
ਇਕ ਅਧਾਤ X ਦੋ ਵਿਭਿੰਨ ਰੂਪਾਂ Y ਅਤੇ 2 ਵਿਚ ਉਪਲੱਬਧ ਹਨ ।Y ਸਭ ਤੋਂ ਕਰੜੀ (ਸਖ਼ਤ) ਹੈ ਜਦਕਿ 1 ਬਿਜਲੀ ਦੀ ਸੁਚਾਲਕ ਹੈ ।Y ਅਤੇ 1 ਦੀ ਪਛਾਣ ਦੱਸੋ ।
ਉੱਤਰ-
Y – ਹੀਰਾ (ਡਾਇਮੰਡ)
Z – ਫ਼ਾਈਟ ।
ਹੀਰਾ ਅਤੇ ਸ਼੍ਰੋਫ਼ਾਈਟ ਦੋਨੋਂ ਕਾਰਬਨ ਦੇ ਭਿੰਨ ਰੂਪ ਹਨ ਇਸ ਲਈ X ਕਾਰਬਨ ਹੈ ।
![]()
ਪ੍ਰਸ਼ਨ 6.
ਇਕ ਤੱਤ X ਆਕਸੀਜਨ ਨਾਲ ਕਿਰਿਆ ਕਰਕੇ X2O ਬਣਾਉਂਦਾ ਹੈ । ਇਹ ਆਕਸਾਈਡ ਪਾਣੀ ਵਿੱਚ ਘੁਲਣਸ਼ੀਲ ਹੈ ਅਤੇ ਨੀਲੇ ਟਮਸ ਨੂੰ ਲਾਲ ਕਰ ਦਿੰਦਾ ਹੈ । ਤੱਤ ਦੀ ਪ੍ਰਕਿਰਤੀ ਦੱਸੋ ਅਰਥਾਤ ਇਹ ਦੱਸੋ ਕਿ ਤੱਤ, ਧਾਤ ਹੈ ਜਾਂ ਅਧਾਤ ?
ਉੱਤਰ-
ਅਧਾਤਾਂ ਦੇ ਆਕਸਾਈਡ ਤੇਜ਼ਾਬੀ ਪ੍ਰਕਿਰਤੀ ਦੇ ਹੁੰਦੇ ਹਨ ਜੋ ਨੀਲੇ ਲਿਟਮਸ ਨੂੰ ਲਾਲ ਕਰ ਦਿੰਦੇ ਹਨ । ਕਿਉਂਕਿ ਤੱਤ X ਦਾ ਆਕਸਾਈਡ ਨੀਲੇ ਲਿਟਮਸ ਨੂੰ ਲਾਲ ਕਰ ਦਿੰਦਾ ਹੈ । ਇਸ ਲਈ ਇਸਦੀ ਪ੍ਰਕਿਰਤੀ ਤੇਜ਼ਾਬੀ ਹੈ । ਇਸ ਲਈ ਤੱਤ X ਅਧਾਤ ਹੈ ।
ਪ੍ਰਸ਼ਨ 7.
ਧਾਤਾਂ ਦੇ ਆਕਸਾਈਡਾਂ ਦੀ ਪ੍ਰਕਿਰਤੀ ਕਿਹੋ ਜਿਹੀ ਹੁੰਦੀ ਹੈ ?
ਉੱਤਰ-
ਧਾਤਾਂ ਦੇ ਆਕਸਾਈਡ ਖਾਰੀ ਆਕਸਾਈਡ ਹੁੰਦੇ ਹਨ ।
ਪ੍ਰਸ਼ਨ 8.
ਦੋ ਉੱਚ ਕੁਟੀਣਸ਼ੀਲ ਧਾਤਾਂ ਦੇ ਨਾਂ ਦੱਸੋ ।
ਉੱਤਰ-
- ਚਾਂਦੀ (ਸਿਲਵਰ ਅਤੇ
- ਸੋਨਾ (ਗੋਲਡ ।
ਪ੍ਰਸ਼ਨ 9.
ਦੋ ਮੈਟਾਲਾਇਡਸ (ਉਪ-ਧਾਤਾਂ ਦੇ ਨਾਂ ਦੱਸੋ ।
ਉੱਤਰ-
- ਸਿਲੀਕਾਂਨ,
- ਆਰਸਨਿਕ ।
ਪ੍ਰਸ਼ਨ 10.
ਧਾਤਾਂ ਨੂੰ ਹਵਾ ਵਿੱਚ ਖੁੱਲ੍ਹਾ ਛੱਡਣ ਨਾਲ ਉਨ੍ਹਾਂ ਦਾ ਰੰਗ ਫਿੱਕਾ ਕਿਉਂ ਪੈ ਜਾਂਦਾ ਹੈ ?
ਉੱਤਰ-
ਉਨ੍ਹਾਂ ਦੀ ਸਹਿ ਤੇ ਆਕਸਾਈਡ, ਕਾਰੋਬਨੇਟ ਜਾਂ ਸਲਫ਼ਾਈਡ ਦੀ ਪਰਤ ਬਣ ਜਾਣ ਕਾਰਨ ।
ਪ੍ਰਸ਼ਨ 11.
ਅਜਿਹੀਆਂ ਧਾਤਾਂ ਦੇ ਨਾਂ ਲਿਖੋ ਜਿਨ੍ਹਾਂ ਨੂੰ ਚਾਕੂ ਨਾਲ ਕੱਟਿਆ ਜਾ ਸਕਦਾ ਹੈ ।
ਉੱਤਰ-
ਸੋਡੀਅਮ, ਪੋਟਾਸ਼ੀਅਮ ਅਤੇ ਮੈਗਨੀਸ਼ੀਅਮ ।
![]()
ਪ੍ਰਸ਼ਨ 12.
ਧਾਤਾਂ ਨੂੰ ਵਿਭਿੰਨ ਆਕਾਰ ਦੇਣਾ ਕਿਉਂ ਸੰਭਵ ਹੈ ?
ਉੱਤਰ-
ਧਾਤਾਂ ਦੇ ਕੁਟੀਯੋਗ ਅਤੇ ਖਿੱਚੀਣਯੋਗ ਗੁਣਾਂ ਕਾਰਨ ।
ਪ੍ਰਸ਼ਨ 13.
ਸਭ ਤੋਂ ਘੱਟ ਇੱਕ ਤਾਪ ਚਾਲਕ ਧਾਤ ਦਾ ਨਾਂ ਦੱਸੋ ।
ਉੱਤਰ-
ਲੈਂਡ ।
ਪ੍ਰਸ਼ਨ 14.
ਕਿਹੜੀ ਧਾਤ ਬਿਜਲੀ ਪ੍ਰਵਾਹ ਦਾ ਵੱਧ ਤਿਰੋਧ ਕਰਦੀ ਹੈ ?
ਉੱਤਰ-
ਪਾਰਾ (ਮਰਕਰੀ) ।
ਪ੍ਰਸ਼ਨ 15.
ਚਾਰ ਅਜਿਹੀਆਂ ਧਾਤਾਂ ਦੇ ਨਾਂ ਦੱਸੋ ਜਿਨ੍ਹਾਂ ਦੀਆਂ ਤਾਰਾਂ ਖਿੱਚੀਆਂ ਜਾ ਸਕਦੀਆਂ ਹਨ ?
ਉੱਤਰ-
ਕਾਪਰ, ਐਲੂਮੀਨੀਅਮ, ਆਇਰਨ, ਲੈਂਡ ।
ਪ੍ਰਸ਼ਨ 16.
ਖਾਰ ਕੀ ਹੁੰਦੀ ਹੈ ? ਖਾਰ ਦੀ ਇਕ ਉਦਾਹਰਨ ਦਿਓ ।
ਉੱਤਰ-
ਖਾਰ – ਧਾਤਵੀ ਹਾਈਡਰੋਕਸਾਈਡ ਜਿਹੜੇ ਪਾਣੀ ਵਿੱਚ ਘੁਲਣਸ਼ੀਲ ਹੁੰਦੇ ਹਨ, ਖਾਰ ਕਹਾਉਂਦੇ ਹਨ ।
ਉਦਾਹਰਨ – ਸੋਡੀਅਮ ਹਾਈਡਰੋਕਸਾਈਡ (NaOH) ।
![]()
ਪ੍ਰਸ਼ਨ 17.
ਦੋ ਐਮਫੋਟੈਰਿਕ ਆਕਸਾਈਡਾਂ ਦੇ ਨਾਂ ਲਿਖੋ ।
ਉੱਤਰ-
- ਐਲੂਮੀਨੀਅਮ ਆਕਸਾਈਡ
- ਜ਼ਿੰਕ ਆਕਸਾਈਡ ।
ਪ੍ਰਸ਼ਨ 18.
ਕੀ ਹੁੰਦਾ ਹੈ ਜਦੋਂ ਮੈਗਨੀਸ਼ੀਅਮ ਨੂੰ ਇਸਦੇ ਜਲਣ ਤਾਪ ਤੱਕ ਗਰਮ ਕੀਤਾ ਜਾਂਦਾ ਹੈ ?
ਉੱਤਰ-
ਮੈਗਨੀਸ਼ੀਅਮ ਚਿੱਟੇ ਪ੍ਰਕਾਸ਼ ਨਾਲ ਬਲਣਾ ਸ਼ੁਰੂ ਕਰਦਾ ਹੈ ਅਤੇ ਮੈਗਨੀਸ਼ੀਅਮ ਆਕਸਾਈਡ ਬਣਾਉਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 19.
ਉਹ ਕਿਹੜੀ ਧਾਤ ਹੈ ਜਿਹੜੀ ਪਤਲੇ ਤੇਜ਼ਾਬ ਨਾਲ ਕਿਰਿਆ ਨਹੀਂ ਕਰਦੀ ਹੈ ?
ਉੱਤਰ-
ਕਾਪਰ ।
ਪ੍ਰਸ਼ਨ 20.
ਉਨ੍ਹਾਂ ਧਾਤਾਂ ਦੇ ਨਾਂ ਦੱਸੋ ਜਿਹੜੀਆਂ ਹਾਈਡਰੋਜਨ ਨਾਲ ਕਿਰਿਆ ਕਰਦੀਆਂ ਹਨ ?
ਉੱਤਰ-
ਸੋਡੀਅਮ, ਪੋਟਾਸ਼ੀਅਮ ਅਤੇ ਕੈਲਸ਼ੀਅਮ ।
ਪ੍ਰਸ਼ਨ 21.
ਜਦੋਂ ਕੈਲਸ਼ੀਅਮ ਧਾਤ ਦੇ ਕਿਸੇ ਟੁਕੜੇ ਨੂੰ ਪਾਣੀ ਵਿਚ ਪਾਇਆ ਜਾਂਦਾ ਹੈ ਤਾਂ ਵਾਪਰਨ ਵਾਲੀ ਕਿਰਿਆ ਦਾ ਸਮੀਕਰਨ ਲਿਖੋ ।
ਉੱਤਰ-
Ca + 2H2O → Ca (OH)2 + H2.
ਪ੍ਰਸ਼ਨ 22.
ਲਾਲ ਗਰਮ ਲੋਹੇ ਉੱਪਰੋਂ ਭਾਫ਼ ਗੁਜ਼ਾਰਣ ਨਾਲ ਹੋਣ ਵਾਲੀ ਰਸਾਇਣਿਕ ਕਿਰਿਆ ਲਈ ਸਮੀਕਰਨ ਲਿਖੋ ।
ਉੱਤਰ-
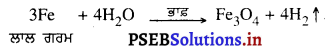
![]()
ਪ੍ਰਸ਼ਨ 23.
ਜਦੋਂ ਕਾਪਰ ਧਾਤ ਦੀ ਪੱਤੀ ਨੂੰ ਜ਼ਿੰਕ ਸਲਫੇਟ ਦੇ ਘੋਲ ਵਿੱਚ ਪਾਇਆ ਜਾਂਦਾ ਹੈ ਤਾਂ ਘੱਟਣ ਵਾਲੀ ਰਸਾਇਣਕ ਕਿਰਿਆ ਲਈ ਸਮੀਕਰਨ ਲਿਖੋ ।
ਉੱਤਰ-
Zn + CuSO4 → ZnSO4 + Cu.
ਪ੍ਰਸ਼ਨ 24.
ਦੋ ਧਾਤਾਂ ਦੇ ਨਾਂ ਦੱਸੋ ਜਿਹੜੇ ਪ੍ਰਕਿਰਤੀ ਵਿੱਚ ਮੁਕਤ ਅਵਸਥਾ ਵਿੱਚ ਪ੍ਰਾਪਤ ਹੁੰਦੇ ਹਨ ?
ਉੱਤਰ-
- ਸੋਨਾ
- ਪਲਾਟੀਨਮ ।
ਪ੍ਰਸ਼ਨ 25.
ਧਾਤਾਂ ਦੇ ਖੋਰਨ ਤੋਂ ਤੁਸੀਂ ਕੀ ਸਮਝਦੇ ਹੋ ?
ਉੱਤਰ-
ਪੋਰਨ – ਹਵਾ ਅਤੇ ਨਮੀ ਦੀ ਉਪਸਥਿਤੀ ਵਿੱਚ ਧਾਤਾਂ ਦੀ ਉੱਪਰਲੀ ਸਤਹਿ ਦਾ ਸਮਾਪਤ/ਕਮਜ਼ੋਰ ਹੋਣਾ, ਧਾਤ ਦਾ ਖੋਰਨ ਕਹਾਉਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 26.
ਕੁਟੀਯੋਗਤਾ ਦੀ ਪਰਿਭਾਸ਼ਾ ਦਿਓ ।
ਉੱਤਰ-
ਕੁਟੀਯੋਗਤਾ (Mallability) – ਇਹ ਧਾਤਾਂ ਦਾ ਉਹ ਗੁਣ ਹੈ ਜਿਸਦੇ ਕਾਰਨ ਧਾਤੂਆਂ ਨੂੰ ਹਥੌੜੇ ਨਾਲ ਕੁੱਟ ਕੇ ਬਗੈਰ ਟੁੱਟੇ ਧਾਤੂਆਂ ਨੂੰ ਪਤਲੀ ਚਾਦਰਾਂ ਦੇ ਰੂਪ ਵਿਚ ਬਦਲਿਆ ਜਾਂਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 27.
ਖਿੱਚੀਣਯੋਗਤਾ ਦੀ ਪਰਿਭਾਸ਼ਾ ਦਿਓ ।
ਉੱਤਰ-
ਖਿੱਚੀਣਯੋਗਤਾ (Ductility) – ਇਹ ਧਾਤੂਆਂ ਦਾ ਉਹ ਗੁਣ ਹੈ ਜਿਸ ਕਾਰਨ ਧਾਤਾਂ ਨੂੰ ਖਿੱਚ ਕੇ ਪਤਲੀਆਂ ਤਾਰਾਂ ਦੇ ਰੂਪ ਵਿਚ ਪਰਿਵਰਤਿਤ ਕੀਤਾ ਜਾ ਸਕਦਾ ਹੈ ।
ਪ੍ਰਸ਼ਨ 28.
ਅਸੀਂ ਲੋਹੇ ਤੋਂ ਬਣੀਆਂ ਹੋਈਆਂ ਵਸਤੂਆਂ ਨੂੰ ਪੇਂਟ ਕਿਉਂ ਕਰਦੇ ਹਾਂ ?
ਉੱਤਰ-
ਲੋਹੇ ਤੋਂ ਬਣੀਆਂ ਹੋਈਆਂ ਵਸਤੂਆਂ ਨੂੰ ਪੇਂਟ ਕੀਤਾ ਜਾਂਦਾ ਹੈ, ਤਾਂ ਜੋ ਲੋਹੇ ਤੋਂ ਬਣੀਆਂ ਹੋਈਆਂ ਵਸਤੂਆਂ ਨੂੰ ਖੋਰਨ ਤੋਂ ਬਚਾਇਆ ਜਾ ਸਕੇ ।
![]()
ਪ੍ਰਸ਼ਨ 29.
ਅਜਿਹੀ ਅਧਾਤ ਦੀ ਉਦਾਹਰਣ ਦਿਓ ਜੋ :
(i) ਬਿਜਲੀ ਦੀ ਸੁਚਾਲਕ ਹੈ
(ii) ਚਮਕੀਲੀ ਹੁੰਦੀ ਹੈ ।
ਉੱਤਰ-
(i) ਬਿਜਲੀ ਦੀ ਸੁਚਾਲਕ ਅਧਾਤ-ਗ੍ਰੇਫਾਈਟ
(ii) ਚਮਕੀਲੀ ਅਧਾਤ-ਆਇਓਡੀਨ ।
ਵਸਤੁਨਿਸ਼ਠ ਪ੍ਰਸ਼ਨ (Objective Type Questions)
ਪ੍ਰਸ਼ਨ 1.
ਸਾਧਾਰਨ ਅਵਸਥਾ ਵਿਚ ਦ੍ਰ ਅਵਸਥਾ ਵਿਚ ਮਿਲਣ ਵਾਲੀ ਅਧਾਤੂ ਹੈ-
(a) ਕਲੋਰੀਨ
(b) ਬੋਮੀਨ
(c) ਫਲੋਰੀਨ
(d) ਆਇਓਡੀਨ ।
ਉੱਤਰ-
(b) ਬੋਮੀਨ ।
ਪ੍ਰਸ਼ਨ 2.
ਐਮਫੋਟੈਰਿਕ ਆਕਸਾਈਡ ਹੈ-
(a) Na2O
(b) BaO
(c) ZnO
(d) K2O.
ਉੱਤਰ-
(c) ZnO.
ਪ੍ਰਸ਼ਨ 3.
ਧਾਤਾਂ ਨੂੰ ਕੁੱਟ ਕੇ ਪਤਲੀ ਚਾਦਰ ਵਿਚ ਬਦਲਿਆ ਜਾ ਸਕਦਾ ਹੈ । ਧਾਤਾਂ ਦਾ ਇਹ ਗੁਣ ਅਖਵਾਉਂਦਾ ਹੈ-
(a) ਕੁਟੀਣਸ਼ੀਲਤਾ
(b) ਖਿੱਚੀਣਸ਼ੀਲਤਾ
(c) ਧਾਤਵੀ ਲਿਸ਼ਕ
(d) ਕਠੋਰਤਾ ।
ਉੱਤਰ-
(a) ਕੁਟੀਣਸ਼ੀਲਤਾ ।
ਪ੍ਰਸ਼ਨ 4.
ਕਿਰਿਆਸ਼ੀਲਤਾ ਲੜੀ ਵਿਚ ਸਭ ਤੋਂ ਵੱਧ ਕਿਰਿਆਸ਼ੀਲ ਧਾਤ ਕਿਹੜੀ ਹੈ ?
(a) Na
(b) Mg
(c) Au
(d) K.
ਉੱਤਰ-
(d) K.
ਪ੍ਰਸ਼ਨ 5.
Fe2O3 + 2Al – 2Fe + Al2O3 + ਊਸ਼ਮਾ, ਇਸ ਕਿਰਿਆ ਦਾ ਨਾਂ ਹੈ –
(a) ਐਲੋਡੀਕਰਨ
(b) ਥਰਮਾਈਟ
(c) ਐਮਲਗਮ
(d) ਉੱਪਰਲੇ ਸਾਰੇ ।
ਉੱਤਰ-
(b) ਥਰਮਾਣ ।
![]()
ਪ੍ਰਸ਼ਨ 6.
ਗੈਲਵਨੀਕਰਨ ਸਮੇਂ ਕਿਸ ਧਾਤ ਦੀ ਪਰਤ ਚੜ੍ਹਾਈ ਜਾਂਦੀ ਹੈ ?
(a) ਗੋਲੀਅਮ
(b) ਐਲੂਮੀਨੀਅਮ
(c) ਜਿਸਤ
(d) ਚਾਂਦੀ ।
ਉੱਤਰ-
(c) ਜਿਸਤ ।
ਖ਼ਾਲੀ ਥਾਂਵਾਂ ਭਰਨਾ
ਪ੍ਰਸ਼ਨ-ਹੇਠ ਲਿਖੀਆਂ ਖ਼ਾਲੀ ਥਾਂਵਾਂ ਭਰੋ :
(i) ਵੱਧ ਕਿਰਿਆਸ਼ੀਲ ਧਾਤਾਂ ਦੁਆਰਾ ਘੱਟ ਕਿਰਿਆਸ਼ੀਲ ਧਾਤਾਂ ਨੂੰ ਉਸਦੇ ਲੂਣ ਦੇ ਘੋਲ ਤੋਂ ਵਿਸਥਾਪਿਤ ਕਰਨ ਦੀ ਕਿਰਿਆ ………………….. ਕਹਾਉਂਦੀ ਹੈ ।
ਉੱਤਰ-
ਵਿਸਥਾਪਨ
(ii) ਮਿਸ਼ਰਿਤ ਧਾਤ ਦੋ ਜਾਂ ਦੋ ਤੋਂ ਵੱਧ ਧਾਤਾਂ ਜਾਂ ਧਾਤ ਅਤੇ ਅਧਾਤ ਦਾ …………………… ਮਿਸ਼ਰਣ ਹੁੰਦਾ ਹੈ ।
ਉੱਤਰ-
ਸਮਅੰਗੀ
(iii) ਲੋਹੇ ਦੇ ਪੈਨ ਨੂੰ ਜੰਗ ਤੋਂ ਬਚਾਉਣ ਲਈ ……………………. ਦੀ ਪਰਤ ਚੜ੍ਹਾਈ ਜਾਂਦੀ ਹੈ ।
ਉੱਤਰ-
ਜ਼ਿੰਕ
(iv) ਸਲਫਾਈਡ ਕੱਚੀ ਧਾਤ ਨੂੰ ਹਵਾ ਦੀ ਹੋਂਦ ਵਿੱਚ ਉੱਚੇ ਤਾਪ ਤੇ ਗਰਮ ਕਰਨ ਨਾਲ ਇਹ ਆਕਸਾਈਡ ਵਿੱਚ ਤਬਦੀਲ ਹੋ ਜਾਂਦੀ ਹੈ । ਇਸ ਅਭਿਕਿਰਿਆ ਨੂੰ …………………….. ਕਹਿੰਦੇ ਹਨ ।
ਉੱਤਰ-
ਭੰਨਣ
(v) ਧਾਤ ਦੇ ਪਤਲੇ ਤਾਰ ਦੇ ਰੂਪ ਵਿੱਚ ਖਿੱਚਣ ਦੀ ਸਮਰੱਥਾ ਨੂੰ ………………………. ਕਹਿੰਦੇ ਹਨ ।
ਉੱਤਰ-
ਖਿੱਚੀਯੋਗਤਾ ।
