Punjab State Board PSEB 10th Class Science Important Questions Chapter 4 कार्बन एवं उसके यौगिक Important Questions and Answers.
PSEB 10th Class Science Important Questions Chapter 4 कार्बन एवं उसके यौगिक
दीर्घ उत्तरात्मक प्रश्न (Long Answer Type Questions)
प्रश्न 1.
अपररूपता किसे कहते हैं ? कार्बन के अपररूपों के नाम लिखो। क्या वे रासायनिक दृष्टि से समान हैं ? उनके भौतिक गुणों की तुलना कीजिए।
उत्तर-
अपररूपता- जिस गुण के कारण तत्व विभिन्न रूपों में पाए जाते हैं, उसे अपररूपता कहते हैं तथा विभिन्न रूपों को तत्व के अपररूप कहते हैं।
कार्बन के अपररूप
- हीरा
- ग्रेफाइट।
रासायनिक दृष्टि से समानता-यदि दोनों अपररूपों की समान मात्रा को वायु में गर्म किया जाए तो दोनों समान मात्रा में ही कार्बन डाइऑक्साइड बनाते हैं और शेष कुछ नहीं बचता। अतः इस प्रयोग से यह सिद्ध होता है कि दोनों अपररूप रासायनिक दृष्टि से समान हैं :
C + O2 → CO2, (हीरा या ग्रेफाइट)
हीरे तथा ग्रेफाइट के भौतिक गुणों की तुलना
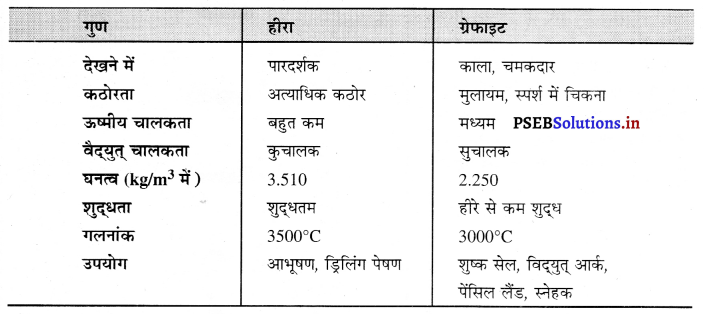
![]()
प्रश्न 2.
(क) सहसंयोजी आबंध किसे कहते हैं ? इनकी विशेषताएँ लिखिए।
(ख) आयनिक और सहसंयोजी यौगिकों में अंतर लिखिए।
उत्तर-
(क) सहसंयोजी आबंध-दो परमाणुओं के बीच इलेक्ट्रॉन के एक जोडे की साझेदारी से बनने वाले आबंध को सहसंयोजी आबंध कहते हैं। इनमें निम्नलिखित विशेषताएं होती हैं
- इन अणुओं में भीतर प्रबल आबंध होता है लेकिन इनका अंतराअणुक बल कम होता है।
- इनका क्वथनांक कम होता है।
- इनका गलनांक कम होता है।
- इनके यौगिक विद्युत् के कुचालक होते हैं।
(ख) आयनिक तथा सहसंयोजी यौगिकों में अंतर-
| आयनिक यौगिक | सहसंयोजी यौगिक |
| 1. ये प्रायः क्रिस्टलीय ठोस अवस्था में पाए जाते हैं। | 1. ये प्रायः द्रवीय या गैसीय अवस्था में पाए जाते हैं परंतु कुछ ठोस अवस्था में भी पाए जाते हैं। |
| 2. ये विद्युत् के सुचालक होते हैं। | 2. ये विद्युत् के कुचालक होते हैं। |
| 3. ये जल में घुलनशील होते हैं। | 3. ये कार्बनिक विलायकों में घुलनशील होते हैं। |
| 4. ये तीव्र अभिक्रियाशील होते हैं। | 4. ये धीमे अभिक्रियाशील होते हैं। |
| 5. इनका गलनांक और क्वथनांक उच्च होता है। | 5. इनका गलनांक और क्वथनांक निम्न होता है। |
प्रश्न 3.
कार्बन यौगिकों की गणना अन्य सभी तत्त्वों की गणना के कुल योग से भी अधिक है। इसका क्या कारण है ?
उत्तर-
कार्बन यौगिकों की अत्याधिक संख्या-सहसंयोजी बंध की प्रकृति के कारण कार्बन में बड़ी संख्या में यौगिक बनाने की क्षमता होती है। ऐसा कार्बन के दो निम्नलिखित कारकों/गुणों के फलस्वरूप होता है-
(i) श्रंखलन (Catenation) कार्बन में कार्बन के ही अन्य परमाणुओं के साथ आबंध बनाने की अद्वितीय क्षमता होती है जिससे बड़ी संख्या में अणु बनते हैं। इस गुण को शृंखलन कहते हैं।
इन यौगिकों में-
(a) कार्बन की लंबी श्रृंखला,
(b) कार्बन की विभिन्न शाखाओं वाली श्रृंखला अथवा
(c) वलय में व्यवस्थित कार्बन भी पाये जाते हैं।
साथी ही कार्बन के परमाणु एक, द्वि अथवा त्रि आबंध से जुड़े हो सकते हैं। जिस सीमा तक श्रृंखलन का गुण कार्बन यौगिकों में पाया जाता है वह किसी और तत्त्व में नहीं मिलता। कार्बन-कार्बन आबंध अत्याधिक प्रबल होता है। अत: यह स्थायी होता है।
(ii) चतुः संयोजकता (Tetra-valency)-चूंकि कार्बन की संयोजकता चार होती है, इसलिए इसमें कार्बन के चार अन्य परमाणुओं या कुछ अन्य एक संयोजक तत्त्वों के परमाणुओं के साथ आबंधन की क्षमता होती है। ऑक्सीजन, हाइड्रोजन, नाइट्रोजन सल्फर, क्लोरीन तथा अन्य तत्त्वों के साथ कार्बन के यौगिक बनते हैं। अन्य तत्त्वों के साथ कार्बन द्वारा बनाए गए आबंध प्रबल होते हैं जिससे यौगिक बहुत स्थायी होते हैं। प्रबल आबंधों के कारण इसका आकार भी छोटा होता है।
प्रश्न 4.
कार्बन यौगिकों के रासायनिक गुणधर्म लिखिए।
उत्तर-
कार्बन यौगिकों के प्रमुख रासायनिक गुणधर्म कार्बन यौगिकों के रासायनिक गुणधर्म निम्नलिखित हैं
(i) दहन-कार्बन अपने सभी अपरूपों में ऑक्सीजन की उपस्थिति में दहन करता है और ऊष्मा, प्रकाश के साथ-साथ CO2, उत्पन्न करता है। उदाहरण
C + O2 → CO2 + ऊष्मा तथा प्रकाश
CH4 + 2O2, → CO2 + 2H2O + ऊष्मा तथा प्रकाश
CH3CH2OH + 3O2 → 2CO2 + 3H2O + ऊष्मा तथा प्रकाश
संतृप्त हाइड्रोकार्बन स्वच्छ ज्वाला के साथ जलते हैं और असंतृप्त कार्बन काले धुएँ वाली पीली ज्वाला उत्पन्न करते हैं।
(ii) ऑक्सीकरण-कार्बन यौगिकों को दहन के द्वारा सरलता से ऑक्सीकृत किया जा सकता है। क्षारीय पोटाशियम परमैंगनेट या अम्लीकृत पोटैशियम डाइक्रोमेट ऐल्कोहॉलों को अम्लों में ऑक्सीकृत कर देते हैं।
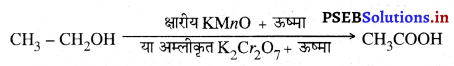
(iii) संकलन अभिक्रिया-असंतृप्त हाइड्रोकार्बन पैलेडियम और निक्कल जैसे उत्प्रेरकों की उपस्थिति में अपने साथ हाइड्रोजन संकलित (जोड़) कर संतृप्त हाइड्रोकार्बन बनाते हैं। निक्कल उत्प्रेरक का उपयोग प्रायः वनस्पति तेलों के हाइड्रोजनीकरण में किया जाता है। वनस्पति तेलों में प्रायः लंबी असंतृप्त कार्बन श्रृंखलाएँ होती हैं जबकि जंतु वसा में संतृप्त कार्बन श्रृंखलाएं होती हैं।

(iv) प्रतिस्थापन अभिक्रिया-संतृप्त हाइड्रोकार्बन अधिकतर अभिकर्मकों की उपस्थिति में क्रिया नहीं करते पर सूर्य के प्रकाश की उपस्थिति में क्लोरीन का हाइड्रोकार्बन में संकलन होता है। क्लोरीन अति तीव्र अभिक्रिया में एकएक करके हाइड्रोजन के परमाणुओं का प्रतिस्थापन करती है जिस कारण उच्च समजातीय एल्केन के साथ अनेक उत्पादों का निर्माण होता है।


![]()
प्रश्न 5.
ऐल्कोहॉल किसे कहते हैं ? कृत्रिम ऐथनॉल को किस विधि द्वारा बनाया जाता है ? एथेनॉल के भौतिक तथा रासायनिक गुण लिखिए।
उत्तर-
ये कार्बन, हाइड्रोजन तथा ऑक्सीजन के सरल यौगिक होते हैं। किसी एल्केन के एक हाइड्रोजन परमाणु को हाइड्रोक्सिल (-OH) ग्रुप द्वारा प्रतिस्थापित करने पर ऐल्कोहॉल प्राप्त होते हैं।
ऐल्कोहॉल का सामान्य सूत्र (CnH2n +2) OH होता है।
उदाहरण-
- मिथेन (CH4) में हाइड्रोजन परमाणु को हाइड्रोक्सिल (–OH) ग्रुप द्वारा प्रतिस्थापित करने में मिथनॉल (CH3OH) प्राप्त होता है।
- एथेन द्वारा एथेनॉल (C2H5OH) प्राप्त होता है।
कृत्रिम एथेनॉल की तैयारी –
कृत्रिम एथेनॉल को बनाने के लिए फॉस्फोरिक अम्ल की उपस्थिति में एथीन की जल के साथ क्रिया की जाती है।

एथीन फॉस्फोरिक अम्ल
एथेनॉल एथेनॉल के भौतिक गुण
- यह एक विशिष्ट गंध वाला रंगहीन द्रव है।
- इसका क्वथनांक 351K तथा गलनांक 156K है।
- यह सभी अनुपातों में जल में विलेय है।
- इसका लिटमस पर कोई प्रभाव नहीं होता क्योंकि यह उदासीन है।
ऐथनॉल के रासायनिक गुण-
(i) यह वायु में नीली लौ के साथ जलती है जिससे कार्बन डाइऑक्साइड तथा पानी बनता है।
C2H5OH + 3O2, → 2CO2, + 3H2O
(ii) ऑक्सीजन या पोटेशियम डाइक्रोमेट (K2Cr2O7) के साथ क्रिया करके ऐथनॉल, ऐथानॉइक अम्ल उत्पन्न करता है।
C2H5OH + O2 → CH3COOH + H2O
(iii) सोडियम के साथ अभिक्रिया
एल्कोहल सोडियम धातु से क्रिया कर हाइड्रोजन गैस उत्सर्जित करता है। इस अभिक्रिया में दूसरा उत्पाद सोडियम ऐथॉक्साइड बनता है।
2C2H5OH + 2Na→ 2C2H5ONa + H2 (सोडियम ऐथॉक्साइड)
(iv) यह सांद्र H2CO4, की उपस्थिति में ग्लैशल ऐसिटिक अम्ल के साथ क्रिया करती है। जब इस मिश्रण को जल तापन पात्र पर गर्म करके हिमशीत सोडियम कार्बोनेट के विलयन पर डालते हैं तो मधुर गंध वाला ऐस्टर उत्पन्न होता है।

(v) असंतृप्त हाइड्रोकार्बन बनाने की अभिक्रिया-ऐथनॉल को अधिक्य सांद्र सल्फ्यूरिक अम्ल के साथ 443K तापमान पर गर्म करने से एथनॉल का निर्जलीकरण हो जाता है और एथीन बनता है।
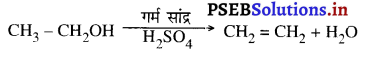
इस अभिक्रिया में सल्फ्यूरिक अम्ल निर्जलीकारक के रूप में काम करता है।
प्रश्न 6.
एथेनॉल के तीन रासायनिक गुण लिखो। इसका प्रयोग ईंधन के तौर पर क्यों किया जाता है ?
उत्तर-
ऐथनॉल के रासायनिक गुण-
(i) यह वायु में नीली लौ के साथ जलती है जिससे कार्बन डाइऑक्साइड तथा पानी बनता है।
C2H5OH + 3O2, → 2CO2, + 3H2O
(ii) ऑक्सीजन या पोटेशियम डाइक्रोमेट (K2Cr2O7) के साथ क्रिया करके ऐथनॉल, ऐथानॉइक अम्ल उत्पन्न करता है।
C2H5OH + O2 → CH3COOH + H2O
(iii) सोडियम के साथ अभिक्रिया
एल्कोहल सोडियम धातु से क्रिया कर हाइड्रोजन गैस उत्सर्जित करता है। इस अभिक्रिया में दूसरा उत्पाद सोडियम ऐथॉक्साइड बनता है।
2C2H5OH + 2Na→ 2C2H5ONa + H2 (सोडियम ऐथॉक्साइड)
(iv) यह सांद्र H2CO4, की उपस्थिति में ग्लैशल ऐसिटिक अम्ल के साथ क्रिया करती है। जब इस मिश्रण को जल तापन पात्र पर गर्म करके हिमशीत सोडियम कार्बोनेट के विलयन पर डालते हैं तो मधुर गंध वाला ऐस्टर उत्पन्न होता है।

(v) असंतृप्त हाइड्रोकार्बन बनाने की अभिक्रिया-ऐथनॉल को अधिक्य सांद्र सल्फ्यूरिक अम्ल के साथ 443K तापमान पर गर्म करने से एथनॉल का निर्जलीकरण हो जाता है और एथीन बनता है।
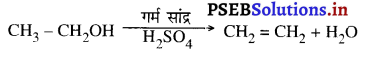
इस अभिक्रिया में सल्फ्यूरिक अम्ल निर्जलीकारक के रूप में काम करता है।
एथेनॉल का प्रयोग ईंधन के रूप में- यह कार्बन का यौगिक ऑक्सीजन में जलने पर अत्यधिक मात्रा में उष्मा तथा प्रकाश उत्पन्न करता है। कुछ देशों में पैट्रोल में एथेनॉल मिलाकर स्वच्छ इंधन के रूप में प्रयोग किया जाता है।
C2H5OH + O2 → CO2 + H2O + ऊष्मा + प्रकाश
प्रश्न 7.
ऐथनॉइक अम्ल के वाणिज्यकीय उत्पादन की विधि का वर्णन करें। ऐथनॉइक अम्ल के गुण तथा उपयोग भी लिखिए।
उत्तर-
ऐथनॉइक अम्ल का वाणिज्यकीय उत्पादन
ऐथनॉइक अम्ल (Acetic Acid) को किण्वन क्रिया से व्यापारिक स्तर पर तैयार किया जाता है। ऐथनॉल की एसिटोबैक्टर नामक जीवाणुओं की उपस्थिति में किण्वन क्रिया करवाई जाती है। यह एक ऑक्सीकरण क्रिया है जिससे ऐथनॉइक अम्ल प्राप्त कर लिया जाता है।

ऐथनॉइक अम्ल के गुण
(क) भौतिक गुण-
- शुद्ध ऐथनॉइक अम्ल का गलनांक 290K होता है और इसीलिए शीत के दिनों में जम जाता है।
- यह एक दुर्बल अम्ल है।
- यह पानी में विलेय है।
(ख) रासायनिक गुण
- सोडियम से क्रिया 2CH3COOH + 2Na → 2CH3COONa + H2 सोडियम ऐथनोएट
- सोडियम हाइड्रोक्साइड और पोटेशियम हाइड्रोक्साइड से क्रिया –
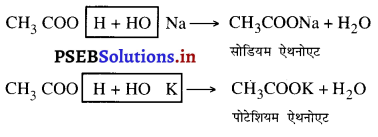
(iii) कार्बोनेट एवं हाइड्रोजन कार्बोनेट से क्रिया-कार्बोनेट और हाइड्रोजन कार्बोनेट के साथ क्रिया करके यह लवण जल एवं कार्बन डाइऑक्साइड उत्पन्न करते हैं।

(iv) ऐस्टरीकरण प्रतिक्रिया-एथेनाइक अम्ल किसी अम्लीय उत्प्रेरक की उपस्थिति में शुद्ध ऐथनॉल (अल्कोहल) से प्रतिक्रिया करके ऐस्टर बनाता है। ऐस्टर की गंध मीठी होती है।

ऐथनोइक अम्ल के उपयोग –
- ऐथनॉइक अम्ल रंग, रेयॉन, प्लास्टिक, रबड़ और रेशम उद्योगों में प्रयुक्त किया जाता है।
- इसे सिरका तथा अचार के रूप में प्रयोग में लाया जाता है।
- इसे सफेद सीसा (white lead 2PbCO3.Pb(OH)2) बनाने में प्रयुक्त किया जाता है।
![]()
प्रश्न 8.
निम्न पदों की व्याख्या कीजिए :
(i) एस्टरीकरण
(ii) साबुनीकरण
(iii) डिकार्बोक्सीलेशन एवं
(iv) बहुलीकरण।
उत्तर-
(i) एस्टरीकरण (Esterification)
ऐल्कोहॉलों के सांद्र सल्फ्यूरिक अम्ल की उपस्थिति में कार्बनिक अम्लों की क्रिया से एस्टर के निर्माण की विधि को एस्टरीकरण कहते हैं।
विधि-एक परखनली में इथाइल ऐल्कोहॉल को एसिटिक अम्ल में मिलाओ। इसमें कुछ बूंदें सांद्र सल्फ्यूरिक अम्ल की डालो और परखनली को हल्के गर्म पानी के टब में रख दो। शीघ्र ही सारे कमरे में एस्टर की सुगंधी भर जाएगी।
CH3COOH + C2H5OH → CH3COOC2H5
यह क्रिया एस्टरीकरण का उदाहरण है। एस्टरों का उपयोग आइसक्रीम, ठंडे पेय, दवाइयों, सौंदर्य प्रसाधन आदि में किया जाता है।
(ii) साबुनीकरण (Saponification) वसा को विघटित करने की प्रक्रिया को साबुनीकरण कहते हैं। साबुनीकरण का कार्य वनस्पति या जंतु वसा में कास्टिक सोडा का 40% विलयन डाल कर गर्म करने से हो जाता है। वसा तथा क्षार अभिक्रिया करके साबुन तथा ग्लिसरॉल बनाते हैं।
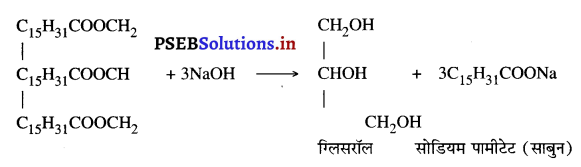
जलीय विलयन से साबुन को अवक्षेपित करने के लिए इसमें नमक का संतृप्त घोल डाला जाता है। ठंडा होने पर साबुन जम कर ऊपरी सतह पर आ जाता है। इसे ऊपर से निकाल लिया जाता है और इसमें मनचाहा रंग और सुगंध मिला कर विभिन्न प्रकार के आकार दे दिए जाते हैं।
(iii) डीकार्बोक्सीलेशन (Decarboxylation)
ऐथेनॉइक अम्ल के सोडियम या पोटाशियम लवण को सोडियम हाइड्रोक्साइड और कैल्सियम ऑक्साइड के 3 : 1 मिश्रण के साथ गर्म करने से मिथेन उत्पन्न होती है।
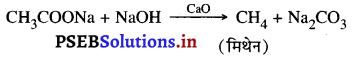
यह मीथेन गैस को बनाने की उपयोगी विधि है। चूंकि इस में CO, का एक अणु हट जाता है, इसलिए इस क्रिया को डीकार्बोक्सीलेशन (Decarboxylation) कहते हैं।
(iv) बहुलीकरण (Polymerization)-
जब विशेष ताप और दाब की उपस्थिति में छोटे-छोटे अणु आपस में जुड़कर एक बड़ा अणु बनाते हैं तो इस क्रिया को बहुलीकरण कहते हैं। छोटे अणु को ‘एकलक’ और बड़े अणु को ‘बहुलक’ कहते हैं।
प्रश्न 9.
समावयव से क्या अभिप्राय होता है ? उदाहरण देकर स्पष्ट कीजिए।
अथवा
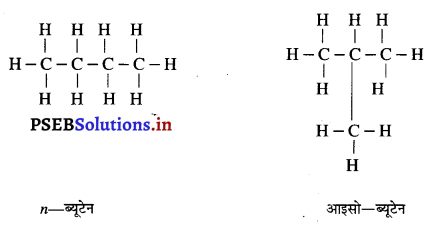
ब्यूटेन के समावयव लिखिए।
उत्तर-
समावयव (Isomers)- ऐसे यौगिक जिनका आण्विक सूत्र तो समान हो परंतु अणुओं की संरचनात्मक व्यवस्था भिन्न-भिन्न हो, उन्हें समावयव कहते हैं तथा इस घटना को समावयवता कहते हैं। मिथेन, एथेन, प्रोपेन में कार्बन तथा हाइड्रोजन के परमाणुओं को पुनः व्यवस्थित करने पर भी संरचना में कोई परिवर्तन नहीं आता परंतु जब अल्केन के अणु में कार्बन की संख्या तीन से अधिक हो जाती है तो एक से अधिक व्यवस्थाएं संभव हो जाती हैं।
इनमें से एक में कार्बन परमाणु लंबी श्रृंखला बनाते हैं जबकि दूसरे में शाखाएं होती हैं। ब्यूटेन में शाखा युक्त श्रृंखला में कम-से-कम कार्बन परमाणु तीन अन्य कार्बन परमाणुओं से बंधित है। इस प्रकार अल्केनों को आइसो-अल्केन कहते हैं। शाखा रहित श्रृंखला में कोई भी कार्बन परमाणु दो से अधिक कार्बन परमाणुओं से बंधित नहीं होता है। इस प्रकार के एल्केनों को सामान्य (नार्मल) n-एल्केन कहते हैं।
ब्यूटेन के दो समावयव
लघु उत्तरात्मक प्रश्न (Short Answer Type Questions)
प्रश्न 1.
कार्बन मुख्यतया सहसंयोजी आबंधों द्वारा यौगिक क्यों बनाता है ?
उत्तर-
कार्बन परमाणु में चार संयोजी इलेक्ट्रॉन होते हैं। यह इन चार इलेक्ट्रॉनों को त्यागकर अथवा चार अन्य इलेक्ट्रॉनों को ग्रहण करके स्थायी विन्यास प्राप्त कर सकते हैं। ऊर्जा संबंधी तथ्यों के अनुसार कार्बन चार इलेक्ट्रॉनों को न तो ग्रहण कर सकता है और न ही इनका त्याग कर सकता है। इस प्रकार, कार्बन के लिए स्थायी विन्यास प्राप्त करने हेतु केवल एक ही विकल्प है कि यह यौगिक निर्माण में इलेक्ट्रॉनों को सांझा करे अर्थात् सहसंयोजक आबंध बनाए।
प्रश्न 2.
CH3CI के आबंध के निर्माण की उदाहरण से सहसंयोजक आबंध की प्रकृति को समझाइए।
उत्तर-
CH3CI एक कार्बन परमाणु, तीन हाइड्रोजन परमाणुओं और एक क्लोरीन परमाणु का बना होता है। कार्बन परमाणु में 4 (संयोजकता इलेक्ट्रॉन), प्रत्येक हाइड्रोजन में 1 संयोजकता इलेक्ट्रॉन और क्लोरीन परमाणु में 7 संयोजकता इलेक्ट्रॉन होते हैं। कार्बन परमाणु अपने 4 संयोजकता इलेक्ट्रॉन होते हैं। कार्बन परमाणु अपने 4 संयोजकता इलेक्ट्रॉनों को तीन हाइड्रोजन परमाणुओं और एक क्लोरीन परमाणु से सांझा करके CH,CI बनाता है।
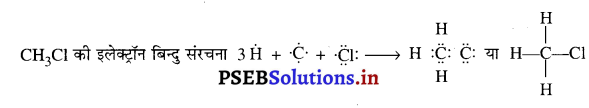
CH3Cl की उपर्युक्त इलेक्ट्रॉन बिंदु संरचना से हम पता लगा सकते हैं कि कार्बन और दूसरे परमाणुओं के बीच में साझे इलेक्ट्रॉनों के चार जोड़े हैं। साझे इलेक्ट्रॉनों का प्रत्येक जोड़ा एक एकल सहसंयोजक आबंध बनाता है। इसलिए, CH3Cl में चार एकल सहसंयोजक आबंध हैं।
प्रश्न 3.
हीरे की संरचना समझाइए और बताइए कि हीरा इतना कठोर क्यों है ?
उत्तर-
हीरे में प्रत्येक कार्बन परमाणु नियमित चतुष्फलक के केंद्र में स्थित रहता है तथा यह सहसंयोजक बंध द्वारा उन चार कार्बन परमाणुओं से बंधित रहता है जो चतुष्फलक के चारों कोनों पर स्थित होते हैं। इस प्रकार कार्बन परमाणु के समस्त बंध योग्य इलेक्ट्रॉन बंधित रहते हैं तथा कोई भी इलेक्ट्रॉन स्वतंत्र नहीं होता। इस प्रकार के प्रबल बंधित चतुष्फलक अवस्था के कारण एक तीन आयामी सुदृढ़ संरचना बन जाती है। हीरा सबसे कठोर तत्व है तथा इसका घनत्व अति उच्च है। चित्र-हीरे की संरचना में कार्बन परमाणुओं की व्यवस्था
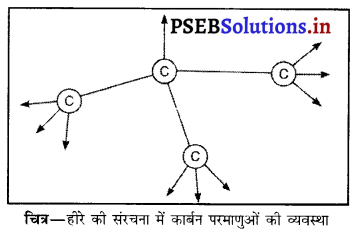
![]()
प्रश्न 4.
हीरे के उपयोग लिखिए।
उत्तर-
हीरे के उपयोग–
- हीरा सबसे कठोर पदार्थ है इसलिए इसका उपयोग दूसरे पदार्थों को काटने के लिए किया जाता है।
- इसकी अद्वितीय चमक के कारण इसका उपयोग आभूषणों को बनाने में किया जाता है।
- इसका उपयोग पृथ्वी की चट्टानों में छिद्र करने हेतु पेषण के रूप में किया जाता है।
- नुकीले किनारे वाले हीरे शल्य चिकित्सकों को आँखों से मोतिया बिंद हटाने के लिए उत्तम औजार प्रदान करते हैं।
प्रश्न 5.
हीरे के अत्यधिक चमकने के कारण बताइए।
उत्तर-
हीरा एक पारदर्शक पदार्थ है जिसका अपवर्तन गुणांक बहुत अधिक होता है। इसमें से गुजरने वाली प्रकाश किरणों का मार्ग से विचलन बहुत अधिक होता है। इसके अनेक प्रतिच्छेदी तलों के अनुरूप उच्चकोटि का विचलन होता है। जब इन प्रतिच्छेदी तलों को पॉलिश कर दिया जाए तो यह हीरे को एक विशेष प्रकार की चमक प्रदान करते हैं जिससे हीरा अत्याधिक चमकता है।
प्रश्न 6.
ग्रेफाइट की संरचना लिखिए तथा यह बताइये कि ग्रेफाइट इतना मुलायम क्यों है ?
उत्तर-
ग्रेफाइट की संरचना-ग्रेफाइट में प्रत्येक कार्बन परमाणु केवल तीन पड़ोसी कार्बन परमाणुओं से सहसंयोजक बंधों द्वारा जुड़ा होता है तथा षट्कोणीय जाल की परतें बनाता है। हीरे की तुलना में ग्रेफाइट में कार्बन परमाणुओं के बीच की दूरी अधिक होती है। ऊपर नीचे की परतों की इस दूरी के कारण विपरीत परतों में स्थित कार्बन परमाणुओं के मध्य सहसंयोजक बंध बनने की संभावना समाप्त हो जाती है जिससे चौथा इलेक्ट्रॉन स्वतंत्र रह जाता है। दूसरे के ऊपर आसानी से फिसल सकती हैं, जिस कारण ग्रेफाइट में स्नेहक गुण होते हैं तथा यह स्पर्श करने में चित्र-ग्रेफाइट की संरचना में कार्बन परमाणुओं की व्यवस्था मुलायम तथा चिकना अनुभव होता है।
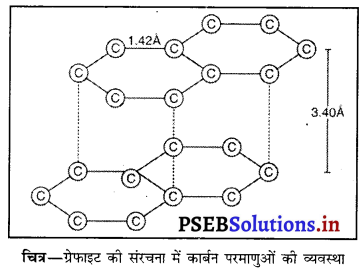
प्रश्न 7.
ग्रेफाइट के भौतिक गुण लिखिए।
उत्तर-
ग्रेफाइट के भौतिक गुण-
- ग्रेफाइट एक चमकदार काला पदार्थ है।
- ग्रेफाइट स्पर्श करने पर मुलायम तथा चिकना प्रतीत होता है।
- यह विद्युत् का सुचालक है।
- इसका घनत्व 2250 kg/m है।
- इसका गलनांक 3700°C है।
प्रश्न 8.
क्या कारण है कि ग्रेफाइट विद्युत् का सुचालक है ?
उत्तर-
ग्रेफाइट में प्रत्येक कार्बन परमाणु केवल तीन कार्बन परमाणुओं से सहसंयोजक बंधों द्वारा जुड़ा रहता है तथा जिस कारण इसमें षट्कोणीय जाल की परतें बनाती हैं। इसमें कार्बन परमाणुओं के बीच दूरी अधिक होती है। परतों के मध्य इस दूरी के कारण विपरीत परतों में स्थित कार्बन परमाणुओं के बीच सहसंयोजक बंधों के बनने की संभावना समाप्त हो जाती है और चौथा संयोजक इलेक्ट्रॉन स्वतंत्र छूट जाता है। इसीलिए ग्रेफाइट में इलेक्ट्रॉनों का प्रवाह आसानी से हो सकता है और ग्रेफाइट विद्युत् का सुचालक होता है।
प्रश्न 9.
ग्रेफाइट के उपयोग लिखिए।
उत्तर-
ग्रेफाइट के उपयोग-
- यह विद्युत् का सुचालक है, इसलिए इसका उपयोग शुष्क सैल, विद्युत् आर्क में इलेक्ट्रोड के रूप में होता है।
- इससे पेंसिल, काला रंग, काला पेंट इत्यादि बनाए जाते हैं।
- इसके स्नेहक गुण के कारण इसका उपयोग उच्च ताप पर मशीनों को चिकना रखने में होता है।
- इसके उच्च गलनांक के कारण ग्रेफाइट की बनी क्रूसीबल कुछ धातुओं को पिघलाने हेतु उपयोग होती है।
प्रश्न 10.
उन पदार्थों को जिनमें 60 कार्बन परमाणु एक-दूसरे से जुड़कर अणु बनाते हैं, फुलरीन क्यों कहते हैं?
उत्तर-
जिन पदार्थों में 60 कार्बन परमाणु एक-दूसरे से जुड़कर अणु बनाते हैं, उन्हें फुलरीन कहते हैं। अमेरिकी वास्तुकार बकमिंसटर फुलर ने त्रिविमीय ज्यामिति वाले गुंबदों की रचना की जिन्हें दृढ़ता प्रदान करने के लिए पंचकोणीय और षट्कोणीय व्यवस्था का उपयोग किया गया था। फुलरीन अणुओं की संरचना इन गुंबदों से मिलती-जुलती प्रतीत होती है। इसलिए उनके नाम पर इन्हें फुलरीन कहते हैं।
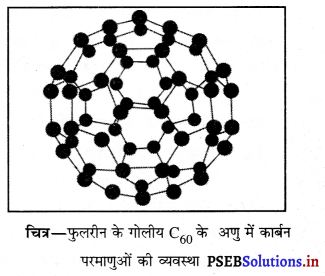
प्रश्न 11.
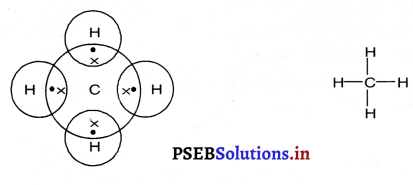
मिथेन, एथेन, एथीन और प्रोपेन की इलेक्ट्रॉन बिंदु संरचना बनाइए।
उत्तर-
(1) मिथेनसूत्र : CH4
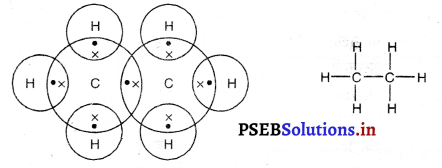
(2) एथेनसूत्र : C2H6
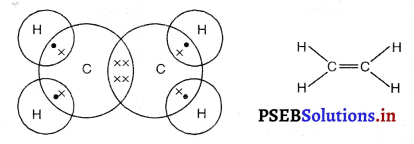
(3) एथीनसूत्र : C2H4
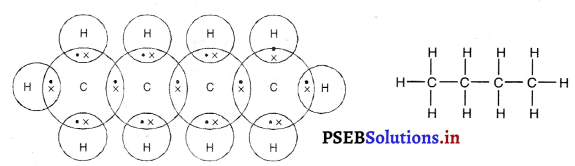
(4) प्रोपेनसूत्र : C2H10
![]()
प्रश्न 12.
(a) समजातीय श्रृंखला क्या होती है ? इसके दो गुण लिखो। एल्केन श्रृंखला के पहले दो सदस्यों के नाम एवं सूत्र लिखो।
(b) मिथेन श्रृंखला के प्रथम तीन समजातीय सदस्यों के नाम एवं संरचना सूत्र लिखो।
उत्तर-
(a) समजातीय श्रेणी-कार्बनिक यौगिकों को एक ही क्रियात्मक समूह वाले, रासायनिक दृष्टि से समान तथा एक ही सामान्य सूत्र से प्रकट किए जा सकने वाले यौगिकों के समूहों में बांटा जा सकता है। ऐसे प्रत्येक समूह को सजातीय श्रेणी कहते हैं। इस श्रेणी में रखे गए निकटतम दो सदस्यों के आण्विक सूत्रों में (-CH2) ग्रुप का अंतर होता है। एक समजातीय श्रेणी के प्रत्येक सदस्यों को समजात कहते हैं। एक ही समजातीय श्रेणी के सभी सदस्यों को समान विधियों द्वारा प्राप्त किया जा सकता है।
समजातीय श्रृंखला के गुण-
(1) किसी भी समजातीय श्रृंखला के सदस्यों को एक सी विधि द्वारा तैयार किया जा सकता है।
(2) समजातीय श्रृंखला के सभी सदस्यों के रासायनिक गुण एक समान होते हैं तथा भौतिक गुणों में अणुभार बढ़ने के साथ-साथ क्रमिक परिवर्तन होता है।
उदाहरण-एल्केन की समजातीय श्रेणी अग्र है-
सामान्य सूत्र : CnH2n+2
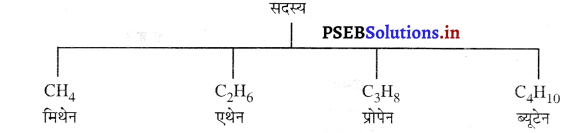
(b) मिथेन के प्रथम तीन सजातीय सदस्य
(i) एथेन (C2H6)
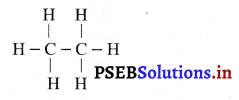
(ii) प्रोपेन (C3H8)
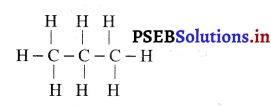
(iii) ब्यूटेन (C4H20)
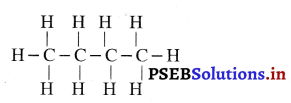
प्रश्न 13.
समजातीय श्रेणी के लक्षण लिखो।
उत्तर-
समजातीय श्रेणी के लक्षण-
- किसी भी सजातीय श्रेणी के सभी सदस्यों को एक सामान्य सूत्र के द्वारा प्रकट किया जा सकता है। जैसे एल्केन समजातीय श्रेणी के सभी सदस्यों को एक ही सामान्य सूत्र CnH2n+2. द्वारा प्रकट किया जाता है।
- किसी भी समजातीय श्रेणी के दो साथ-साथ वाले सदस्यों में (-CH2) ग्रुप का अंतर होता है।
- किसी भी समजातीय श्रेणी के सभी सदस्य एक जैसे रासायनिक गुण प्रकट करते हैं।
- किसी भी समजातीय श्रेणी के सदस्यों के भौतिक गुणों में अणु भार बढ़ने के साथ-साथ क्रमिक परिवर्तन होता है।
- किसी भी समजातीय श्रेणी के सदस्यों को एक सी विधियों द्वारा तैयार किया जा सकता है।
प्रश्न 14.
कभी-कभी केरोसीन स्टोव और एल० पी० जी० चूल्हे भी जलते समय बर्तनों को काला करते हैं ? क्यों? इससे वायु प्रदूषण किस प्रकार होता है?
उत्तर-
जब कभी केरोसीन स्टोव और एल० पी० जी० चूल्हे जलते समय बर्तनों को काला करें तब समझ जाना चाहिए कि वायु के लिए बने स्टोव छिद्र किसी कारण अवरुद्ध हो गए हैं। पर्याप्त मात्रा में ऑक्सीजन की उपस्थिति में स्वच्छ नीली ज्वाला उत्पन्न होती है लेकिन जब ईंधन को जलने के लिए वायु की आवश्यक मात्रा नहीं मिलती तब ईंधन व्यर्थ खर्च होने लगता है ; काला धुआँ उत्पन्न होता है जिस से बर्तनों के तले काले होने लगते हैं और वायु प्रदूषित होती है।
प्रश्न 15.
सजीव प्राणियों पर एथेनॉल का सेवन सीधे रूप से क्या-क्या प्रभाव डालता है ?
उत्तर-
- एथेनॉल के सेवन से उपापचयी प्रक्रिया धीमी हो जाती है।
- केंद्रीय तंत्रिका तंत्र कमजोर हो जाता है।
- समन्वय की कमी हो जाने के कारण मानसिक दुविधा, उनींदापन और अंतर्बोध में कमी उत्पन्न हो जाती है।
- सोचने-समझने की क्षमता कम हो जाती है।
- माँसपेशियाँ प्रभावित हो जाती हैं।
प्रश्न 16.
मेथेनॉल के प्रयोग से कोई भी व्यक्ति किस प्रकार प्रभावित होता है ?
अथवा
एथानोल पीने से हमारे स्वास्थ्य पर क्या प्रभाव पड़ता है ?
उत्तर-
इथानोल का स्वास्थ्य पर प्रभाव –
- इसके पीने से दिल की पेशियाँ खराब हो जाती हैं।
- इससे जिगर का आकार बढ़ जाता है।
- इसके अधिक सेवन से जिगर के फेल होने से मृत्यु भी हो सकती है।
- इसके अधिक सेवन से दिल पर बुरा प्रभाव पड़ता है।
- इसके अधिक सेवन से व्यक्ति शराबी हो जाता है, जुबान तुतलाने लगती है तथा निर्णय लेने की क्षमता में भी अधिक समय लगता है।
प्रश्न 17.
एक कार्बनिक यौगिक ‘A’ का अणुसूत्र C2H6O है। गर्म उत्प्रेरक ताँबे की उपस्थिति में वायु में उपचयन द्वारा यह CH3COOH में उपचयित हो जाता है। यौगिक ‘A’ क्या है ?
उत्तर-
यौगिक ‘A’ उपचयन द्वारा ऐसीटिक एसिड, CH3COOH बनाता है चूँकि एसिड, ऐल्कोहॉल या एक एल्डिहाइड के उपचयन से बनता है। अतः यौगिक ‘A’ एक ऐल्कोहॉल (एथिल ऐल्कोहॉल) या एस्टिएल्डिहाइड होना चाहिए क्योंकि इसके अणु में दो कार्बन परमाणु होते हैं। एथिल ऐल्कोहॉल CH3CH2OH या C2H5OH होता है तथा एस्टिएल्डिहाइड CH3CHO या C2H4O होता है। इसलिए यौगिक ‘A’ केवल एथिल ऐल्कोहॉल ही है।
प्रश्न 18.
मिसेल निर्माण क्यों होता है जब साबुन को जल में मिलाया जाता है ?
उत्तर-
जब साबन को जल में मिलाया जाता है, मिसेल निर्माण होता है क्योंकि साबन अणुओं को हाइड्रोकार्बन श्रृंखलाएँ जल-विरोधी (जल-विकर्षक) होती हैं जो जल में अविलेय हैं परंतु साबुन अणुओं के आयनिक सिरे जलरागी (जल-आकर्षक) होते हैं और इस कारण जल में विलेय होते हैं। साबुन मिसेल में, हाइड्रोकार्बन, श्रृंखला के अनावेशित सिरे अंदर की ओर होते हैं जबकि आवेशित आयनिक सिरे बाहर की ओर होते हैं।
![]()
प्रश्न 19.
कारण सहित समझाइए कि क्यों साबुन कठोर जल में शोधन अभिकर्मक का कार्य प्रभावी रूप से संपन्न नहीं करता है ?
उत्तर-
साबुन कठोर पानी में सफ़ाई करने में प्रभावी नहीं होते क्योंकि कठोर पानी में कैल्सियम और मैग्नीशियम के लवण घुले होते हैं। जब साबुन को कठोर पानी में डाला जाता है तब कठोर पानी में कैल्सियम और मैग्नीशियम आयन साबुन से क्रिया करते हैं और वसीय अम्लों के कैल्सियम और मैग्नीशियम लवणों को बनाते हैं –

यदि कठोर पानी का प्रयोग किया जाए तो साबुन का बहुत बड़ा भाग व्यर्थ हो जाता है।
स्पष्ट ही कठोर पानी के प्रयोग से साबुन, कैल्सियम और मैग्नीशियम लवणों के अघुलनशील तलछट तैयार करते हैं जो कपड़ों से चिपके रहते हैं। ये कपड़े की सफ़ाई करने में बाधा बनते हैं और कपड़े पूरी तरह से साफ़ नहीं हो पाते।
प्रश्न 20.
साबुन और अपमार्जकों मे अंतर लिखिए।
उत्तर-
साबुन और अपमार्जक में अंतर
| साबुन (Soap) | अपमार्जकों (Detergent) |
| (1) साबुन लंबी शृंखला वाले वसा अम्लों का सोडियम लवण होता है। | (1) संश्लिष्ट अपमार्जक, लंबी श्रृंखला वाले ‘बेंजीन, सल्फोनिक अम्ल का सोडियम लवण’ या लंबी श्रेणी वाले ‘एल्काइल हाइड्रोजन सल्फेट का सोडियम लवण’ होता है। |
| (2) साबन कठोर जल के साथ झाग उत्पन्न नहीं करता। | (2) अपमार्जक कठोर जल के साथ भी झागं उत्पन्न करता है। |
| (3) साबुन को वनस्पति तेल या जंतु वसा से बनाया जाता है। | (3) संश्लिष्ट अपमार्जक कोयले तथा पेट्रोलियम के हाइड्रोकार्बन से बनते हैं। |
| (4) साबुन जल प्रदूषण नहीं फैलाता। | (4) अपमार्जक जल प्रदूषण फैलाता है। |
 |
 |
प्रश्न 21.
किण्वन प्रक्रम द्वारा एथॉनॉल के विरचन का वर्णन कीजिए।
उत्तर-
साधारण ताप पर किसी जैव-रासायनिक उत्प्रेरक की उपस्थिति में किण्वन क्रिया की जाती है जिसमें शर्करा अणुओं का ऐल्कोहॉल और कार्बन डाइऑक्साइड में परिवर्तन होता है। ये उत्प्रेरक ‘एंजाइम’ कहलाते हैं, जिनका शाब्दिक अर्थ ‘यीस्ट’ या ‘खमीर के अंदर’ होता है। ऐथनॉल को एंजाइमों की उपस्थिति में शक्कर या स्टार्च के किण्वन द्वारा बनाया जाता है। किसी पात्र में अंगूर के रस या शर्करा के विलयन में खमीर डाल कर इसे 20°-30°C ताप पर रखा जाता है। किण्वन द्वारा शक्कर या स्टार्च के अणु छोटे अणुओं में टूट जाते हैं जिससे कार्बन डाइऑक्साइड गैस उत्पन्न होती है। इस कार्बन डाइऑक्साइड को बाहर निकलने दिया जाता है परंतु वायु को पात्र में नहीं जाने दिया जाता। इस किण्वन प्रक्रिया के दौरान एथेनॉल का जल में तनु घोल बन जाता है। ऐथेनॉल को पृथक् करके आसवन विधि द्वारा शुद्ध किया जाता है।
रासायनिक अभिक्रिया

प्रश्न 22.
हाइड्रोजन अणु में बने आबंध को प्रदर्शन करें।
उत्तर-
हाइड्रोजन अणु में बने आबंध का प्रदर्शन-हाइड्रोजन परमाणु का परमाणु क्रमांक एक है। इसलिए इसके K कक्ष में एक इलैक्ट्रॉन है तथा इस K कक्ष को पूरा करने के लिए एक अतिरिक्त इलैक्ट्रॉन की आवश्यकता होती है। हाइड्रोजन के दो परमाणु परस्पर 1-1 इलैक्ट्रॉन सांझा करके हाइड्रोजन अणु (H2) बनाते हैं। इसके परिणामस्वरूप प्रत्येक हाइड्रोजन परमाणु निकटतम हीलियम गैस का इलैक्ट्रॉनिक विन्यास प्राप्त कर लेते हैं जिससे दोनों परमाणुओं के K कक्ष में 2-2 इलैक्ट्रॉन हो जाते हैं। इस प्रकार इन सांझा किये गए इलैक्ट्रॉन युग्म से दो परमाणुओं के मध्य एकल सहसंयोजक आबंध बनता है।

प्रश्न 23.
ऑक्सीजन के अणु में बनने वाले सहसंयोजक आबंध को समझाओ तथा चित्र द्वारा इसका प्रदर्शन करो।
उत्तर-
ऑक्सीजन के अणु में बने सहसंयोजक आबंध की जानकारी तथा प्रदर्शन-ऑक्सीजन का परमाणु अंक 6 है। इसके परमाणु के L कक्ष में 6 इलैक्ट्रॉन होते हैं तथा इसे अपना अष्टक पूरा करने के लिए दो अन्य इलैक्ट्रॉनों की आवश्यकता होती है। इसलिए ऑक्सीजन के प्रत्येक परमाणु 2 इलैक्ट्रॉन दूसरे परमाणु के साथ 2 इलैक्ट्रॉनों की साझेदारी करता है। इस प्रकार ऑक्सीजन के दो परमाणुओं के मध्य 2 युग्म इलैक्ट्रॉनों की साझेदारी से दोहरा सहसंयोजक आबंध बनता है।
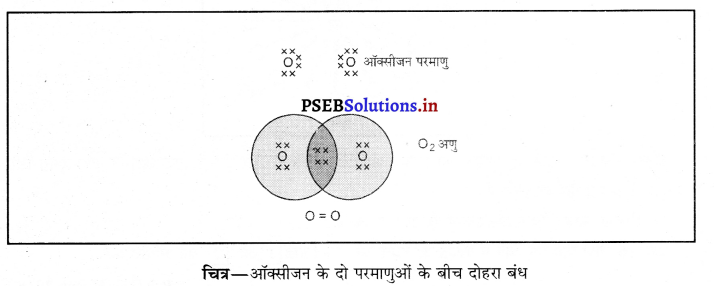
प्रश्न 24.
नाइट्रोजन के अणु में किस प्रकार का आबंध बनता है ? चित्र बनाकर समझाइए।
उत्तर-
नाइट्रोजन के अणु में सहसंयोजक आबंध का बनना-नाइट्रोजन के अणु में दो नाइट्रोजन परमाणु होते हैं। नाइट्रोजन परमाणु का परमाणु क्रमांक 7 है तथा इसके अंतिम कक्ष L में 5 इलैक्ट्रॉन होते हैं। नाइट्रोजन के अणु के प्रत्येक परमाणु को अष्टक पूरा करने के लिए 3 इलैक्ट्रॉन की आवश्यकता होती है। प्रत्येक परमाणु 3-3 इलैक्ट्रॉन सांझा करता है। इस प्रकार सांझा किये गए तीन युग्म इलैक्ट्रॉनों से सहसंयोजक त्रि-आबंध का निर्माण होता है। N, की इलैक्ट्रॉन बिंदु संरचना तथा सहसंयोजक त्रि-आबंध का प्रदर्शन चित्र में किया गया है।
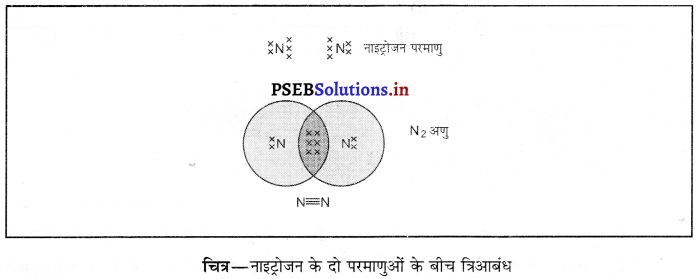
![]()
प्रश्न 25.
चित्र में दर्शाई रचना को क्या कहा जाता है ? इसके दो सिरे क्या दर्शाते हैं ? यह रचना किस क्रिया में बनती है ?
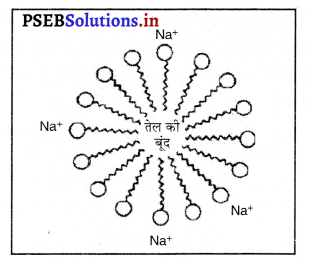
उत्तर-
चित्र में दर्शाई गई संरचना को मिसेल कहते हैं। इसके दो सिरे होते हैं, एक जलरागी तथा दूसरा सिरा जलविरागी अथवा पूँछ कहलाता है। यह संरचना, साबुन द्वारा सफाईकरण क्रिया में बनती है।
प्रश्न 26.
नीचे दिए गए चित्र में दर्शाई गई रचना का नाम लिखें 1 और 2 को अंकित करें।
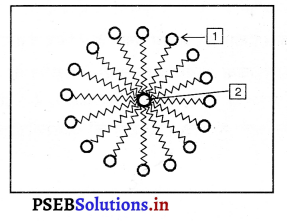
उत्तर-
चित्र में दशाई गई रचना मिसैल कहलाती है।
1 जलस्नेही सिरा (हाइड्रोफिलिक सिरा)
2 जल-विरोधी सिरा (हाइड्रोफोबिक सिरा)
प्रश्न 27.
(i) प्रोपेन का आणविक सूत्र लिखें ।

उत्तर-
(i) प्रोपेन का आणविक सूत्र : C3H8
(ii) ब्रोमो-एथेन।
प्रश्न 28.
नीचे दिए गए चित्र में दर्शाए गए यौगिक का नाम लिखो। इस यौगिक में कितने इकहरे (Single) सहसंयोजी बन्ध हैं ? यह यौगिक किस कार्बनिक श्रृंखला का है ?
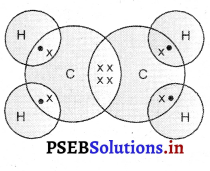
उत्तर-
यौगिक नाम : ईथीन ईथीन में चार इकहरे सहसंयोजी आबंध होते हैं। इसके कार्बन परमाणुओं के मध्य दोहरा आबंध होने के कारण यह असंतृप्त कार्बन श्रृंखला का यौगिक है।
प्रश्न 29.
(i) ब्यूटेन का आणविक सूत्र लिखो।
(ii) प्रोपेनल की संरचना का रेखा चित्र बनाओ।
उत्तर-
(i) ब्यूटेन का आणविक सूत्र- C4H10
(ii) प्रोपेनल की संरचना का रेखा चित्र
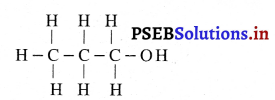
अति लघु उत्तरात्मक प्रश्न (Very Short Answer Type Questions)
प्रश्न 1.
कार्बन के सबसे बाहरी कक्ष में कितने इलेक्ट्रॉन होते हैं ?
उत्तर-
चार।
प्रश्न 2.
कार्बन को चार इलेक्ट्रॉन प्राप्त करने या कम करने की आवश्यकता क्यों होती है ?
उत्तर-
नोबल गैस की संरचना को प्राप्त करने के लिए।
प्रश्न 3.
इलेक्ट्रॉन के सहभाजी युगल हाइड्रोजन के दो परमाणुओं के बीच कौन-सा बंध बनाते हैं ?
उत्तर-
एकल बंध।
प्रश्न 4.
नाइट्रोजन की परमाणु संख्या कितनी होती है ?
उत्तर-
सात।
![]()
प्रश्न 5.
अष्टक बनाने के लिए नाइट्रोजन का प्रत्येक परमाणु कितने इलेक्ट्रॉन देता है ?
उत्तर-
तीन।
प्रश्न 6.
ईंधन के रूप में किस गैस का सबसे अधिक उपयोग होता है ?
उत्तर-
मिथेन गैस का।
प्रश्न 7.
मिथेन किन दो गैसीय ईंधन का प्रमुख घटक है ?
उत्तर-
- बायोगैस
- सी० एन० जी० ।
प्रश्न 8.
CNG का पूरा नाम लिखिए।
उत्तर-
कंप्रेस्ड नेचुरल गैस (संपीड़ित प्राकृतिक गैस) ।
प्रश्न 9.
हीरे की संरचना कैसी होती है ?
उत्तर-
प्रबल त्रिविमीय संरचना।
प्रश्न 10.
ग्रेफाइट की संरचना कैसी होती है ?
उत्तर-
षट्कोणीय।
प्रश्न 11.
विद्युत् का सुचालक कौन है-हीरा या ग्रेफाइट ?
उत्तर-
ग्रेफाइट।
प्रश्न 12.
ग्रेफाइट छूने में कैसा प्रतीत होता है ?
उत्तर-
चिकना तथा सर्पशशील।
प्रश्न 13.
किस तत्व में बड़ी मात्रा में यौगिक तैयार करने का गुण विद्यमान है ?
उत्तर-
कार्बन।
प्रश्न 14.
हाइड्रोकार्बन का सरलतम रूप कौन-सा है ?
उत्तर-
मिथेन (CH4 )।
![]()
प्रश्न 15.
किन्हीं पांच तत्वों के नाम लिखिए जो कार्बन के साथ मिलकर यौगिक बनाते हैं।
उत्तर-
ऑक्सीजन, हाइड्रोजन, नाइट्रोजन, सल्फर, क्लोरीन।
प्रश्न 16.
एथेन का आण्विक सूत्र लिखिए।
उत्तर-
C2H6.
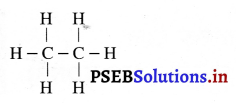
प्रश्न 17.
एथेन का संरचनात्मक सूत्र लिखिए।
उत्तर
प्रश्न 18.
निम्नलिखित के अगले उच्च समाजात लिखिए :
(i) C3H6
(ii) C6 H8
उत्तर-
(i) C4 H8
(ii) C7 H10 .
प्रश्न 19.
ऐथनॉल की संरचना लिखिए।
उत्तर-
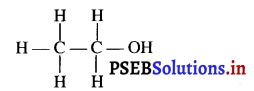
प्रश्न 20.
प्रोपेनॉन (CH3COCH3) में उपस्थिति क्रियात्मक संग्रह का नाम लिखिए।
उत्तर-

प्रश्न 21.
सरलतम कीटोन की संरचना बनाइए।
उत्तर-
रलतम कीटोन ऐसीटोन है। इसकी संरचना है :
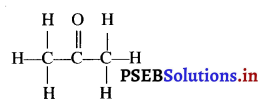
प्रश्न 22.
चार कार्बन परमाणुओं वाले ऐल्डिहाइड की संरचना और नाम लिखिए।
उत्तर-
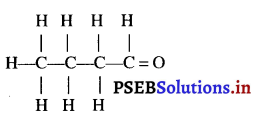
![]()
प्रश्न 23.
एथाइल ऐल्कोहॉल (C2H5OH) की संरचना लिखिए।
उत्तर-
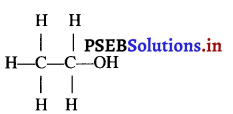
प्रश्न 24.
CH3COOH यौगिक में उपस्थित प्रकार्यात्मक समूह का
(i) नाम तथा
(ii) संरचना सूत्र लिखिए।
उत्तर-
(i) कार्बोक्सिलिक समूह
(ii) संरचना सूत्र :
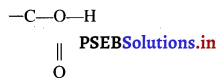
प्रश्न 25.
निम्न में से कौन-से दो यौगिक एक सजातीय श्रेणी से संबंध रखते हैं ? C2H6O2, C2H6O2, C2H6CH4O.
उत्तर-
C2H6O (C2H5OH) और CH4O(CH2OH).
प्रश्न 26.
एक एस्टर का संरचनात्मक सूत्र लिखो।। उस अम्ल और एल्कोहॉल का आणविक सूत्र लिखो जिससे यह उत्पन्न हुआ है।
उत्तर-
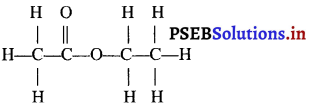

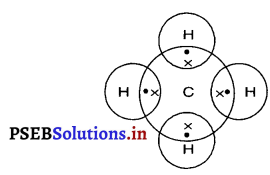
प्रश्न 27.
मिथेन की इलैक्ट्रॉन-बिंदु संरचना बनाइए।
उत्तर-
प्रश्न 28.
सहसंयोजी आबंध क्या होते हैं ?
उत्तर-
सहसंयोजी आबंध-दो परमाणुओं के मध्य एक इलैक्ट्रॉन युग्म की सांझेदारी से बने आबंध को सहसंयोजी आबंध कहते हैं।
प्रश्न 29.
सहसंयोजक यौगिक विद्युत् के दुर्बल चालक क्यों होते हैं ?
उत्तर–
क्योंकि इनमें आयन या मुक्त इलैक्ट्रॉन नहीं होते हैं जो विद्युत् चालन के लिए आवश्यक है।
प्रश्न 30.
अपररूप क्या होते हैं ?
उत्तर-
अपररूप- जब एक तत्त्व दो या अधिक रूपों में पाया जाता है जिसके भौतिक गुण भिन्न-भिन्न हों परंतु रासायनिक गुण एक समान हों तब तत्त्व के ये रूप उस तत्त्व के अपररूप होते हैं।
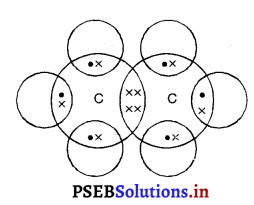
प्रश्न 31.
एथेन की इलैक्ट्रॉन-बिंदु संरचना बनाइए।
उत्तर-
एथेन की इलैक्ट्रॉन-बिंदु संरचना
प्रश्न 32.
प्रोपेन की संरचना बनाइए।
उत्तर-
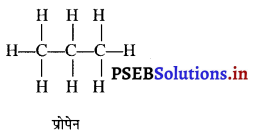
प्रश्न 33.
एथीन की इलैक्ट्रॉन-बिंदु संरचना बनाइए।
उत्तर-
एथीन की इलैक्ट्रॉन-बिंदु संरचना
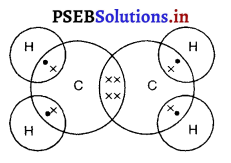
![]()
प्रश्न 34.
क्रियात्मक समूह किसे कहते हैं ?
उत्तर-
क्रियात्मक समूह (Functional Group)-एक या एक से अधिक परमाणुओं का वह समूह जो किसी कार्बनिक यौगिक की रासायनिक प्रवृत्ति को निर्धारित करता है, क्रियात्मक समूह कहलाता है। जैसे CH3Cl में -Cl तथा C2H5 OH में –OH क्रियात्मक समूह है।
प्रश्न 35.
एलकेन, एलकीन तथा एलकाइन के सामान्य सूत्र लिखिए।
उत्तर-
एलकेन का सामान्य सूत्र : Cn H2n+2
एलकीन का सामान्य सूत्र : CnH2n
एलकाइन का सामान्य सूत्र : CnH2n-2
जहाँ n यौगिक में कार्बन के परमाणुओं की संख्या है।
प्रश्न 36.
ब्यूटेन के समावयवों का चित्रण करें।
उत्तर-
ब्यूटेन के दो समावयव हैं :
(i) n – ब्यूटेन तथा
(ii) आइसो-ब्यूटेन
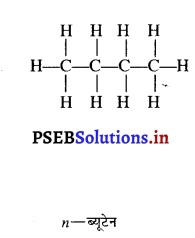
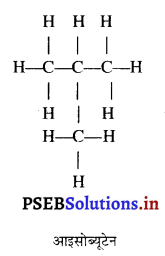
प्रश्न 37.
एल्कोहॉल समजातीय श्रेणी के प्रथम चार समजात लिखिए।
उत्तर-
CH3OH, C2H5OH, C3HOH, C4H9OH
प्रश्न 38.
उत्प्रेरक क्या है ?
उत्तर-
उत्प्रेरक-वे पदार्थ जो किसी अभिक्रिया के होने की दर बढ़ाने के लिए कारक होता है परंतु इनकी स्वयं की उपस्थिति से स्वयं पर कोई प्रभाव नहीं पड़ता है।
प्रश्न 39.
विकृतित स्पिरिट या ऐल्कोहॉल क्या है ?
उत्तर-
विषाक्त रसायन जैसे मैथेनॉल या ऐसीटोन या पिरीडीन या कॉपर सल्फेट मिले हुए एथेनॉल को विकृतित स्पिरिट अथवा ऐल्कोहॉल कहते हैं। यह पीने योग्य नहीं होता है।
प्रश्न 40.
हाइड्रोजन का परमाणु क्रमांक क्या है ?
उत्तर-
एक।
प्रश्न 41.
सिरके में उपस्थित कार्बनिक अम्ल का नाम व रासायनिक सूत्र लिखिए।
उत्तर-
एथेनॉइक अम्ल (CH3COOH)।
वस्तुनिष्ठ प्रश्न (Objective Type Questions)
बहु-विकल्पीय प्रश्न
प्रश्न 1.
एसिटिक अम्ल की एल्कोहल के साथ क्रिया को कहते हैं
(a) विकार्बोक्सिलकरण
(b) बहुलीकरण
(c) साबुनीकरण
(d) एस्टरीकरण।
उत्तर-
(d) एस्टरीकरण।
प्रश्न 2.
एसिटिक एसिड में कितने प्रतिशत जल सिरका कहलाता है ?
(a) 5% – 8%
(b) 15% – 20%
(c) 21% – 29%
(d) 30% – 40%.
उत्तर-
(a) 5% – 8%.
प्रश्न 3.
कार्बोक्सिलिक अम्लों में क्रियात्मक समूह होता है –
(a) –CHO
(b) – CH2OH
(c) –COOH
(d) –OH.
उत्तर-
(c) – COOH.
![]()
प्रश्न 4.
एथेनॉइक अम्ल का सूत्र है –
(a) C2H5OH
(b) CH3COCH3
(c) CH3COOH
(d) C2H5COOH.
उत्तर-
(d) C2H5COOH.
प्रश्न 5. ऐल्काइन का सामान्य सूत्र है –
(a) CnH2n – 2
(b) CnH2n + 2
(c) CnH2n
(d) Cn + 22n.
उत्तर-
(a) CnH2n – 2
प्रश्न 6.
प्रोपेनोन में क्रियात्मक समूह है –
(a) –OH
(6) CHO
(c) C = O
(d) -COOH.
उत्तर-
(c) C = O.
प्रश्न 7.
जल की कठोरता के लिए कौन-से आयन उत्तरदायी होते हैं ?
(a) Ca2+ आयन
(b) Mg2+ आयन
(c) Ca2+ और Mg2+ आयन
(d) Ca + 2 और Mg2+ आयन में से कोई नहीं।
उत्तर-
(c) Ca2+ और Mg2+ आयन।
रिक्त स्थानों की पूर्ति कीजिए
(i) परमाणु या परमाणुओं का समूह जो किसी ऐल्किल मूलक के साथ जुड़कर उस पदार्थ के विशिष्ट व्यवहार को दर्शाता है, उसे ………………………. कहते हैं।
उत्तर-
क्रियात्मक समूह
(ii) एल्कोहल प्रबल आक्सीकारकों की उपस्थिति में ऑक्सीकरण होने पर …………………….. बनता है।
उत्तर-
कार्बोक्सिलिक अम्ल
(iii) ……………………. का उपयोग चिकित्सा क्षेत्र में कीटाणुनाशक के रूप में किया जाता है।
उत्तर-
एथेनॉल
(iv) जलरहित शुद्ध एथेनॉइक अम्ल ………………………….. अम्ल कहलाता है।
उत्तर-
ग्लैशल ऐसीटिक
![]()
(v) …………………… विघटित न होने के कारण मानव जीवन तथा पारिस्थितिक तंत्र को प्रभावित करता है।
उत्तर-
पॉलीथीन।
