Punjab State Board PSEB 9th Class Science Important Questions Chapter 4 परमाणु की संरचना Important Questions and Answers.
PSEB 9th Class Science Important Questions Chapter 4 परमाणु की संरचना
दीर्घ उत्तरात्मक प्रश्न (Long Answer Type Questions)
प्रश्न 1.
परमाणु के नाभिक से क्या अभिप्राय है ? नाभिक की खोज करने के लिए रदरफोर्ड द्वारा किए गए अल्फा-किरण प्रकीर्णन प्रयोग की संक्षिप्त में विवेचना कीजिए। इस प्रयोग के परिणामों तथा त्रुटियों को भी लिखिए।
उत्तर-
नाभिक (Nucleus)- रदरफोर्ड तथा सहयोगियों द्वारा किए गए अल्फा कण प्रकीर्णन प्रयोग (Alpha particle scattering experiment) से गहन द्रव्यमान वाले नाभिक के अस्तित्व के बारे संकेत मिला। परमाणु के सघन तथा धन आवेशित भाग को नाभिक कहा जाता है। इस पर उपस्थित धन आवेश, इलेक्ट्रॉनों के ऋण आवेश के बराबर होने के कारण परमाणु उदासीन होता है।
परमाणु के आयतन की तुलना में नाभिक का आयतन बहुत ही कम होता है। नाभिक में प्रोटॉन तथा न्यूट्रॉन होते हैं। परमाणु का द्रव्यमान प्रोटॉन तथा न्यूट्रॉन के कारण होता है क्योंकि इलैक्ट्रॉन का द्रव्यमान नाममात्र होता है। __रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग- रदरफोर्ड ने सन् 1911 में अल्फा कण प्रकीर्णन प्रयोग द्वारा नाभिक की खोज की थी। इस प्रयोग में उसने एक सोने की बारीक 1000 परमाणुओं के बराबर मोटी पन्नी पर तीव्र गति वाले अल्फा कणों की बमबारी की।
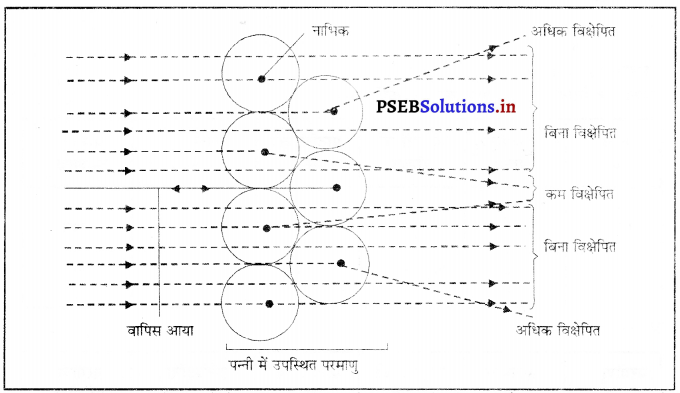
सोने की पतली पन्नी से टकराने के उपरान्त एल्फा कणों का प्रकीर्णन हो जाता है अर्थात् वे बिखर जाते हैं। अधिकांश कण सोने के पत्र को पार कर जाते हैं परंतु कुछ कण परमाणु नाभिक के टकराने के बाद उसी दिशा में वापिस लौट आते हैं।
प्रयोग के प्रेक्षण-प्रयोग के परिणामस्वरूप रदरफोर्ड ने निम्नलिखित प्रेक्षण प्रस्तुत किए-
- बहुत से α-कण (लगभग 99%) सोने की पन्नी में से बिना किसी परावर्तन के गुज़र जाते हैं।
- कुछ कण विभिन्न कोणों पर विक्षेपित होते हैं।
- बहुत ही अल्प संख्या में कण (10,000 में से एक) केंद्रीय भाग से टकराकर अपने पथ पर फिर लौट आते है।
प्रयोग से परिणाम – ऐसे प्रयोगों की श्रृंखला से रदरफोर्ड ने निम्नलिखित परिणाम प्रस्तुत किए-
- क्योंकि शीट में से बहुत-से कण बिना परावर्तित हुए गुज़र जाते हैं, इससे सिद्ध होता है कि परमाणु में अधिकतर स्थान खाली है।
- धन आवेशित कुछ α-कण (He2+) अपने पथ से परावर्तित होते हैं, अर्थात् मुड़ जाते हैं। इससे यह निर्णय लिया जा सकता है कि परमाणु का कुछ भाग धन आवेशित तथा द्रव्यमान युक्त है।
- कुछ α-कण वापिस लौट आए। इसी से नाभिक की स्थिति का पता लगता है।
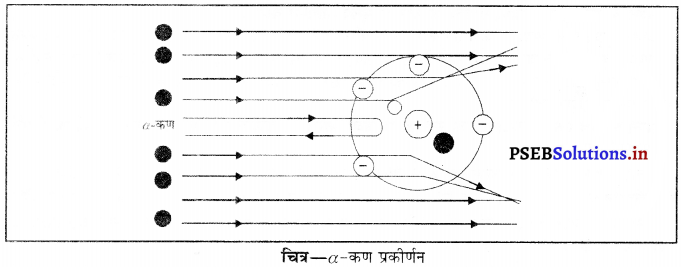
त्रुटियां – यह परमाणु की स्थिरता के विषय में कुछ व्यक्त नहीं करता। नाभिक के चारों ओर इलैक्ट्रॉन वृत्तीय चक्कर लगाते हैं जिसका परिणाम उनकी तेज़ गति होती है। इस कारण आवेशित कणों से विकिरित ऊर्जा परमाणु को अस्थिर कर देगी। पर यह सत्य नहीं है जबकि परमाणु तो वास्तव में निश्चित संरचना के साथ स्थिर होता है।
![]()
लघु उत्तरात्मक प्रश्न (Short Answer Type Questions)
प्रश्न 1.
रदरफोर्ड के परमाणु मॉडल के आधार स्पष्ट कीजिए।
उत्तर-
रदरफोर्ड के परमाणु मॉडल के निम्नलिखित मुख्य बिंदु थे-
- परमाणु का केंद्र धनावेशित होता है जिसे नाभिक कहते हैं। परमाणु का लगभग संपूर्ण द्रव्यमान नाभिक में होता है।
- नाभिक के चारों ओर इलेक्ट्रॉन निश्चित कक्षाओं में चक्कर लगाते हैं जैसे सूर्य के चारों ओर विभिन्न नक्षत्र चक्कर लगाते हैं।
- नाभिक का आकार परमाणु के आकार की तुलना में बहुत कम होता है।
प्रश्न 2.
रदरफोर्ड को कैसे विश्वास हुआ कि परमाणु के नाभिक में प्रोटॉन होते हैं ?
उत्तर-
ऐसा α-किरणों के प्रकीर्णन प्रयोग द्वारा पता चला कि बहुत कम α-कण (लगभग 10,000 में से एक) उसी दिशा में वापिस हो जाते हैं। क्योंकि α-कण नाभिक द्वारा अपकर्षित किए जाते हैं, इसलिए ऐसे कणों पर अवश्य ही धन आवेश होगा। उस समय तक ज्ञात अवपरमाणुक कणों-इलैक्ट्रॉनों और प्रोटॉनों में से केवल प्रोटॉन पर धन आवेश था। इसलिए ही तत्व के परमाणु के नाभिक में प्रोटॉन विद्यमान हैं, जोकि α-कणों को अपकर्षित करते हैं।
प्रश्न 3.
रदरफोर्ड ने इस तथ्य के लिए क्या कारण बताया था कि परमाणु के इलैक्ट्रॉन नाभिक के अंदर की ओर अपकर्षित नहीं होते ?
उत्तर-
रदरफोर्ड के अनुसार परमाणु के बाह्य नाभिकीय भाग में इलेक्ट्रॉन स्थिर नहीं है। ये शैल (Shell) नामक वृत्ताकार परिपथों में चक्कर लगाते हैं। बाह्य नाभिकीय भाग में स्थित इलेक्ट्रॉन नाभिक की ओर आकर्षित होते हैं। इस आकर्षण बल को इससे विपरीत दिशा में क्रियाशील केंद्रीय बल संतुलित कर देता है। इसलिए इलेक्ट्रॉन निश्चित परिपथों में निरंतर घूमते रहते हैं तथा नाभिक के अंदर की ओर आकर्षित नहीं होते।
प्रश्न 4.
नाभिकीय आकार की तुलना में परमाणु के आकार का परिमाण बताइए।
उत्तर-
परमाणु की त्रिज्या नाभिक की त्रिज्या से 1015 गुणा बड़ी है।

प्रश्न 5.
रदरफोर्ड परमाणु मॉडल के बारे में मुख्य आपत्ति क्या थी ?
उत्तर-
इलैक्ट्रॉन आवेशित कण हैं। कोई भी आवेशित कण जब त्वरित किया जाता है तो ऊर्जा विकरित करता है। नाभिक के गिर्द चक्राकार गति में रहने के लिए इलेक्ट्रॉन को त्वरित होना पड़ेगा जिसके फलस्वरूप वह ऊर्जा का विकिरण करेगा। ऊर्जा की हानि के कारण कक्षा का आकार सिकुड़ेगा और अंत में नाभिक को टकराएगा। इसलिए ऐसा मॉडल स्थिरता प्रदान नहीं करेगा।
![]()
प्रश्न 6.
जब एक इलैक्ट्रॉन ऊर्जा स्तर K से ऊर्जा स्तर L में छलांग लगाता है तो परमाणु की ऊर्जा क्यों बढ़ जाती है ?
उत्तर-
एक इलेक्ट्रॉन जो ऊर्जा स्तर K में चक्कर लगा रहा है उसके पास ऊर्जा की एक निश्चित मात्रा है। जब वह इलैक्ट्रॉन K ऊर्जा स्तर से L ऊर्जा स्तर में कूद जाता है तो वह L ऊर्जा स्तर की ऊजां ग्रहण कर लेता है जोकि पहले से अधिक होती है। इस प्रकार इलेक्ट्रॉन पहली ऊर्जा से अधिक ऊर्जा प्राप्त कर लेता है। इससे कुल मिला कर परमाणु की ऊर्जा में वृद्धि हो जाती है।
प्रश्न 7.
वे शैल जिनमें इलेक्ट्रॉन परमाणु के नाभिक के गिर्द चक्कर लगाते हैं ऊर्जा स्तर क्यों कहलाते हैं ?
उत्तर-
एक इलेक्ट्रॉन किसी शैल में चक्कर लगाते समय कुछ ऊर्जा की मात्रा से जुड़ा रहता है। जब यह एक शैल से दूसरे शैल में छलाँग लगाता है तो इसकी ऊर्जा में परिवर्तन आ जाता है। इस प्रकार शैल इलेक्ट्रॉन को ऊर्जा प्रदान करने के साथ-साथ स्थान भी बदलता है जिससे उन्हें ऊर्जा शैल या ऊर्जा स्तर कहा जाता है।
प्रश्न 8.
परमाणु की संरचना को समझने के लिए रदरफोर्ड का मूल योगदान क्या थे ?
अथवा
रदरफोर्ड द्वारा प्रस्तुत किए गए नाभिकीय मॉडल के लक्षण क्या थे ?
उत्तर-
परमाणु की नाभिकीय संरचना को समझने के लिए रदरफोर्ड का मूल योगदान निम्न प्रकार थे-
- परमाणु का केंद्र धन आवेशित होता है जिसे नाभिक कहा जाता है।
- एक परमाणु का संपूर्ण द्रव्यमान नाभिक में होता है।
- नाभिक का आकार परमाणु के आकार की तुलना में बहुत छोटा होता है।
- इलैक्ट्रॉन नाभिक के इर्द-गिर्द निश्चित कक्षाओं में चक्कर लगाते हैं।
प्रश्न 9.
फ्लोरीन परमाणु में 9 इलेक्ट्रॉन तथा 9 प्रोटॉन हैं। इसके परमाणु में कितने ऊर्जा शैल होंगे ?
उत्तर-
क्योंकि पहले कोश K में 2 इलेक्ट्रॉन समा सकते हैं। इसलिए शेष 7 इलैक्ट्रॉन दूसरे कोश L में समा जायेंगे जिसकी अधिकतम सामर्थ्य 8 इलेक्ट्रॉनों की है। इसलिए फ्लोरीन के दो ऊर्जा कोश होंगे।
प्रश्न 10.
मैग्नीशियम परमाणु में 12 इलेक्ट्रॉन है। इसका कौन-सा ऊर्जा कोश पूर्ण रूप से भरा हुआ नहीं
उत्तर-
मैग्नीशियम परमाणु में 12 इलेक्ट्रॉन हैं। K कोश में 2 इलेक्ट्रॉन तथा दूसरे L कोश में 8 इलेक्ट्रॉन भरे जायेंगे।
इस प्रकार K तथा L शैल पूर्ण रूप से भरे गए हैं। शेष 2 इलेक्ट्रॉन [12 – (2 + 8) = 2)] तीसरे कोश M में समाहित होंगे जबकि इस कोश में अधिकतम 18 इलेक्ट्रॉन भरे जा सकते हैं। अत: तीसरा कोश M अपूर्ण है।
प्रश्न 11.
निम्न परमाणु युग्ल की इलेक्ट्रॉनिक संरचना में क्या समानताएं हैं ? प्रत्येक परमाणु की इलैक्ट्रॉन संख्या कोष्ठक में दिये गए हैं ।
लीथियम (3), सोडियम (11) तथा पोटैशियम (19), हीलियम (2), नियॉन (10) तथा आर्गान (18), बैरीलियम (4), मैग्नीशियम (12) तथा कैल्सियम (20)।
उत्तर-
- लीथियम, सोडियम तथा पौटैशियम सभी के बाह्यतम कोश में एक इलेक्ट्रॉन है।
- हीलियम, नियॉन तथा आर्गान सभी के बाहयतम कोश में 8 इलेक्ट्रॉन हैं।
- बैरीलियम, मैग्नीशियम तथा कैल्सियम सभी के बाह्यतम कोश में 2 इलेक्ट्रॉन हैं।
![]()
प्रश्न 12.
एक तत्त्व का परमाणु रासायनिक संयोजन में भाग नहीं लेता है। क्या आप बता सकते हैं कि इस परमाणु के बाह्यतम कोश में इलेक्ट्रॉनों की संख्या कितनी है ? वर्णन करें।
उत्तर-
यह कथन दर्शाता है कि तत्व अक्रियाशील गैस है और इसके परमाणु के बाह्यतम कोश में ? या 8 इलेक्ट्रॉन हैं।
ऐसा इसलिए है कि हीलियम के बाह्यतम कोश में 2 इलेक्ट्रॉन को छोड़ कर ऐसे परमाणु जिनके बाह्यतम कोश में 8 इलेक्ट्रॉन हैं अक्रियाशील हैं और वे रासायनिक संयोजन में भाग नहीं लेते हैं।
प्रश्न 13.
एक तत्व में 16 प्रोटॉन हैं। परमाणु के K, L तथा M कोशों में कितने इलेक्ट्रॉन उपस्थित होंगे ? इसकी इलैक्ट्रॉन संयोजकता क्या होगी ?
उत्तर-
इलेक्ट्रॉनों की संख्या = प्रोटॉनों की संख्या = 16
इलेक्ट्रॉनिक संरचना = K = 2 ; L = 8 ; M = 6
तत्व में वैलेंस इलेक्ट्रॉनों की संख्या = 6
∴ इलैक्ट्रॉन संयोजकता = 8 – 6 = 2
प्रश्न 14.
यदि हम किसी परमाणु का क्रमांक जानते हैं तो उसका इलेक्ट्रॉनिक विन्यास लिखना संभव है। ऐसा क्यों है ?
उत्तर-
हां. किसी तत्व के परमाणु क्रमांक की सहायता से उसकी इलेक्ट्रॉन संरचना लिखना संभव है। वास्तव में किसी तत्व का परमाणु क्रमांक उसके परमाणु में विद्यमान प्रोटॉनों या न्यूट्रॉनों की संख्या के बराबर होता है। यदि हमें इलेक्ट्रॉनों की संख्या पता हो तो हम इलेक्ट्रॉनिक विन्यास लिख सकते हैं। इलेक्ट्रॉनिक विन्यास का अर्थ है कि विभिन्न शैलों में इलेक्ट्रॉनों का वितरण किस प्रकार है।
उदाहरण – ऑक्सीजन की परमाणु संख्या (Z) 8 है। इसका अर्थ यह है कि ऑक्सीजन में 8 इलेक्ट्रॉन हैं। इनमें से 2 पहले शैल में होते हैं जिससे वह पूरी तरह भर जाता है। शेष 6 इलेक्ट्रॉन दूसरे शैल में विद्यमान होते हैं।
ऑक्सीजन में इलेक्ट्रॉन वितरण इस प्रकार है-
पहले K-शैल में 2 इलेक्ट्रॉन
दूसरे L-शैल में 6 इलेक्ट्रॉन

प्रश्न 15.
क्या किसी परमाणु में 12 प्रोटॉन और 13 इलेक्ट्रॉन होना संभव है ? व्याख्या करें।
उत्तर-
नहीं, ऐसा संभव नहीं है। एक परमाणु विद्युतीय दृष्टि से उदासीन होना चाहिए। इसका अर्थ है कि इस पर कोई आवेश शेष नहीं रहता है। अब प्रत्येक प्रोटॉन पर इकाई धन आवेश होता है तथा प्रत्येक इलेक्ट्रॉन पर इकाई ऋण आवेश होता है। अतः एक उदासीन परमाणु में इलेक्ट्रॉनों और प्रोटॉनों की संख्या बराबर होनी चाहिए।
प्रश्न 16.
संकेत \({ }_{20}^{40} \mathrm{Ca}\) से लिखें-
(i) Ca की द्रव्यमान संख्या
(ii) Ca की परमाणु संख्या
(iii) Ca नाभिक की संरचना।
उत्तर-
(i) Cu की द्रव्यमान संख्या = 40
(ii) Ca की परमाणु संख्या = 20
(iii) Ca नाभिक की संरचना-
प्रोटॉनों की संख्या P = 20. इलेक्ट्रॉनों की संख्या = P = 20
न्यूट्रॉनों की संख्या = द्रव्यमान संख्या – प्रोटॉनों की संख्या
= 40 – 20 = 20
प्रश्न 17.
इस कथन से क्या सूचना मिलती है कि मैग्नीशियम की द्रव्यमान संख्या 24 तथा परमाणु संख्या 12 है ?
उत्तर-
मैग्नीशियम की परमाणु संख्या 12 इस ओर संकेत करती है कि इसके परमाणु के नाभिक में 12 प्रोटॉन हैं तथा इतने ही इलेक्ट्रॉन इसके बाह्य नाभिकीय भाग में हैं। द्रव्यमान संख्या 24 यह दर्शाती है कि प्रोटॉनों के साथ नाभिक में 12 न्यूट्रॉन (24-12) भी विद्यमान हैं।
![]()
प्रश्न 18.
द्रव्यमान संख्या को परिभाषित कीजिए। द्रव्यमान संख्या नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों से कैसे संबंधित है ?
उत्तर-
द्रव्यमान संख्या – किसी तत्व की द्रव्यमान संख्या उसमें उपस्थित प्रोटॉनों और न्यूट्रॉनों की संख्या के योग के बराबर होती है।
द्रव्यमान संख्या (A) = प्रोटॉनों की संख्या (P) + न्यूट्रॉनों की संख्या (N)
न्यूट्रॉनों की संख्या = द्रव्यमान संख्या – प्रोटॉनों की संख्या
= द्रव्यमान संख्या – परमाणु संख्या
= A – Z
प्रश्न 19.
जे० जे० टॉमसन के प्रसिद्ध प्रयोगों से पहले विद्युत् और चुंबकीय क्षेत्रों में कैथोड किरणों का विक्षेपण ज्ञात था, तो जे० जे० टॉमसन का मुख्य योगदान क्या था ?
उत्तर-
जे० जे० टॉमसन का योगदान यह था कि (i) उन्होंने कणों पर आवेश और उनके द्रव्यमान अनुपात का पता लगाया था।
उनके अनुसार \(\frac{e}{m}\) = 1.76 × 1011 c /kg
यहाँ e = कणों पर आवेश तथा m = द्रव्यमान है।
(ii) उन्होंने इलेक्ट्रॉन के द्रव्यमान का पता लगाया जो m = \(\frac{1.602 \times 10^{-19 \mathrm{c}}}{1.76 \times 10^{11 \mathrm{c} / \mathrm{kg}}}\)
= 9.1 × 10-31 kg = 9.1
× 10 g-28 ग्राम था। यह द्रव्यमान हाइड्रोजन के द्रव्यमान का \(\frac{1}{1837}\) भाग के समान था।
प्रश्न 20.
निम्नलिखित तत्वों के परमाणुओं में वेलैंस कोश इलेक्ट्रॉनों की संख्या कितनी है ?
(i) ऐलुमिनियम
(ii) सल्फ र
(ii) क्लोरीन
(iv) कार्बन
(v) नाइट्रोजन
(vi) पोटैशियम
(vii) ऑक्सीजन
(viii) फ्लोरीन।
उत्तर-
| क्रमांक | तत्व का नाम | वेलैंस कोश (संयोजकता) इलेक्ट्रॉन की संख्या |
| (i) | ऐलुमिनियम (A1) | 3 |
| (ii) | सल्फर (S) | 2 |
| (iii) | क्लोरीन (Cl) | 1 |
| (iv) | कार्बन (C) | 4 |
| (v) | नाइट्रोजन (N) | 3 |
| (vi) | पोटैशियम (K) | 1 |
| (vii) | ऑक्सीजन (O) | 2 |
| (viii) | फ्लू ओरीन (F) | 1 |
प्रश्न 21.
न्यूट्रॉन के अस्तित्व को किसने प्रस्तावित किया ? इस पूर्वधारणा (Assumption) का क्या आधार था ?
उत्तर-
सबसे पहले न्यूट्रॉन के अस्तित्व का विचार रदरफोर्ड ने प्रकट किया था। सन् 1920 में उसने मत प्रस्तुत किया कि नाभिक में प्रोटॉन और उसके निकट इलेक्ट्रॉन विद्युतीय आकर्षण के कारण आपस में इतने निकट हों कि उन्हें एक कण के रूप में ही माना जा सकता हो जिसमें पूरा आवेश शून्य हो गया हो। इसलिए उसने एक नये कण की संकल्पना की और उसका नाम न्यूट्रॉन रखा। तत्पश्चात् इसी संकल्पना ने आधुनिक विज्ञान की अनेक महत्त्वपूर्ण समस्याओं को हल कर दिया।
प्रश्न 22.
प्रायोगिक रूप से न्यूट्रॉन की खोज किसने की ? इस प्रयोग की आवश्यक बातें क्या थीं ?
उत्तर-
जेम्स चैडविक ने सन् 1932 में सबसे पहले न्यूट्रॉन की खोज की थी। उन्होंने पाया कि जब बैरीलियम नामक तत्व से a-किरणें टकरायी जाती हैं तो उससे एक नया कण विसर्जित होता है। यह नया कण उदासीन प्रकृति का था। जब इस कण को जिंक सल्फाइड की प्लेट से टकराया गया तो प्रकाश उत्पन्न हुआ। इसका द्रव्यमान हाइड्रोजन के द्रव्यमान के समान था।
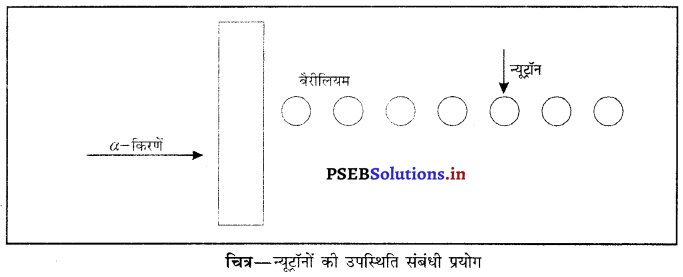
उपस्थिति संबंधी प्रयोग उन्होंने पाया कि हाइड्रोजन परमाणु के अतिरिक्त अन्य सभी तत्वों में न्यूट्रॉन थे। न्यूट्रॉन का द्रव्यमान लगभग प्रोटॉन के द्रव्यमान के समान था। प्रोटॉन का द्रव्यमान 1 a.m.u. माना जाता था। इसलिए न्यूट्रॉन का द्रव्यमान भी 1 a.m.u. है। न्यूट्रॉन आवेशित कण नहीं हैं इसलिए इनका परीक्षण आसान नहीं है परंतु 1932 ई० में चैडविक इनको प्रदर्शित करने में सफल हो गया।
‘प्रश्न 23.
हीलियम के संयोजकता कक्ष में 2 इलेक्ट्रॉन होते हैं पर उसकी संयोजकता 2 नहीं होती। क्यों ?
उत्तर-
हीलियम के संयोजकता कक्ष में 2 इलेक्ट्रॉन होते हैं पर उसकी संयोजकता 2 नहीं होती क्योंकि उसका कक्ष पूर्ण होता है। इसलिए उसकी संयोजकता शून्य है।
![]()
प्रश्न 24.
संयोजकता इलेक्ट्रॉन को परिभाषित कीजिए। यह परमाणु संरचना से कैसे सम्बन्धित है ?
उत्तर-
संयोजकता इलेक्ट्रॉन-किसी परमाणु के सबसे बाह्यतम कक्ष में उपस्थित इलेक्ट्रॉन ही संयोजकता इलेक्ट्रॉन कहलाते हैं। ये ही रासायनिक क्रियाओं में भाग लेते हैं।
संयोजकता किसी परमाणु की संरचना को प्रकट करती है। जैसे सोडियम (Na) की परमाणु संख्या 11 है। उसके इलेक्ट्रॉनिक विन्यास (K = 2, L = 8, M = 1) में सबसे बाहरी कक्ष M में एक इलेक्ट्रॉन है। इसलिए उसकी संयोजकता एक है। किसी भी तत्व के रासायनिक गुण सबसे बाहरी कक्ष में उपस्थित इलेक्ट्रॉनों की संख्या पर ही निर्भर करते हैं। परमाणु संरचना से ही संयोजकता इलेक्ट्रॉनों का पता लगता है। यह परमाणु के नाभिक के द्रव्यमान से लगभग संबंधित नहीं होते। यदि किसी परमाणु का बाह्यतम कक्ष पूर्ण रूप से भरा हुआ (8, 18, 32 इलेक्ट्रॉन) हो तो उस तत्व की संयोजकता शून्य होती है और वह निष्क्रिय होता है। विभिन्न तत्वों के परमाणुओं में बराबर इलेक्ट्रॉन होने की अवस्था में उनके रासायनिक गुण एक समान होते हैं।
प्रश्न 25.
परमाणु नाभिक के आवश्यक गुणधर्म की व्याख्या कीजिए। इन गुणधर्मों की इलैक्ट्रॉन के गुणधर्मों से तुलना कीजिए।
उत्तर-
परमाणु नाभिक ( केंद्रक) के गुणधर्म-
- परमाणु का नाभिक (केंद्रक) धन आवेश युक्त होता है।
- परमाणु का पूरा द्रव्यमान उसके नाभिक में ही स्थित होता है।
- परमाणु नाभिक का आकार परमाणु के आकार से बहुत छोटा होता है। यह परमाणु के आकार से 105 गुना छोटा होता है।
परमाणु नाभिक की त्रिज्या 10-13 10-19 होती है जबकि परमाणु की अपनी त्रिज्या 10-8 सें०मी० होती है। इसलिए परमाणु का अधिकांश भाग खाली होता है।
परमाणु नाभिक के गुणधर्मों की इलैक्ट्रॉनों के गुणधर्मों से तुलना-
- इलेक्ट्रॉनों पर ऋण आवेश होता है, जबकि नाभिक पर प्रोटॉनों के कारण धन आवेश होता है।
- इलेक्ट्रॉन केंद्रक के चारों ओर घूमते रहते हैं जबकि नाभिक परमाणु के केंद्रीय भाग में स्थित होता है।
- नाभिक का द्रव्यमान हीलियम परमाणु के बराबर होता है जबकि इलेक्ट्रॉन हाइड्रोजन परमाणु के \(\frac{1}{1840}\) भाग
के बराबर होता है।
प्रश्न 26.
इलेक्ट्रानों को नक्षत्रीय इलेक्ट्रॉन क्यों कहा जाता है ?
उत्तर-
रदरफोर्ड के परमाणु मॉडल को सौर मॉडल भी कहते हैं क्योंकि इस मॉडल में यह कल्पना की गई थी कि जिस प्रकार सूर्य के चारों ओर सभी नक्षत्र चक्कर लगाते हैं, उसी प्रकार नाभिक के चारों ओर इलेक्ट्रॉन चक्कर लगाते हैं। इसलिए परमाणु के इलेक्ट्रॉनों को नक्षत्रीय इलेक्ट्रॉन भी कहा जाता है।
प्रश्न 27.
क्या ऐसा संभव हो सकता है कि तत्व के अणु में एक इलेक्ट्रॉन और एक प्रोटॉन हो परंतु उसका कोई भी न्यूट्रॉन न हो ? यदि ऐसा है तो उस तत्व का नाम लिखिए।
उत्तर-
हाँ, ऐसा संभव है। हाइड्रोजन तत्व के अणु की स्थिति में ऐसा ही होता है जिसे \({ }_{1}^{1} \mathrm{H}\) से प्रदर्शित किया जाता है।
प्रश्न 28.
क्या 35Cl और 37Cl की संयोजकता अलग-अलग होगी ? अपने उत्तर को स्पष्ट कीजिए।
उत्तर-
नहीं, 35Cl और 37Cl की संयोजकता अलग-अलग नहीं होगी क्योंकि ये दोनों एक ही तत्व के समस्थानिक हैं।
![]()
प्रश्न 29.
चित्र द्वारा सोडियम परमाणु और सोडियम आयन में इलैक्ट्रॉन वितरण दर्शाइए और इनकी परमाणु संख्या दीजिए।
उत्तर-
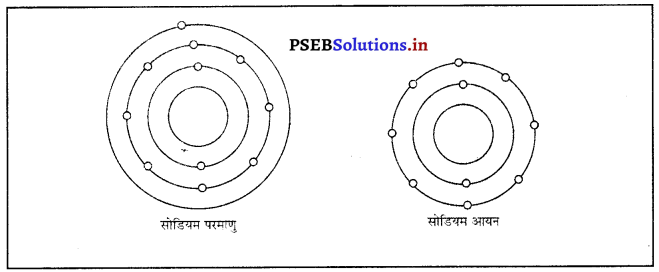
सोडियम परमाणु की परमाणु संख्या 11 है और इसमें इलेक्ट्रॉनों की संख्या भी 11 है। धनात्मक सोडियम आयन (Na+) में इलेक्ट्रॉनों की संख्या 11 – 1 = 10 होती है। इसलिए उसके इलेक्ट्रॉनिक कक्ष में इलेक्ट्रॉन वितरण 2, 8 होगा। किसी तत्व की परमाणु संख्या इसके प्रोटॉनों के बराबर होगी। इसलिए सोडियम परमाणु और सोडियम आयन में परमाणु संख्या समान ही होगी। अत: दोनों की परमाणु संख्या 11 है।
प्रश्न 30.
हीलियम, नियॉन तथा आर्गान तत्वों की संयोजकता शून्य क्यों है ?
उत्तर-
हीलियम के एकमात्र शैल K में 2 इलेक्ट्रॉन हैं। क्योंकि यह अधिकतम इलेक्ट्रॉनों की संख्या है जो K शैल में समाहित हो सकती है। इसलिए यह न तो इलेक्ट्रॉन का लाभ कर सकता है और न ही हानि । इसलिए इसकी संयोजकता शून्य है। इसी भांति नियॉन (2, 8) और आर्गान (2, 8, 8) में बाह्यतम शैल में आठ-आठ इलेक्ट्रॉन हैं जोकि अधिकतम संख्या है। इसलिए दोनों नियॉन और आर्गान की संयोजकता शून्य है।
प्रश्न 31.
एक तत्व की परमाणु संख्या 15 है। इसका क्या अभिप्राय है ? क्या यह संभव है कि एक ही परमाणु के कोश (शैल) अधिक हो सकते हैं ?
उत्तर-
जब एक परमाणु के तीन कोश हैं, इसका तात्पर्य यह है कि परमाणु में इलेक्ट्रॉन का वितरण तीन ऊर्जा स्तरों में है। इस प्रकार उत्तेजित अवस्था में उसी परमाणु के इलेक्ट्रॉन तीन से अधिक ऊर्जा स्तरों में वितरित हैं। जिससे उसी परमाणु के अधिक शैल (कोश) होंगे।
प्रश्न 32.
तत्वों की परमाणु संख्या तथा परमाणु द्रव्यमान संख्या नीचे दी गई हैं। निम्न सूचना को रिक्त स्थानों में लिखिए।
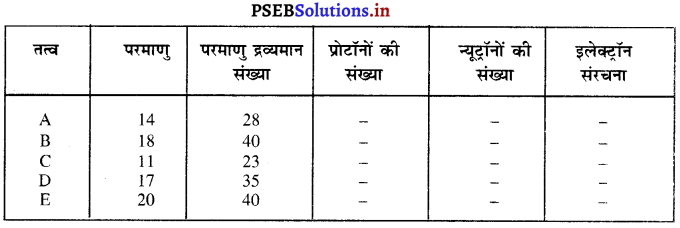
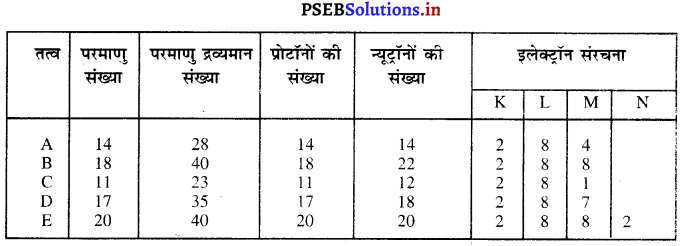
उत्तर-
प्रश्न 33.
एक तत्व की परमाणु संख्या क्या होगी जिसके M-शैल में 7 इलेक्ट्रॉन हैं ?
उत्तर-
इसका तात्पर्य यह है कि तत्व के परमाणु के K-शैल तथा L-शैल पूर्ण रूप से भरे हुए हैं। K-शैल में अधिकतम इलेक्ट्रॉन की संख्या 2 तथा L-शैल में 8 हो सकती है जबकि M-शैल में 7 इलेक्ट्रॉन हैं।
इसलिए परमाणु में इलेक्ट्रॉनों की कुल संख्या = 2 + 8 + 7 = 17
क्योंकि परमाणु विद्युतीय रूप से उदासीन होता है, इसलिए परमाणु में प्रोटॉनों की संख्या = इलेक्ट्रॉनों को संख्या होगी।
∴ परमाणु में प्रोटॉनों की संख्या = 17
∴ परमाणु की परमाणु संख्या = 17
प्रश्न 34.
समस्थानिकों के समान गुण लिखिए।
उत्तर-
समस्थानिकों के गुण-
- किसी तत्व के समस्थानिकों की परमाणु संख्या समान होती है।
- तत्व के सभी समस्थानिकों के रासायनिक गुण एक जैसे होते हैं।
- तत्व के सभी समस्थानिकों में इलेक्ट्रॉनों की संख्या समान होती है।
- तत्व के सभी समस्थानिकों का इलेक्ट्रॉनिक विन्यास एक जैसा होता है।
![]()
प्रश्न 35.
निम्न सारणी में किन्हीं तत्वों की द्रव्यमान संख्या तथा परमाणु संख्या दी गई है :
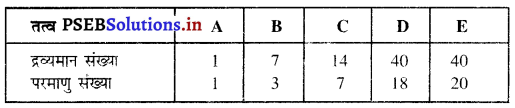
(i) ऊपर दी गई सारणी से आइसोबार (समभारिक) का युग्म चुनिए।
(ii) सारणी में लिखे तत्व B की संयोजकता क्या होगी ?
उत्तर-
(i) D तथा E
(ii) B तत्व की संयोजकता = 1
संख्यात्मक प्रश्न (Numerical Problems)
प्रश्न 1.
परमाणु द्रव्यमान 35 और 37 वाले क्लोरीन के दो समस्थानिक (आइसोटोप) 3 : 1 के अनुपात में विद्यमान हैं। इनका औसत परमाणु द्रव्यमान क्या होगा ?
हल :
क्लोरीन का औसत परमाणु द्रव्यमान = \(\frac{35 \times 3+37 \times 1}{3+1}\)
= \(\frac{105+37}{4}\) = 35.5 a. m. u.
प्रश्न 2.
परमाणु क्रमांक 18 वाले तत्व X तथा परमाणु क्रमांक 16 वाले तत्व Z में से कौन-सा रासायनिक रूप से अधिक अभिक्रियाशील होगा ?
हल :
X तत्व का परमाणु क्रमांक = इलेक्ट्रॉनों की संख्या = 18

अब Z तत्व का परमाणु क्रमांक – Z में उपस्थित इलेक्ट्रॉनों की संख्या = 16
![]()
किसी निष्क्रिय गैस के एक परमाणु के सबसे बाहरी कक्ष में 8 इलेक्ट्रॉन होते हैं जिससे X न तो कभी इलेक्ट्रॉन खोएगा और न ही अर्जित करेगा। अतएव X रासायनिक रूप से अभिक्रियाशील नहीं है।
किसी निष्क्रिय गैस के विन्यास को प्राप्त करने के लिए Z तत्व 2 इलेक्ट्रॉन अर्जित कर सकता है। अतएव Z रासायनिक रूप से X से अधिक अभिक्रियाशील है।
प्रश्न 3.
उस तत्व की परमाणु संख्या ज्ञात करें जिसके नाभिक में 12 न्यूट्रॉन हैं और जिसकी द्रव्यमान संख्या 23 है। इस तत्व का संकेत क्या है ?
हल :
परमाणु के नाभिक में न्यूट्रॉन की संख्या = 12
परमाणु द्रव्यमान (A) = 23
परमाणु संख्या (Z) = ?
हम जानते हैं कि द्रव्यमान संख्या (A) = प्रोटॉन की संख्या + न्यूट्रॉन की संख्या
23 = P + 12
∴ प्रोटॉन की संख्या (P) = 23 – 12 = 11
अर्थात् परमाणु संख्या (Z) = प्रोटॉन की संख्या = 11 उत्तर
सोडियम तत्व की परमाणु संख्या 11 तथा द्रव्यमान संख्या 23 है। इस तत्व को दर्शाने के लिए संकेत है \({ }_{11}^{23} \mathrm{Na}\) उत्तर
प्रश्न 4.
निम्नलिखित में प्रोटॉनों, न्यूट्रॉनों और इलेक्ट्रॉनों की संख्या पता करें : \({ }_{92}^{235} \mathbf{U}\) तथा \({ }_{92}^{238} \mathrm{U}\) दोनों परमाणुओं का आपस में क्या संबंध है ?
हल :
U-235 परमाणु की द्रव्यमान संख्या (A) = 235
परमाणु संख्या (Z) = 92
हम जानते हैं कि n = A – Z
n = 235 – 92
n = 143
∴ U-235 में प्रोटॉन की संख्या = परमाणु संख्या = 92
इलेक्ट्रॉन की संख्या = प्रोटॉन की संख्या = 92
न्यूट्रॉन की संख्या = 143
U-238 परमाणु की द्रव्यमान संख्या (A) = 238
परमाणु संख्या (Z) = 92
n = 238 – 92
n = 146
\({ }_{92}^{235} \mathrm{U}\) तथा \({ }_{92}^{238} \mathrm{U}\) दोनों यूरेनियम तत्व के समस्थानिक हैं। इन दोनों के नाभिक में प्रोटॉनों की संख्या एक समान 92 है, परंतु न्यूट्रॉनों की संख्या विभिन्न है अर्थात् दोनों परमाणुओं की परमाणु संख्या समान है, परंतु द्रव्यमान संख्या भिन्न है।
![]()
प्रश्न 5.
तत्व \(x_{9}^{19}\) में कितने इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन हैं ? इस तत्व की संयोजकता कितनी होगी ?
हल :
परमाणु संख्या = 9
द्रव्यमान संख्या = 19
∴ इलेक्ट्रॉनों की संख्या = 9
प्रोटॉनों की संख्या = परमाणु संख्या = 9
न्यूट्रॉनों की संख्या – 19 – 9 = 10
![]()
तत्व की संयोजकता = 8 – 7 = 1
प्रश्न 6.
परमाणु के अवपरमाणुक कणों के नाम बताओ। हीलियम का परमाणु द्रव्यमान 4u तथा इसके नाभिक में 2 प्रोटॉन हैं। इसमें कितने न्यूट्रॉन हैं ? सोडियम तथा कार्बन की इलेक्ट्रॉनिक संरचना लिखिए (दिया है सोडियम की परमाणु संख्या = 11, कार्बन की परमाणु संख्या = 6)।
हल :
(i) परमाणु के अवपरमाणुक कण : इलेक्ट्रॉन, प्रोटॉन, न्यूट्रॉन
(ii) हीलियम में न्यूट्रॉनों की संख्या = 4 – 2 = 2
(iii) सोडियम की इलेक्ट्रॉनिक संरचना : 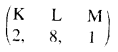
(iv) कार्बन की इलेक्ट्रॉनिक संरचना : 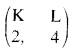
अति लघु उत्तरात्मक प्रश्न (Very Short Answer Type Questions)
प्रश्न 1.
‘कैनाल रे’ की खोज किसने और कब की थी ?
उत्तर-
‘कैनाल रे’ को खोज ई० गोल्डस्टीन ने सन 1886 में की थी।
प्रश्न 2.
कैनाल किरणों पर कौन-सा आवेश होता है ? उत्तर-धन आवेश।
प्रश्न 3.
प्रोटॉन पर कौन-सा आवेश होता है ?
उत्तर-
धन आवेश।
प्रश्न 4.
प्रोटॉन परमाणु के किस भाग में होते हैं ?
उत्तर-
सबसे भीतरी भाग नाभिक में।
![]()
प्रश्न 5.
डाल्टन के अनुसार परमाणु के मूल गुण क्या थे ?
उत्तर-
डाल्टन के अनुसार परमाणु अविभाज्य और अविनाशी है।
प्रश्न 6.
डॉल्टन के सिद्धांत को किस खोज ने गलत सिद्ध कर दिया था ?
उत्तर-
इलेक्ट्रॉन और प्रोटॉन की खोज ने।
प्रश्न 7.
परमाणु संरचना से संबंधित पहला मॉडल किसने प्रस्तुत किया था ?
उत्तर-
जे० जे० टॉमसन।
प्रश्न 8.
रदरफोर्ड ने एल्फा कणों के प्रकीर्णन प्रयोग में सोने की पन्नी क्यों चुनी थी ?
उत्तर-
रदरफोर्ड बहुत पतली परत चाहते थे जो 1000 परमाणुओं के बराबर मोटी हो।
प्रश्न 9.
एल्फा कण क्या होते हैं ?
उत्तर-
दविआवेशित हीलियम (He2+) कण होते हैं।
![]()
प्रश्न 10.
एल्फा कणों पर कौन-सा आवेश होता है ?
उत्तर-
धन आवेश ।
प्रश्न 11.
एल्फा कणों का द्रव्यमान कितना होता है ?
उत्तर-
4u.
प्रश्न 12.
नील्स बोर ने रदरफोर्ड के मॉडल पर उठी आपत्तियों को किस प्रकार दूर किया ?
उत्तर-
नील्स बोर ने स्पष्ट किया कि इलेक्ट्रॉन कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं जिनसे ऊर्जा का विकिरण नहीं होता।
प्रश्न 13.
ऊर्जा स्तर किसे कहते हैं ?
उत्तर-
इलेक्ट्रॉन जिन निश्चित कक्षाओं में चक्कर लगाते हैं उन्हें ऊजां स्तर कहते हैं। इन्हें K. L, M. N… या 1, 2, 3, 4 … के द्वारा निरूपित किया जाता है।
प्रश्न 14.
परमाणु द्रव्यमान किसे कहते हैं ?
उत्तर-
परमाणु द्रव्यमान – परमाणु के नाभिक में उपस्थित प्रोटॉन और न्यूट्रॉन के द्रव्यमान के योग को परमाणु द्रव्यमान कहते हैं।
प्रश्न 15.
विभिन्न कक्षाओं में इलेक्ट्रॉनों के वितरण का नियम किसने प्रस्तुत किया था ?
उत्तर-
बोर और बरी ने।
प्रश्न 16,
परमाणु के विभिन्न कक्षाओं में इलेक्ट्रॉनों की कक्षा में वितरण करने का सूत्र लिखिए।
उत्तर-
2n2जहां ‘n’ कक्षा की संख्या या ऊर्जा स्तर होता है।
![]()
प्रश्न 17.
पहली चार कक्षाओं में क्रम से इलेक्ट्रॉनों की अधिकतम संख्या लिखिए।
उत्तर-
2, 8. 18. 32.
प्रश्न 18.
सबसे बाह्यतम कोश में अधिकतम कितने इलेक्ट्रॉन हो सकते हैं ?
उत्तर-
8.
प्रश्न 19.
रासायनिक रूप से कौन-से तत्व सक्रिय नहीं होते ?
उत्तर-
जिन तत्वों के परमाणुओं के बाह्यतम कक्ष पूर्ण रूप से भरे होते हैं, वे रासायनिक दृष्टि से सक्रिय नहीं होते।
प्रश्न 20.
अष्टक किसे कहते हैं ?
उत्तर-
अष्टक -आट इलेक्ट्रॉन वालं सबसे बाहरी कक्ष को अप्टक कहते हैं।
प्रश्न 21.
तत्व की संयोजकता क्या होती है ?
उत्तर-
संयोजकता – परमाणा के बाहयतम कक्ष में इलेक्ट्रॉनों के अष्टक बनाने के लिए जितनी संख्या में इलेवटॉनों का सामेदारी या स्थानांतरण होता है. वह उस तत्व की संयोजकता होती है।
प्रश्न 22.
परमाणु संख्या किसे कहते हैं ?
उत्तर-
परमाणु संख्या – किसी परमाणु के नाभिक में उपस्थित प्रोटॉनों की कुल संख्या को परमाणु संख्या कहते है।
![]()
प्रश्न 23.
न्यूक्लिऑन किसे कहते हैं ?
उत्तर-
न्यूक्लिऑन – कियो परमाणु के नाभिक में उपस्थित प्रोटॉन और न्यूट्रॉन को न्यूक्लिऑन कहते हैं।
प्रश्न 24.
परमाण का लगभग संपूर्ण द्रव्यमान कहां स्थित होता है ?
उत्तर-
परमाणु के नाभिक में।
प्रश्न 25.
द्रव्यमान संख्या किसे कहते हैं ?
उत्तर-
द्रव्यमान संख्या – किसी परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूटॉनों की कुल संख्या के योग को द्रव्यमान संख्या कहते हैं।
प्रश्न 26.
समस्थानिक किस कहते हैं ?
उत्तर-
समस्थानिक ( आइसोटोप)- एक ही तत्व के परमाणु जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती है, उसे समस्थानिक कहते हैं।
प्रश्न 27.
क्लोरीन के दो समस्थानिक लिखिए।
उत्तर-
\({ }_{17}^{35} \mathrm{U}\) तथा \({ }_{17}^{37} \mathrm{U}\)
प्रश्न 28.
कार्बन के दो समस्थानिक लिखिए।
उत्तर-
\({ }_{16}^{12} \mathrm{U}\) तथा \({ }_{16}^{14} \mathrm{U}\)।
![]()
प्रश्न 29.
क्लोरीन के परमाणु का द्रव्यमान क्या है ?
उत्तर-
35.5.
प्रश्न 30.
कैंसर के उपचार में किस तत्व के समस्थानिक का प्रयोग किया जाता है ?
उत्तर-
कोबाल्ट के समस्थानिक का।
प्रश्न 31.
घेघा रोग के इलाज में किस तत्व के समस्थानिक का प्रयोग किया जाता है ?
उत्तर-
आयोडीन के समस्थानिक का।
प्रश्न 32.
परमाणु भट्टी में ईंधन के रूप में किस तत्व के समस्थानिक का उपयोग किया जाता है ?
उत्तर-
यूरेनियम का।
प्रश्न 33.
समभारिक किसे कहते हैं ?
उत्तर-
समभारिक-भिन्न-भिन्न परमाणु संख्या पर समान द्रव्यमान संख्या वाले तत्वों को समभारिक कहते हैं।
प्रश्न 34.
दो समभारिक तत्वों के उदाहरण दीजिए।
उत्तर-
- कैल्सियम
- आर्गान।
प्रश्न 35.
हाइड्रोजन के तीन समस्थानिकों के नाम लिखिए।
उत्तर-
- प्रोटियम (\({ }_{1}^{1} \mathrm{H}\))
- ड्यूटीरियम (\({ }_{1}^{2} \mathrm{H}\))
- ट्राइटियम (\({ }_{1}^{3} \mathrm{H}\))
![]()
प्रश्न 36.
यदि किसी तत्व के K तथा L शैल संपूर्ण रूप से इलैक्ट्रॉनों से भरे हों तो इसमें इलेक्ट्रॉनों की कुल कितनी संख्या होगी ? ।
उत्तर-
इलेक्ट्रॉनों की संख्या = 10 (K = 2, L = 8)
प्रश्न 37.
परमाणु के कौन-से इलेक्ट्रॉन तत्व के गुणों को निर्धारित करते हैं ?
उत्तर-
वेलैंस इलेक्ट्रॉन।
प्रश्न 38.
क्लोरीन परमाणु की द्रव्यमान संख्या 35 और परमाणु संख्या 17 है। आप क्लोरीन परमाणु को कैसे प्रदर्शित करोगे ?
उत्तर-
\({ }_{17}^{35} \mathrm{Cl}\)
प्रश्न 39.
उस अवपरमाणुक कण का नारा बताओ जो परमाणु का आकार निर्धारित करता है।
उत्तर-
इलेक्ट्रॉन।
प्रश्न 40.
उन पदार्थों ( परमाणुओं) को क्या कहते हैं जिनके रासायनिक गुण समान हों परंतु भौतिक गुण अलग हों ?
उत्तर-
समस्थानिक (आइसोटोप)।
प्रश्न 41.
Mg2+ आयन में 10 इलैक्ट्रॉन हैं। Mg2+ में प्रोटॉनों की संख्या क्या होगी ?
उत्तर-
12
![]()
प्रश्न 42.
वह कौन-सा तत्व है जिसके परमाणु के नाभिक में न्यूट्रॉन उपस्थित नहीं है ?
उत्तर-
हाइड्रोजन।
प्रश्न 43.
किसी तत्व के समस्थानिकों में निम्न कणों में से कौन-कौन से समान संख्या में होते हैं : इलेक्ट्रॉन, प्रोट्रॉन, न्यूट्रॉन ?
उत्तर-
इलेक्ट्रॉन तथा प्रोटॉन।
प्रश्न 44.
हाइड्रोजन के तीन समस्थानिक हैं : \({ }_{1}^{1} \mathrm{H}\), \({ }_{1}^{2} \mathrm{H}\), \({ }_{1}^{3} \mathrm{H}\) ये सभी विद्युतीय उदासीन क्यों हैं ?
उत्तर-
इन तीनों में एक प्रोटॉन तथा एक इलेक्ट्रॉन उपस्थित है।
प्रश्न 45.
एक तत्व के परमाणु की परमाणु संख्या 16 है। उसके संयोजकता इलेक्ट्रॉनों की संख्या तथा संयोजकता विन्यास लिखें।
उत्तर-
संयोजकता इलेक्ट्रॉनों की संख्या = 6

