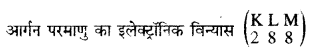Punjab State Board PSEB 9th Class Science Book Solutions Chapter 4 परमाणु की संरचना Textbook Exercise Questions and Answers.
PSEB Solutions for Class 9 Science Chapter 4 परमाणु की संरचना
PSEB 9th Class Science Guide परमाणु की संरचना Textbook Questions and Answers
प्रश्न 1.
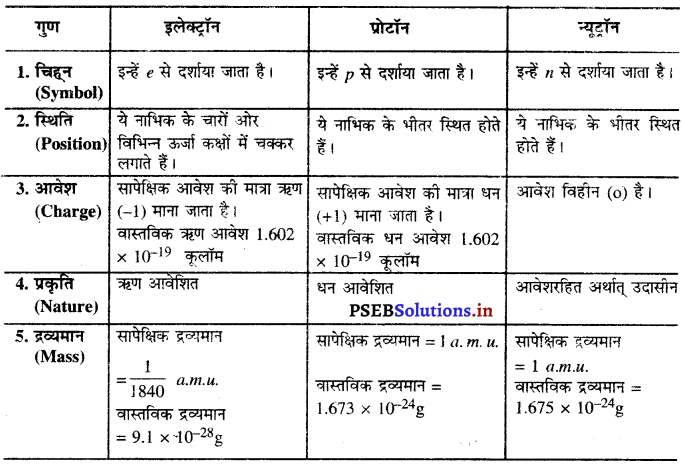
इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए।
उत्तर-
इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन के गुणों की तुलना-
प्रश्न 2.
जे० जे० टॉमसन के परमाणु मॉडल की क्या सीमाएं हैं ?
उत्तर-
टॉमसन परमाणु मॉडल की सीमाएं – जे० जे० टॉमसन ने सुझाव दिया कि परमाणु का द्रव्यमान उसके अंदर स्थित प्रोटॉन तथा इलेक्ट्रॉन के फलस्वरूप होता है जोकि परमाणु के भीतर एक समान वितरित होते हैं जैसे क्रिसमस केक के अंदर ड्राइफ्रूट (मेवा) लगा रहता है।
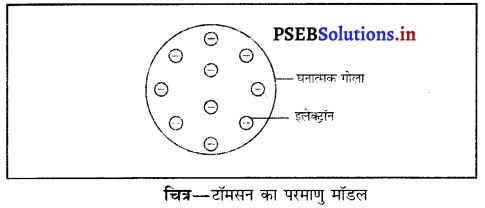
यह धारणा रदरफोर्ड के सुझाव से मेल नहीं खाती थी क्योंकि उसने कहा था कि परमाणु द्रव्यमान नाभिक के अंदर स्थित प्रोटॉनों तथा न्यूट्रॉनों के कारण होता है।
प्रश्न 3.
रदरफोर्ड के परमाणु मॉडल की क्या सीमाएं हैं ?
उत्तर-
रदरफोर्ड के परमाणु मॉडल की सीमाएं – रदरफोर्ड ने अपने परमाणु मॉडल में प्रस्तुत किया कि परमाणु का पूरा द्रव्यमान नाभिक में केंद्रित होता है। नाभिक धन आवेशित होता है जिसके चारों ओर इलेक्ट्रॉन विभिन्न ऊर्जा शैल में चक्कर लगाते हैं। ये ऋण आवेशित (इलेक्ट्रॉन) प्रवेगित कण चक्रीय गति करते हुए ऊर्जा विकसित करते हैं तथा ऊर्जा की हानि होने पर नाभिक में जा गिरते हैं ! इसका अभिप्राय यह हुआ कि परमाणु अस्थिर हैं जोकि सही नहीं है।
![]()
प्रश्न 4.
बोर के परमाणु मॉडल की व्याख्या कीजिए।
उत्तर-
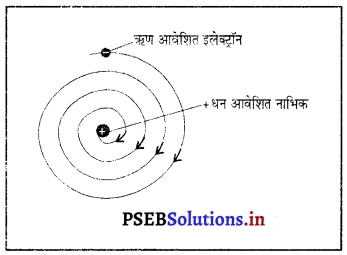
बोर का परमाणु मॉडल*
नीलस बोर ने परमाणु की संरचना के बारे निम्नलिखित मान्यताएं पेश की-
- परमाणु का केंद्र धन आवेशित छोटा सा ठोस भाग होता है जिसे नाभिक (Nucleus) कहते हैं। नाभिक में प्रोटॉन तथा न्यूट्रॉन उपस्थित रहते हैं।
- नाभिक का आयतन, परमाणु के आयतन की तुलना में बहुत छोटा होता है।
- ऋण-आवेशित इलैक्ट्रॉन नाभिक के चारों तरफ कुछ निश्चित पथों (आर्बिट) में चक्कर लगाते रहते हैं जिन्हें इलेक्ट्रॉन के विविक्त आर्बिट (Discrete orbits) कहते हैं। जब इलेक्ट्रॉन विविक्त आर्बिट में चक्कर लगाते हैं तो उनकी ऊर्जा का विकिरण नहीं होता है।
- जब इलेक्ट्रॉन चक्कर लगाते हुए एक ऊर्जा कोश से किसी दूसरे ऊर्जा कोश में छलांग लगाता है तो ऊर्जा परिवर्तन होता है।
प्रश्न 5.
इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए।
उत्तर-
विभिन्न परमाणु मॉडलों की तुलना-
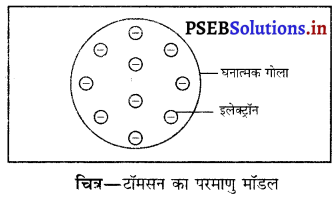
(i) टॉमसन का परमाणु मॉडल
- डिस्चार्ज ट्यूब (विसर्जन नली) प्रयोग के आधार पर टॉमसन ने यह सुझाव दिया कि परमाणु विद्युतीय रूप से उदासीन है तथा इसके पूरे आयतन में इलेक्ट्रॉन समरूप फैले हुए हैं।
- परमाणु धन आवेशित गोलाकार का बना होता है जिसमें इलेक्ट्रॉन धंसे रहते हैं।
- परमाणु का आकार 10-10 मी० अथवा 1°A होता है।
- परमाणु का द्रव्यमान समान रूप से पूर्ण क्षेत्र में फैला हुआ होता है।
(ii) रदरफोर्ड परमाणु मॉडल-

- सोने की पन्नी से α-विकिरणों के प्रकीर्णन ने यह सुझाया कि नाभिक परमाणु का बहुत छोटा तथा ठोस भाग है जिसमें धन-आवेशित कण विदयमान होते हैं।
- परमाणु के नाभिक का अर्धव्यास पूर्ण परमाणु के अद्धव्यास का 105 गुना होता है।
- परमाणु में इलैक्ट्रॉन, नाभिक के इर्द-गिर्द विभिन्न कक्षाओं में तीव्र गति से चक्कर लगाते हैं।
(iii) नीलस बोर का परमाणु मॉडल-
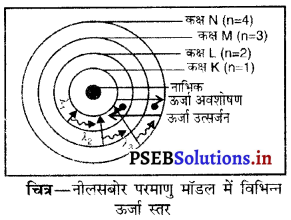
- परमाणु का नाभिक इलेक्ट्रॉनों से घिरा रहता है।
- नाभिक के इर्द-गिर्द इलेक्ट्रॉन निश्चित ऊर्जा स्तरों अथवा कोशों में चक्रीय गति करते हैं।
- जब इलेक्ट्रॉन गति करते हुए एक कोश से दूसरे कोश में गिरता है तो ऊर्जा परिवर्तन होता है। (लाभ अथवा हानि) जो विविरणों के रूप में होता है तथा अंत में इलेक्ट्रॉन नाभिक में जा गिरता है। अर्थात् परमाणु अस्थिर है।
प्रश्न 6.
पहले अठारह तत्वों के विभिन्न कक्षों में इलैक्ट्रॉन वितरण के नियम को लिखिए।
उत्तर-
विभिन्न कोशों में इलैक्ट्रॉन वितरण – परमाणुओं के विभिन्न कक्षों में इलैक्ट्रॉन वितरण के लिए बोर तथा बरी ने निम्नलिखित नियम प्रतिपादित किए-
- परमाणु के किसी कोश में उपस्थित अधिक-से-अधिक इलेक्ट्रॉनों की संख्या को 2n2 सूत्र द्वारा दर्शाया जा सकता है, जहाँ n कोश अथवा ऊर्जा स्तर की संख्या है। भीतर से बाहर की ओर ऊर्जा स्तर के नाम क्रमश: K, L, M, ……. हैं।
- बाह्यतम कोश में इलैक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है।
- बाह्यतम कोश से पहले कोश में 18 से अधिक इलेक्ट्रॉन नहीं हो सकते।
- किसी परमाणु के दिए गए कोश में इलेक्ट्रॉन उस समय तक स्थान ग्रहण नहीं करते जब तक उससे अंदर वाला कोश पूरी तरह भर नहीं जाता है। अर्थात् कोश क्रमानुसार ही भरे जाते हैं।
![]()
प्रश्न 7.
सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर-
किसी तत्व की संयोजक क्षमता को उस तत्व की संयोजकता कहते हैं। परमाणु के बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या उसकी संयोजकता बताती है। परंतु यदि बाह्यतम शैल में इलेक्ट्रॉन की संख्या उसकी अधिकतम क्षमता के समीप हो तो संयोजकता ज्ञात करने के लिए परमाणु के बाह्यतम कोश में उपस्थित इलेक्ट्रॉन संख्या को 8 में से घटा लिया जाता है।
सिलिकॉन – सिलिकॉन परमाणु में प्रोटॉनों की संख्या (p) = 14
∴ इलेक्ट्रॉनों की संख्या (e) = 14
![]()
∴ सिलिकॉन परमाणु के बाह्यतम शैल में उपस्थित इलेक्ट्रॉनों की संख्या = 4
∴ सिलिकॉन की संयोजकता = 4
ऑक्सीजन
ऑक्सीजन परमाणु में प्रोटॉनों की संख्या (p) = 8
∴ इलेक्ट्रॉनों की संख्या (e) = 8

ऑक्सीजन के बाहयतम कोश में इलेक्ट्रॉनों की संख्या = 6
∴ ऑक्सीजन की संयोजकता = (8 – 6) = 2 है।
प्रश्न 8.
उदाहरण के साथ व्याख्या कीजिए-परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक। समस्थानिकों के कोई दो उपयोग लिखिए।
उत्तर-
(i) परमाणु संख्या (Atomic Number) – किसी परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या को उस परमाणु की परमाणु संख्या कहते हैं। उदाहरणार्थ मैग्नीशियम परमाणु के नाभिक 12 प्रोटॉन हैं।
इसलिए मैग्नीशियम की परमाणु संख्या 12 है। परमाणु संख्या को ‘z’ से दर्शाया जाता है ?
परमाणु संख्या (z) = प्रोटॉन संख्या (p) = इलैक्ट्रॉन संख्या (e)
इसी प्रकार कार्बन के परमाणु में 6 प्रोटॉन होते हैं।
∴ कार्बन की परमाणु संख्या (z) = 6
(ii) द्रव्यमान संख्या (Mass Number) – किसी तत्व के नाभिक में प्रोटॉन तथा न्यूट्रॉन जिन्हें इकट्ठा मिलाकर न्यूक्लीऑन कहते हैं, की कुल संख्या को द्रव्यमान संख्या कहते हैं । द्रव्यमान संख्या को ‘A’ से प्रदर्शित किया जाता है। द्रव्यमान संख्या (A) = नाभिक में उपस्थित प्रोटॉन की संख्या + नाभिक में उपस्थित न्यूट्रॉन की संख्या
उदाहरणार्थ, कार्बन के नाभिक में 6 प्रोटॉन तथा 6 न्यूट्रॉन उपस्थित होते हैं, इसलिए
कार्बन की द्रव्यमान संख्या A = p + n
= 6 + 6
= 12 है।
(ii) समस्थानिक (Isotopes) – एक ही तत्व के दो परमाणु जिनकी परमाणु संख्या एक समान है परंतु परमाणु द्रव्यमान भिन्न-भिन्न हो, उन्हें उस तत्व के समस्थानिक (Isotopes) कहते हैं।
उदाहरण के लिए क्लोरीन के दो समस्थानिक \({ }_{17}^{35} \mathrm{Cl}\) तथा \({ }_{17}^{37} \mathrm{Cl}\) हैं जिनकी परमाणु संख्या एक समान अर्थात् 17 है परंतु एक की परमाणु द्रव्यमान संख्या 35 और दूसरे की परमाण द्रव्यमान संख्या 37 है।
(iv) समभारिक (Isobars) – ऐसे तत्व जिनकी परमाणु संख्या भिन्न-भिन्न होती है परंतु द्रव्यमान संख्या एक समान होती हैं, उन्हें समभारिक कहते हैं। उदाहरणार्थ कैल्शियम की परमाणु संख्या 20 तथा आर्गान की परमाणु संख्या 18 है परन्तु इनकी द्रव्यमान संख्या 40 है जिस कारण इनमें इलैक्ट्रॉन की संख्या भिन्न-भिन्न होती है। इन तत्वों के रासायनिक गुण समान होते हैं। इन तत्वों में उपस्थित प्रोटॉन तथा न्यूट्रॉन की संख्या भिन्न होती है।
समस्थानिकों के उपयोग (Uses of Isotopes)-
- कैंसर की चिकित्सा के लिए कोबाल्ट के समस्थानिक का उपयोग किया जाता है।
- गॉयटर की चिकित्सा में आयोडीन के समस्थानिक का उपयोग किया जाता है।
प्रश्न 9.
Na+ के पूरी तरह भरे हुए K और L कोश होते हैं-व्याख्या कीजिए।
उत्तर-
किसी तत्व के परमाणु में इलेक्ट्रॉनों की संख्या उतनी ही होती है जितनी उस परमाणु के नाभिक में प्रोटॉन होते हैं। इलेक्ट्रॉन तथा प्रोटॉन पर विपरीत आवेश होता है जिसके परिणामस्वरूप परमाणु विद्युतीय उदासीन होता है। यदि उदासीन परमाणु में इलेक्ट्रॉन की वृद्धि होगी तो उसमें इकाई ऋण आवेश आ जायेगा। दूसरी ओर यदि उसमें से एक इलेक्ट्रॉन निकल जाता है तो वह इकाई धन आवेश ग्रहण कर लेगा। इसलिए इलेक्ट्रॉन का निकलना या संयोजित होने से ऐसे बने आवेशित कण को आयन कहते हैं।
सोडियम परमाणु विद्युतीय उदासीन है। इसमें 11 प्रोटॉन तथा 11 इलेक्ट्रॉन होते हैं। इन इलेक्ट्रॉनों का वितरण 2, 8, 1 है। अब उनमें से 1 इलेक्ट्रॉन निकलने से यह धन आवेशित सोडियम आयन बन जाता है।
सोडियम परमाणु (Na) – le e. → सोडियम आयन (Na+)
अथवा 11-e – 1-e → 10-e
NaO – 1-e Na+
सोडियम आयन का इलेक्ट्रॉनिक विन्यास (2, 8) होगा।
अर्थात् इसमें K तथा L कोश पूर्ण रूप से भरे हुए होते हैं।
प्रश्न 10.
यदि ब्रोमीन परमाणु दो समस्थानिकों के [ \({ }_{35}^{79} \mathrm{Br}\)(49.7%) तथा \({ }_{35}^{81} \mathrm{Br}\) (50.3%) ] रूप में है तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
हल :
ब्रोमीन का समस्थानिक जिसका परमाणु द्रव्यमान 79 है = 49.7 %
∴ ब्रोमीन के परमाणु द्रव्यमान के लिए \({ }_{35}^{79} \mathrm{Br}\) का योगदान = \(\frac{79}{100}\) x 49.7
= 39.26u
ब्रोमीन का समस्थानिक जिसका परमाणु द्रव्यमान 81 है = 50.3 %
ब्रोमीन के परमाणु द्रव्यमान के लिए \({ }_{35}^{81} \mathrm{Br}\) का योगदान = \(\frac{50.3}{100}\) x 81
= 40.74 u
अब ब्रोमीन परमाणु का औसत परमाणु द्रव्यमान = 39.26 + 40.74 = 80.0 u
![]()
प्रश्न 11.
एक तत्व x का परमाणु द्रव्यमान 16.2 u है तो इस सैंपल में समस्थानिक \({ }_{8}^{16} x\) और \({ }_{8}^{18} x\) प्रतिशत क्या होगा ?
हल :
मान लो सैंपल में \({ }_{8}^{16} x\) की प्रतिशतता = y है
∴ सैंपल में \({ }_{8}^{18} x\) की प्रतिशतता = (100 – y)

16.2 x 100 = 1800 – 2 y
1620 = 1800 – 2y
2 y = 1800 – 1620
2 y = 180
∴ y = \(\frac{180}{2}\)
= 90
अर्थात् \({ }_{8}^{16} \mathrm{X}\) की प्रतिशतता = 90%
तथा \({ }_{8}^{18} \mathrm{X}\) की प्रतिशतता = 100 – 90
= 10%
प्रश्न 12.
यदि तत्व का Z = 3 तो तत्व की संयोजकता क्या होगी ? तत्व का नाम भी लिखिए।
हल :
तत्व की परमाणु संख्या को z से दर्शाया जाता है।
∴ तत्व की परमाणु संख्या = z = 3
अर्थात् तत्व के परमाणु में उपस्थित प्रोटॉनों की संख्या = इलैक्ट्रॉनों की संख्या = 3
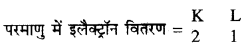
यह परमाणु लीथियम है तथा इसकी संयोजकता 1 है।
प्रश्न 13.
दो परमाणु स्पीशीज़ के केंद्रकों का संघटन नीचे दिया गया है-

X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इन दोनों स्पीशीज़ में क्या संबंध है?
उत्तर-
X की द्रव्यमान संख्या = 6 + 6
= 12
Y की द्रव्यमान संख्या = 6 + 8
= 14
क्योंकि X तथा Y दोनों की परमाणु संख्या एक समान है परंतु इनकी द्रव्यमान संख्या भिन्न है इसलिए दोनों परमाणु एक ही तत्व के समस्थानिक ![]() हैं।
हैं।
प्रश्न 14.
निम्नलिखित वक्तव्यों में गलत के लिए F और सही के लिए T लिखें।
(a) जे० जे० टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केंद्रक में केवल न्यूक्लीयॉन्स होते हैं।
(b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं। इसलिए यह अनावेशित होता है।
(c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग \(\frac{1}{2000}\) गुणा होता है।
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंकचर आयोडीन बनाने में होता है।
उत्तर-
(a) False,
(b) False,
(c) True,
(d) TTrue.
प्रश्न संख्या 15, 16 तथा 17 में गलत के सामने (×) का चिह्न तथा सही के सामने (√) का चिह्न लगाएँ
प्रश्न 15.
रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था-
(a) परमाणु केंद्रक
(b) इलैक्ट्रॉन
(c) प्रोटॉन
(d) न्यूट्रॉन।
उत्तर-
(a) परमाणु केंद्रक √
(b) ×
(c) ×
(d) ×.
![]()
प्रश्न 16.
एक तत्व के समस्थानिक में होते हैं-
(a) समान भौतिक गुण
(b) भिन्न रासायनिक गुण
(c) न्यूट्रॉनों के अलग-अलग संख्या
(d) भिन्न परमाणु संख्या।
उत्तर-
(a) ×
(b) ×
(c) न्यूट्रॉनों की अलग-अलग संख्या √
(d) ×
प्रश्न 17.
Cl– आयन में संयोजकता इलैक्ट्रॉनों की संख्या है-
(a) 16
(b) 8
(c) 17
(d) 18.
उत्तर-
(a) ×
(b) 8 √
(c) ×
(d) ×.
प्रश्न 18.
सोडियम का सही इलैक्ट्रॉनिक विन्यास निम्न में से कौन-सा है ?
(a) 2, 8
(b) 8, 2.1
(c) 2. 1. 8
(d) 2. 8. 1.
उत्तर-
(a) ×
(b) ×
(c) ×
(d) 2, 8, 1√.
प्रश्न 19.
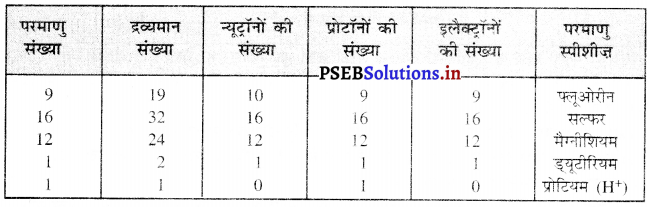
निम्नलिखित सारणी को पूरा कीजिए-
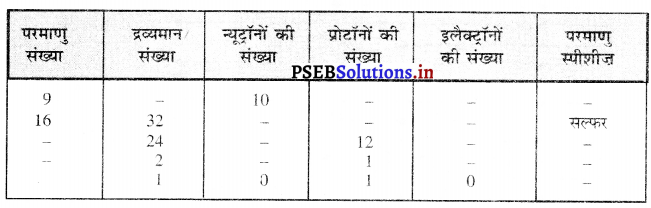
उत्तर-
Science Guide for Class 9 PSEB परमाणु की संरचना InText Questions and Answers
पाठ्य-पुस्तक के प्रश्नों के उत्तर
प्रश्न 1.
केनाल किरणें क्या हैं ?
उत्तर-
केनाल किरणें (Canat Rays) – एनोड से उत्सर्जित होने वाली किरणें जब डिस्चार्ज टयब में गैस प्रयोग की जाती है, केनाल किरणें कहलाती हैं। ये धन आवेशित विकिरणें हैं जो ऐसे कणों से निर्मित होती हैं और जिनका द्रव्यमान, इलैक्ट्रॉन का 2000 गुना होता है परंतु इसका आवेश इलैक्ट्रॉन के आवेश से विपरीत होता है।
प्रश्न 2.
यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो उसमें कोई आवेश होगा या नहीं ?
उत्तर-
प्रत्येक प्रोटॉन का आवेश +1 तथा इलैक्ट्रॉन का आवेश -1 माना गया है। अब क्योंकि किसी परमाणु में एक प्रोटॉन तथा एक इलेक्ट्रॉन है जो परस्पर एक-दूसरे के आवेशों को संतुलित करते हैं। इसलिए इस परमाणु पर कोई परिणामी (नेट) आवेश नहीं होगा अर्थात् परमाणु विद्युतीय उदासीन होगा।
प्रश्न 3.
परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए। उत्तर-टॉमसन का परमाणु मॉडल (Thomson’s Model of Atom)-
- परमाणु धन आवेशित गोलाकार होता है तथा इलैक्ट्रॉन इसमें फँसे होते हैं जैसे क्रिसमस केक में मेवा लगा होता है।
- ऋणात्मक तथा धनात्मक आवेश मात्रा में समान होते हैं जो एक-दूसरे को संतुलित करते हैं। इसलिए परमाणु विद्युतीय रूप से उदासीन (आवेश रहित) होता है।
![]()
प्रश्न 4.
रदरफोर्ड के परमाणु मॉडल के अनुसार नाभिक के परमाणु में कौन-सा अवपरमाणुक कण विद्यमान है ?
उत्तर-
रदरफोर्ड के परमाणु मॉडल अनुसार परमाणु का नाभिक (Nucleus) धन आवेशित होता है। परमाणु का लगभग सारा द्रव्यमान परमाणु के नाभिक में स्थित होता है तथा इलैक्ट्रॉन नाभिक के चारों ओर विभिन्न पथों (कक्षाओं) में चक्कर लगाते हैं। इसलिए परमाणु के नाभिक में अवपरमाणुक कण प्रोटॉन विद्यमान होता है।
प्रश्न 5.
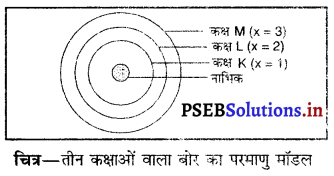
तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइए।
उत्तर-
प्रश्न 6.
क्या अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु के पन्नी से संभव होगा ?
उत्तर-
यदि अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त किसी अन्य धातु की पन्नी से किया जाए तो वही परिणाम संभव होगा जो सोने की पन्नी के साथ हुआ था।
अंतर केवल इतना है कि सोना एक आघातवर्धनीय धातु है और इसे पीट कर पतलो चादर में बदला जा सकता है जबकि अन्य किसी धातु को इतना बारीक नहीं किया जा सकता है। यदि हम मोटी धातु की चादर का प्रयोग करेंगे तो अल्फा कण इससे टकराकर वापिस लौट आएंगे तथा हमें परमाणु के भीतर धन आवेशित प्रोटॉन की स्थिति का पक्का अनुमान नहीं होगा।
प्रश्न 7.
परमाणु के तीन अवपरमाणुक कणों के नाम लिखें।
उत्तर-
परमाणु के तीन अवपरमाणुक कण-परमाणु के निम्नलिखित तीन अवपरमाणुक कम हैं :-
(i) प्रोटॉन (1P1 )
(ii) इलेक्ट्रॉन (0e-1 )
(iii) न्यूट्रॉन (1n0 )।
प्रश्न 8.
हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे ?
उत्तर-
हीलियम परमाणु में न्यूट्रॉनों की संख्या-किसी परमाणु का द्रव्यमान उसके नाभिक (Nucleus) में उपस्थित प्रोटॉन तथा न्यूट्रॉन के द्रव्यमानों के योग के कारण होता है : अब हीलियम परमाणु का परमाणु द्रव्यमान 4 u है तथा इसके नाभिक में 2 प्रोटॉन होते हैं और दो प्रोटॉनों का द्रव्यमान 20 है। इसलिए इसके नाभिक में (4 u -2u = 2u) द्रव्यमान न्यूट्रॉन की उपस्थिति के कारण है। क्योंकि 1 न्यूट्रॉन का द्रव्यमान 1 u होता है इसलिए नाभिक में 2 न्यूट्रॉन होंगे जो 2 u द्रव्यमान प्रदान करेंगे।
पाठ्य-पुस्तक के प्रश्नों के उत्तर
प्रश्न 9.
कार्बन और सोडियम के परमाणुओं के लिए इलैक्ट्रॉन-वितरण लिखिए।
उत्तर-
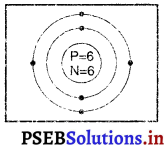
कार्बन परमाणु – कार्बन का परमाणु द्रव्यमान 12 है। इसलिए
इसमें प्रोटॉनों की संख्या (p) = 6 तथा इलैक्ट्रॉनों की संख्या (e) = 6 है।
कार्बन परमाणु में इलैक्ट्रॉन वितरण-
K-कोश में अधिकतम इलेक्ट्रॉनों की संख्या = 2
∴ L-कोश में इलेक्ट्रॉनों की संख्या = 4
सोडियम परमाणु
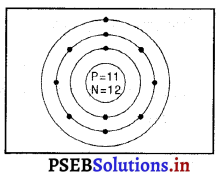
सोडियम का परमाणु द्रव्यमान = 23 है, इसलिए सोडियम के परमाणु में प्रोटॉनों की संख्या (p) = 11 तथा इलेक्ट्रॉनों की संख्या (e) = 11 है।
सोडियम परमाणु में इलेक्ट्रॉनों का वितरण-
K-कोश में इलैक्ट्रॉनों की संख्या = 2
L-कोश में इलैक्ट्रॉनों की संख्या = 8
M-कोश में इलैक्ट्रॉनों की संख्या = 1
![]()
प्रश्न 10.
अगर किसी परमाणु का K और L कोश भरा है तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी ?
उत्तर-
K-कोश भरा हुआ होने की परिस्थिति में इलेक्ट्रानों की कुल संख्या = 2
L-कोश पूरा भरा हुआ होने की अवस्था में इलेक्ट्रानों की संख्या = 8
∴ परमाणु में उपस्थित कुल इलैक्ट्रॉन = 2 + 8 = 10
प्रश्न 11.
क्लोरीन, सल्फर और मैग्नीशियम की परमाणु संख्या से आप संयोजकता कैसे प्राप्त करेंगे ?
उत्तर-
(i) क्लोरीन (Cl)-
क्लोरीन की परमाणु संख्या = 17
क्लोरीन के परमाणु में उपस्थित प्रोटॉनों की संख्या (p) = 17
इलेक्ट्रॉनों की संख्या (e) = 17
![]()
क्लोरीन परमाणु के बाह्यतम कोश में उपस्थित
इलेक्ट्रॉनों की संख्या = 7
∴ क्लोरीन की संयोजकता = 8 – 7
अर्थात् बाह्यतम कोश में अष्टक बनाने के लिए आवश्यक इलेक्ट्रॉन = 1
(ii) सल्फर (S)-
सल्फर की परमाणु संख्या = 16
सल्फर के परमाणु में उपस्थित प्रोटॉनों की संख्या (p) = 16
इलेक्ट्रॉनों की संख्या (e) = 16

सल्फर परमाणु के बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या = 6
बाह्यतम कोश में अष्टक (पूरा भरने) बनाने के लिए आवश्यक इलेक्ट्रॉन = 8 – 6 = 2
∴ सल्फर की संयोजकता = 2
(iii) मैग्नीशियम (Mg)-
मैग्नीशियम की परमाणु संख्या = 12
मैग्नीशियम के परमाणु में उपस्थित प्रोटॉनों की संख्या (p) = 12
इलेक्ट्रॉनों की संख्या (e) = 12

मैग्नीशियम के परमाणु के बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या
अर्थात् मैग्नीशियम परमाणु के बाह्यतम कोश को भरा होने के लिए जितने इलेक्ट्रॉन छोड़ने पड़ेंगे = 2
∴ मैग्नीशियम परमाणु की संयोजकता = 2
प्रश्न 12.
यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है, तब
(क) परमाणु की परमाणुक संख्या क्या होगी ?
(ख) परमाणु का क्या आवेश है ?
उत्तर-
(i) परमाणु की परमाणु संख्या = प्रोटॉनों की संख्या (p) = 8
∴ परमाणु में उपस्थित इलेक्ट्रॉन न्यूट्रॉनों की संख्या= 8
∴ परमाणु द्रव्यमान = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
= 8 + 8 = 16
(ii) परमाणु में उपस्थित इलेक्ट्रॉनों की संख्या = प्रोटॉनों की संख्या = 8
परमाणु पर उपस्थित आवेश = प्रोटॉनों की संख्या – इलेक्ट्रॉनों की संख्या
= 8 – 8
= 0
अर्थात् परमाणु आवेश विहीन है।
प्रश्न 13.
पाठ्य-पुस्तक की सारणी 4.1 की सहायता से ऑक्सीजन और सल्फर परमाणु की द्रव्यमान संख्या ज्ञात कीजिए।
उत्तर-
(i) ऑक्सीजन (O)
ऑक्सीजन परमाणु में उपस्थित प्रोटॉनों की संख्या (p) = 8
न्यूट्रॉनों की संख्या (n) = 8
∴ ऑक्सीजन परमाणु की परमाणु की द्रव्यमान संख्या = p + n
= 8 + 8
= 16
(ii) सल्फर (S)-
सल्फर के परमाणु में उपस्थित प्रोटॉनों की संख्या (p) = 16
न्यूट्रॉनों की संख्या (n) = 16
∴ सल्फर परमाणु की परमाणु द्रव्यमान संख्या = p + n
= 16 + 16
= 32
प्रश्न 14.
चिह्न H, D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए।
उत्तर-
H, D और T चिह्न हाइड्रोजन के तीन समस्थानिक हैं जिनकी परमाणु संख्या 1 है परंतु परमाणु द्रव्यमान संख्या भिन्न-भिन्न है।
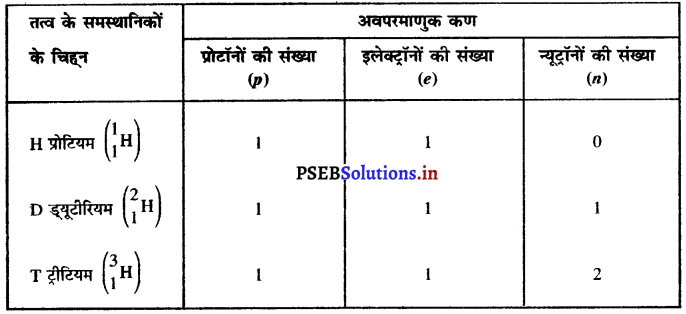
![]()
प्रश्न 15.
समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर-
(i) समस्थानिक (Isotopes) – क्लोरीन तत्व के दो समस्थानिक \({ }_{17}^{35} \mathrm{Cl}[latex] तथा [latex]{ }_{17}^{37} \mathrm{Cl}\) हैं। इन दोनों की परमाणु संख्या 17 है।
अब परमाणु संख्या = प्रोटॉनों की संख्या = इलेक्ट्रॉनों की संख्या = 17

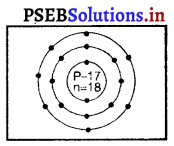
(ii) समभारिक (Isobars) – कैल्सियम \({ }_{20}^{40} \mathrm{C} a\) तथा आर्गन (\({ }_{18}^{40} \mathrm{~A} r\)) समभारिकों का युग्म है जिनका परमाणु द्रव्यमान एक समान 40 है परंतु १९ गाणु संख्या क्रमशः 20 और 18 भिन्न होने के कारण परमाणुओं का इलेक्ट्रॉन वितरण भी भिन्न होगा।
कैल्सियम (Ca)-
परमाणु द्रव्यमान संख्या = 40
अर्थात कैल्सियम के परमाणु में प्रोटॉनों की संख्या (p) = 20
इलैक्ट्रॉनों की संख्या (e) = 20 ……….(1)
परमाणु द्रव्यमान संख्या = n + p = 40 …………….(2)
∴ कैल्सियम के परमाणु में उपस्थित न्यूट्रॉनों की संख्या (n) = (2) – (1)
= 40 – 20
= 20
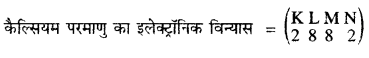
आर्गन (Ar) परमाणु संख्या = 18
अर्थात् आर्गन के परमाणु में प्रोटॉनों की संख्या (p) = इलैक्ट्रॉनों की संख्या (e) = 18 ………………. (1)
परमाणु द्रव्यमान संख्या = n + p = 40 ………………… (2)
∴ आर्गन परमाणु में उपस्थित न्यूट्रॉनों की संख्या (n)
= (2) – (1)
= 40 – 18
= 22