Punjab State Board PSEB 10th Class Science Important Questions Chapter 3 धातु एवं अधातु Important Questions and Answers.
PSEB 10th Class Science Important Questions Chapter 3 धातु एवं अधातु
दीर्घ उत्तरात्मक प्रश्न (Long Answer Type Questions)
प्रश्न 1.
धातुओं के भौतिक एवं रासायनिक गुणधर्मों का वर्णन कीजिए।
उत्तर-
धातुओं के भौतिक गुणधर्म-
- धात्विक चमक-शुद्ध धातुओं की सतहें चमकीली होती है। इस गुणधर्म को धात्विक चमक (metallic lustre) कहते हैं ; जैसे-सोने में पीले रंग की, ताँबे में लाल-भूरे रंग की, एल्यूमीनियम में सफेद रंग की चमक होती है।
- कठोरता-धातुएँ सामान्यतः कठोर होती हैं। विभिन्न धातुओं की कठोरता भिन्न-भिन्न होती है। कॉपर (ताँबा), आयरन (लोहा), एल्यूमिनियम अत्यंत कठोर धातुएँ हैं, जबकि सोडियम, पोटैशियम मृदु धातुएँ हैं।
- आघातवर्ध्यता- जो धातुएँ हथौड़े द्वारा पीट-पीट कर पतली चादरों में परिवर्तित हो जाती हैं आघातवर्धनीय कहलाती हैं। इस गुणधर्म को आघातवर्ध्यता (malleability) कहते हैं। सोना तथा चाँदी सर्वाधिक आघातवर्धनीय धातुएँ हैं।
- तन्यता- वे धातुएँ जिनसे अत्यंत पतले तार खींचे जा सकते हैं, तन्य कहलाती हैं तथा इस गुणधर्म को तन्यता (ductility) कहते हैं। सोना तथा चाँदी सर्वाधिक तन्य धातुएँ हैं।
- उष्मीय चालकता-धातुएँ सामान्यतः ऊष्मा की सुचालक होती हैं। चाँदी ऊष्मा की सर्वश्रेष्ठ सुचालक है। अन्य धातुएँ जो ऊष्मा की सुचालक हैं के उदाहरण कॉपर, एल्यूमीनियम आदि हैं।
- वैद्युत् चालकता-धातुएँ विद्युत् की सुचालक होती हैं। सिल्वर, कॉपर आदि विद्युत् की सुचालक हैं।
धातुओं के रासायनिक गुणधर्म
1. धातुओं की ऑक्सीजन से अभिक्रिया-सभी धातुएँ ऑक्सीजन से संयोग करके धात्विक ऑक्साइड बनाती हैं। क्योंकि सभी धातुओं की अभिक्रियाशीलता भिन्न-भिन्न है। इसलिए वे अलग-अलग ताप पर ऑक्सीजन से संयोग करते हैं।
(i) सामान्य ताप पर Na तथा K ऑक्सीजन से संयोग करके ऑक्साइड बनाते हैं जो पानी में घुलने पर हाइड्रोक्साइड बनाते हैं।
4Na (s) + O2 (g) → 2Na2O (s)
Na2O (s) + H2O → 2NaOH (aq)
(ii) मैग्नीशियम रिबन वायु में जलकर मैग्नीशियम ऑक्साइड बनाता है।
![]()
(iii) तांबा तथा लोहा शुष्क वायु में उच्च तापक्रम पर ऑक्सीजन से संयोग करते हैं।

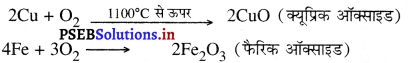
2. धातुओं की तनु अम्लों से अभिक्रिया-धातुएं तनु अम्लों से अभिक्रिया करके हाइड्रोजन गैस मुक्त करती हैं। विभिन्न धातुओं अम्लों के साथ अभिक्रियाशीलता की दर भिन्न-भिन्न होती है।
(i) Na, K, Zn, Mg, Fe आदि अवरोही क्रम में अभिक्रियाशील हैं।
2Na + 2HCl → 2NaCl + H2↑
Mg + 2HCl → MgCl2+ H2↑
Zn + H2SO4 → ZnSO4 + H2↑
(ii) तनु नाइट्रिक अम्ल Cu, Ag, Pb, Hg धातुओं के साथ क्रिया करके NO (नाइट्रोजन ऑक्साइड) बनाता
3Cu + 8HNO3 → 3Cu (NO3)2 + 2NO + 4H2O
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
(iii) Mg तथा Mn के साथ तनु नाइट्रिक अम्ल हाइड्रोजन गैस मुक्त करते हैं।
Mg + 2HNO3 → Mg(NO3)2 + H2 ↑
(iv) सोना तथा प्लाटीनम तनु अम्ल से अभिक्रिया नहीं करते।
3. धातुओं की क्लोरीन से अभिक्रिया-धातुएं, क्लोरीन से संयोग करके अपने क्लोराइड बनाती हैं।
Ca + Cl2 → CaCl2
4. धातुओं की हाइड्रोजन से अभिक्रिया-क्रियाशील धातुएं Na, K, Ca आदि हाइड्रोजन से संयोग करके अपने हाइड्राइड बनाती हैं।
2Na + H2 → 2NaH (सोडियम हाइड्राइड)
Ca + H2 → CaH2 (कैल्शियम हाइड्राइड)
5. धातुओं की पानी से अभिक्रिया –
(i) जब पानी सामान्य ताप पर हो तो Na, K, Ca आदि क्रिया करके हाइड्रोजन गैस मुक्त करती है।
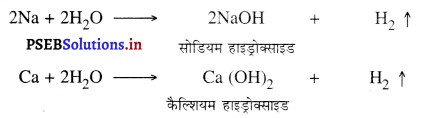
(ii) जब पानी उबलता हो तो Mg, Zn, Fe अभिक्रिया करके ऑक्साइड बनाते हैं।
Mg + H2O → MgO + H2↑
3Fe + 4H2O → Fe3O4 + 4H2↑
![]()
प्रश्न 2.
अधातुओं के भौतिक तथा रासायनिक गुण लिखो।
उत्तर-
अधातुओं के भौतिक गुण-
(i) भौतिक अवस्था-अधातुएं सामान्य तापमान पर प्राय: गैसीय अवस्था में या फिर ऐसे द्रव या ठोस रूप में होती हैं, जो निम्न तापमान पर ही वाष्पों में परिवर्तित हो जाते हैं।
(ii) धात्वीय चमक-अधातुओं की कोई चमक नहीं होती, किंतु आयोडीन थोड़ी सी धात्वीय चमक रखता है।
(ii) अधातुएं न ही आघातवीय हैं, न ही तन्य।
(iv) चालकता-धातुएं बिजली एवं ताप की कुचालक होती हैं। ग्रेफाइट ही एक ऐसी अधातु है, जो बिजली एवं ताप की सुचालक है।
(v) कठोरता-अधातुएं प्राय: नर्म होती हैं, किंतु हीरा अधातु होते हुए भी कठोरतम पदार्थ है।
अधातुओं के रासायनिक गुण –
(i) कार्बन की ऑक्सीजन से क्रिया-अधातुएं ऑक्सीजन के साथ क्रिया करके अम्लीय ऑक्साइड बनाती हैं।

कार्बन डाइऑक्साइड कार्बन डाइऑक्साइड का स्वभाव अम्लीय है। कार्बन डाइऑक्साइड पानी के साथ क्रिया करके कार्बोनिक अम्ल बनाती है।

(ii) नाइट्रोजन और सल्फर की हाइड्रोजन के साथ क्रिया-हाइड्रोजन अनुकूल परिस्थितियों में नाइट्रोजन के साथ क्रिया करके अमोनिया बनाती है, जबकि सल्फर के साथ क्रिया करके हाइड्रोजन सल्फाइड बनाती है।

(iii) सल्फर और हाइड्रोजन की ऑक्सीजन के साथ क्रिया-सल्फर ऑक्सीजन की उपस्थिति में जलकर क्रिया करके सल्फर डाइऑक्साइड बनाता है। हाइड्रोजन, ऑक्सीजन के साथ क्रिया करके पानी बनाता है।

(iv) फॉस्फोरस के साथ क्लोरीन की क्रिया-फॉस्फोरस क्लोरीन के साथ क्रिया करके फॉस्फोरस ट्राइक्लोराइड बनाती है।

प्रश्न 3.
धात्विकी क्या है ? इस प्रक्रम में प्रयुक्त पदों का विस्तारपूर्वक वर्णन कीजिए।
अथवा
अयस्क से धातु-निष्कर्षण में प्रयुक्त चरणों का उल्लेख कीजिए।
उत्तर-
धात्विकी- अयस्कों से धातुओं के निष्कर्षण और बाद में उनको परिष्कृत करके उपयोग में लाए जाने योग्य बनाने के प्रक्रम को धात्विकी (metallurgy) कहते हैं।
धात्विकी प्रक्रम में प्रयुक्त पद-धात्विकी प्रक्रम में मुख्यतः तीन पद होते हैं-
(I) अयस्क की समृद्धि,
(II) अपचयन तथा
(III) धातुओं का शुद्धिकरण।
I. अयस्क की समृद्धि
भू-खनन से प्राप्त अयस्कों में मिट्टी, बालू, चट्टानी पदार्थ आदि अशुद्धियाँ होती हैं जिन्हें गैंग कहते हैं। अयस्क से धातु के निष्कर्षण से पहले इन अशुद्धियों को हटाना आवश्यक होता है। अयस्क से गैंग हटाने की प्रक्रिया सांद्रण कहलाती है जो उनके भौतिक रासायनिक गुणधर्मों से भिन्नता पर आधारित होती है।
इसके लिए कई विधियाँ प्रयुक्त की जाती हैं जो निम्नलिखित हैं-
1. चंबकीय विधि-यह विधि चुंबकीय कणों (आयरन, कोबाल्ट, निक्कल) की अशुदधियों को अलग करने के लिए अपनाई जाती है। जो खनिज चुंबकीय प्रकृति के होते हैं वे चुंबकीय क्षेत्र की ओर आकर्षित होते हैं जबकि गैंग आदि आकर्षित नहीं होते। क्रोमाइट तथा पाइरोल्युसाइट अयस्क इसी विधि द्वारा सांद्रित किए जाते हैं। इस विधि में पीसे हुए अयस्क को एक कन्वेयर बैल्ट के ऊपर रखते हैं। कन्वेयर बैल्ट दो रोलरों के ऊपर से गुज़रती है जिनमें से एक चुंबकीय होता है। जब अयस्क चुंबकीय किनारे पर से नीचे आता है तो चुंबकीय और अचुंबकीय पदार्थ दो अलग अलग ढेरों में एकत्रित हो जाते हैं। लोहे के अयस्क मैग्नेटाइट का सांद्रण इसी विधि द्वारा किया जाता है।
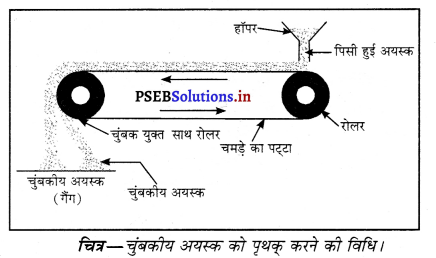
2. द्रवचालित धुलाई-इस विधि में बारीक पिसे हुए अयस्क को पानी की तेज़ धारा में धोया जाता है। इस तेज़ धारा में गैंग हल्के कण बह जाते हैं जबकि भारी खनिज कण तली में बैठ जाते हैं। टिन और लैड के अयस्क इसी विधि द्वारा सांद्रित किये जाते हैं।
(iii) फैन प्लवन विधि-इस विधि में बारीक पिसे हुए अयस्क को जल एवं किसी उपयुक्त तेल के साथ एक बड़े टैंक में मिलाया जाता है। खनिज कण पहले से तेल से भीग जाते हैं जबकि गैंग के कण पानी से भीग जाते हैं। अब इस मिश्रण में से दबाव अधीन वायु प्रवाहित की जाती है जिससे खनिज कण युक्त तेल के झाग या फैन बन जाते हैं जो जल की सतह पर तैरने लगते हैं जिन्हें बड़ी सरलता से जल के ऊपर से निकाला जा सकता है। तांबा, सीसा तथा जिंक के सल्फाइडों के सांद्रण के लिए इस विधि का प्रयोग किया जाता है।
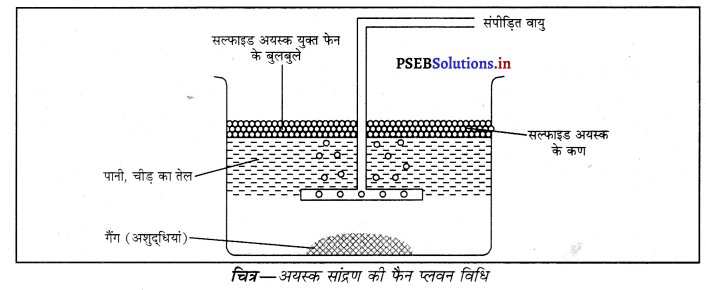
![]()
II. अपचयन
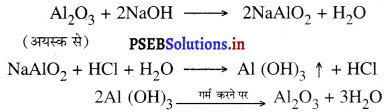
1. रासायनिक पृथक्करण (Chemical Separation)रासायनिक पृथक्करण में खनिज तथा गैंग के मध्य रासायनिक गुणों के अंतर का उपयोग किया जाता है। इसकी एक मुख्य विधि है-बेयर की विधि जिस द्वारा बॉक्साइट से एल्यूमीनियम ऑक्साइड प्राप्त किया जाता है। बेयर विधि द्वारा एल्यूमीनियम अयस्क का सांद्रण-इस विधि में बॉक्साइट को गर्म सोडियम हाइड्रोक्साइड के साथ अपचयित किया जाता है जो जल में घुलनशील है। गैंग को छान कर अलग कर दिया जाता है। एल्यूमीनियम का अवक्षेपण एल्यूमीनियम हाइड्रोक्साइड के रूप में प्राप्त होता है जिसके बाद एल्यूमीनियम हाइड्रोक्साइड को गर्म करके शुद्ध एल्यूमीनियम ऑक्साइड प्राप्त लिया जाता है। विभिन्न अभिक्रिया निम्नलिखित प्रकार से है-
2. सांद्रित अयस्क का धातु ऑक्साइड में बदलना भर्जन- इस क्रिया में अयस्क को वायु की उपस्थिति में गर्म करके धातु ऑक्साइड प्राप्त करते हैं, जो आसानी से अपचयित होकर धातु को अलग कर देता है। जिंक ब्लेंडी में जिंक सल्फाइड होता है। जब सांद्रित जिंक ब्लैंड अयस्क (जिंक सल्फाइड) को वायु में भर्जित किया जाता है तो वह ऑक्सीकृत होकर जिंक ऑक्साइड बना देता है।
![]()
निस्तापन- इस क्रिया में अयस्क को वायु की अनुपस्थिति में गर्म करके नमी तथा वाष्पशील अशुद्धियों को . अलग कर देते हैं। जब किसी कार्बोनेट अयस्क को गर्म किया जाता है, तो वह विघटित होकर धातु ऑक्साइड बना देता है।
![]()
3. धातु ऑक्साइड से धातु प्राप्त करना-धातु ऑक्साइडों से धातु प्राप्त करने के लिए उन्हें किसी अपचायक के साथ गर्म करते हैं। ज़िंक, लोहा, टिन तथा निकल जैसी धातुओं के ऑक्साइडों का अपचयन करके धातुएँ प्राप्त करने के लिए कार्बन का अपचायक के रूप में उपयोग किया जाता है।
ZnO(s) + C(s) → Zn(s) + CO(g)
मध्यम अभिक्रियाशीलता वाली धातुओं के ऑक्साइडों का अपचयन करने के लिए सोडियम, कैल्शियम तथा एल्यूमीनियम जैसी अभिक्रियाशील धातुएँ भी अपचायक के रूप में उपयोग की जा सकती हैं।
3MnO2(s) + 4Al(s) → 3Mn (1) + 2Al2O3(s) + ऊष्मा
III. धातुओं का शुद्धिकरण धात्वीय ऑक्साइडों के अपचयन के बाद प्राप्त हुई धातुओं में कई प्रकार की अशुद्धियाँ होती हैं। इसलिए शुद्ध धातु प्राप्त करने के लिए इन अशुद्धियों को अलग करना बहुत ज़रूरी होता है। शुद्धिकरण के लिए अपनाई जाने वाली विधि अशुद्धियों और धातु के गुणों पर निर्भर करती है।
कुछ विधियों का विवरण नीचे दिया गया है –
1. आसवन विधि-कम उबाल दर्जे वाली धातुओं को इस विधि द्वारा शुद्ध किया जाता है। जिंक, कैल्शियम और मरकरी जैसी धातुएं शीघ्र वाष्प के रूप में बन जाती हैं इसलिए उन्हें आसवन विधि द्वारा शुद्ध किया जाता है।
2. गलनिक पृथक्करण-इस प्रक्रिया में ढलान युक्त भट्ठी का उपयोग किया जाता है। भट्ठी का ताप धातु के गलनांक से कुछ अधिक रखा जाता है। अशुद्ध धातु को भट्ठी के सबसे ऊपरी सिरे पर रखा जाता है। गर्म करने पर धातु तो पिघल कर नीचे की ओर बह जाती है जबकि ठोस अशुद्धियां वहीं रह जाती हैं। इस विधि द्वारा टिन, सीसा तथा बिस्मथ का परिष्करण किया जाता है।’
3. विद्युतीय शुद्धिकरण-धातुओं का परिष्करण धातुओं का शुद्धिकरण कहलाता है। तांबा, टिन, सीसा, सोना, जिंक, क्रोमियम तथा निक्कल जैसी शुद्ध धातु एनोड कैथोड की पट्टी को कैथोड तथा अशुद्ध धातु की पट्टी को एनोड के रूप में लिया जाता है। वैद्युत् अपघटय के अशुद्ध तांबे रूप में धातु का कोई लवण लिया जाता है।
‘जब की छड़ विदयुत् अपघटन सेल में से धारा प्रवाहित करते हैं तो धातु कैथोड पर जमा हो जाता है तथा एनोड पर स्थित अन्य अभिक्रियाशील धातुएं अपघट्य के घोल में पहुंच शुद्ध तांबे की छड़ कॉपर सल्फेट जाती हैं। कम अभिक्रियाशील धातुएं जैसे सोना तथा चांदी विद्युत् अपघटनी सेल की तली में गिर जाती हैं, चित्र-धातुओं के शदधिकरण के लिए विदयुत अपघटन जिन्हें प्राप्त कर लिया जाता है।
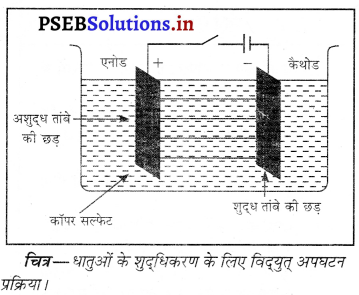
यदि तांबे को परिष्कृत करना हो तो विद्युत्-अपघटय के रूप में कॉपर सल्फेट का अम्लीकृत घोल किया जाता है तथा सैल में होने वाली अभिक्रियाएं निम्नलिखित होती हैं।
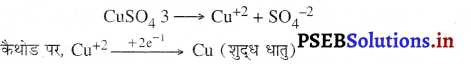
प्रश्न 4.
धातुओं एवं अधातुओं के बीच कैसे विभेद करेंगे ?
उत्तर-
धातुओं और अधातुओं के गुणों में विभेद
भौतिक गुणों में विभेद
| धातुएं (Metals) | अधातुएं (Non-Metals) |
| (1) धातुएं सामान्य ताप पर ठोस होती हैं परंतु केवल पारा सामान्य ताप पर तरल अवस्था में होता है। | (1) अधातुएं सामान्य ताप पर तीनों अवस्थाओं में पाई जाती हैं। फॉस्फोरस और सल्फर ठोस रूप में, H2, O2, N2 गैसीय रूप में तथा ब्रोमीन तरल रूप में होती हैं। |
| (2) धातुएं तन्य तथा आघातवर्ध्य तथा लगिष्णु होती हैं। | (2) वे प्रायः भंगुर होती हैं। |
| (3) धातुएं प्राय: चमकदार होती हैं अर्थात् उनमें धात्विक चमक होती है। | (3) अधातुओं में धात्विक चमक नहीं होती परंतु हीरा, ग्रेफाइट तथा आयोडीन इसके अपवाद हैं। |
| (4) धातुएं ऊष्मा तथा विद्युत् की सुचालक होती हैं परंतु बिस्मथ इसका अपवाद है। | (4) ग्रेफाइट और गैस कार्बन को छोड़कर सभी अधातुएं कुचालक हैं। |
| (5) धातुओं के गलनांक तर्थो क्वथनांक अत्यधिक होते | (5) अधातुओं के गलनांक तथा क्वथनांक कम होते हैं। |
| (6) धातुएं अधिकांशतः कठोर होती हैं परंतु सोडियम तथा पोटाशियम चाकू से काटी जा सकती हैं। | (6) इनकी कठोरता भिन्न-भिन्न होती हैं। हीरा सब पदार्थों से कठोरतम है। |
| (7) धातुओं का आपेक्षिक घनत्व अधिक होता है परंतु Na, K इसके अपवाद हैं। | (7) अधातुओं का आपेक्षिक ताप प्रायः कम होता है। |
| (8) धातुएं अपारदर्शक होती हैं। | (8) गैसीय अधातुएं पारदर्शक हैं। |
रासायनिक गुणों में विभेद
| धातुएं (Metals) | अधातुएं (Non-Metals) |
| (1) धातुएं क्षारीय ऑक्साइड बनाती हैं जिसमें से हैं। | (1) अधातुएं अम्लीय तथा उदासीन ऑक्साइड बनाती कुछ क्षार बनाती हैं। |
| (2) धातुएं अम्लों से अभिक्रिया करके हाइड्रोजन गैस पुनः स्थापित करती हैं तथा अनुरूप लवण बनाती हैं। | (2) अधातुएं अम्लों में से हाइड्रोजन गैस को पुनः स्थापित नहीं करती हैं। |
| (3) धातुएं धनात्मक आवेश की प्रकृति की होती हैं। | (3) अधातुएं ऋणात्मक आवेश की प्रकृति की होती हैं। |
| (4) धातुएं क्लोरीन से संयोग करके क्लोराइड बनाती हैं जो वैद्युत् संयोजक होते हैं। | (4) अधातुएं क्लोरीन से संयोग कर क्लोराइड बनाती हैं परंतु वे सहसंयोजक होते हैं। |
| (5) कुछ धातुएं हाइड्रोजन से संयोग करके हाइड्रोक्साइड बनाती हैं जो विद्युत् संयोजक होते हैं। | (5) अधातुएं हाइड्रोजन के साथ अनेक स्थाई हाइड्राइड बनाती हैं जो सहसंयोजक होते हैं। |
| (6) धातुएं अपचायक हैं। | (6) अधातुएं ऑक्सीकारक हैं। |
| (7) धातुएं जलीय विलयन में धनायन बनाती हैं। | (7) अधातुएं जलीय विलयन में ऋणायन बनाती हैं। |
प्रश्न 5.
संक्षरण से क्या भाव है ? धातुओं के संक्षारण से बचाने के लिए आप क्या करोगे ? (मॉडल पेपर)
उत्तर-
संक्षरण-अयस्क से प्राप्त धातु काफ़ी शुद्ध होती है तथा देखने में सुंदर दिखती है। प्रकृति इसे पुनः उसी रूप में परिवर्तित करने का यत्न करती है। जिस रूप में उसे प्राप्त किया जाता है।
धात्वीय सतह पर वातावरण की गैसें आदि की क्रिया से धात्वीय ऑक्साइड, सल्फाइड, कार्बोनेट और सल्फेट बनते हैं। इस तरह धातु धीरे-धीरे क्षरित होती रहती है। धातुओं के इस प्राकृतिक क्षरण को संक्षरण कहते हैं। आयरन के संक्षरण को जंग लगना भी कहते हैं। जंग लगना एक गंभीर आर्थिक समस्या है। जंग लाल भूरे रंग का एक पाऊडर होता है जो जलीय आयरन ऑक्साइड (Fe2O. xH2O) के रूप में होता है। लोहे को जंग लगने के लिए जल और ऑक्सीजन की उपस्थिति आवश्यकता होती है।

संक्षरण की रोकथाम के उपाय
- धातुओं को नमी (आर्द्रता) से बचा कर रखना चाहिए।
- धातुओं की ऊपरी सतह पर पेंट कर देना चाहिए ताकि इसकी सतह का ऑक्सीजन तथा नमी से संपर्क टूट जाए।
- धातु की सतह पर ग्रीस या तेल लगाना चाहिए।
- धातु पर किसी अन्य संक्षारण-रोधी धातु की परत चढ़ा देनी चाहिए।
- धातु को पिघले हुए ज़िंक में डुबो कर बाहर निकाल लेना चाहिए जिससे इस पर जिंक की परत जम जाए अर्थात् गैल्वनीकरण कर देना चाहिए।
प्रश्न 6.
लोहे का जंग लगने की क्रिया का विवरण दो और इससे बचाव के कोई दो ढंग बताओ।
अथवा
लोहे को जंग से बचाने (rusting of iron) के लिए किन्हीं पांच ढंगों का संक्षिप्त में वर्णन कीजिए।
अथवा
जंग लगना क्या है ? लोहे को जंग लगने से रोकने के लिए दो उपाय बताओ।
उत्तर-
लोहे का जंग लगना (Rusting of Iron)- यह क्रिया निम्नलिखित चरणों में पूरी होती है –
(i) आयरन इलैक्ट्रॉन खो देने पर फैरस आयन बनाता है।
Fe + 2e– → Fe2+
(ii) ये फैरस आयन ऑक्सीजन और जल के साथ क्रिया करके फैरिक ऑक्साइड की परत बनाते हैं तथा 8 हाइड्रोजन आयन मुक्त होते हैं।
4Fe2+ + O2 + 4H2O → 2Fe2O3 + 8H+ फैरिक ऑक्साइड
(iii) फैरिक ऑक्साइड जलयोजित (hydrate) होकर जंग बनाता है।
Fe2O3 + x H2O → Fe2O3. x H2Oजलयोजित फैरिक ऑक्साइड
(iv) हाइड्रोजन के आयन इलैक्ट्रॉन प्राप्त करके हाइड्रोजन गैस बनाते हैं।
8H+ + 8e– → 4H2
जंग न चिपकने वाला एक यौगिक है। यह परत के बाद दूसरी परत बनकर उड़ता रहता है। इस तरह जंग की एक परत उड़ने के बाद लोहे की मुक्त हुई परत पर फिर जंग लगने लगता है। इस तरह पूरा लोहा जंग से प्रभावित होकर नष्ट हो जाता है। जंग लगने की रोकथाम-संक्षरण एक आर्थिक समस्या है। मानवीय जीवन के लिए जंग लगना बहुत हानिकारक है।
![]()
इसकी रोकथाम के लिए निम्नलिखित विधियाँ हैं-
- पेंट करना-लोहे की वस्तुओं को पेंट करके या ग्रीस लगाकर जंग लगने से बचाया जा सकता है। ऐसा करने से लोहे की सतह का वातावरण की ऑक्सीजन से संपर्क टूट जाता है।
- धात्वीय परत चढ़ाना-लोहे की अपेक्षा अधिक सरलता से इलेक्ट्रॉन प्रदान करने वाली धातु की परत चढ़ाकर जंग लगने से रोका जा सकता है। उदाहरणस्वरूप जिंक धातु लोहे की अपेक्षा सरलता से इलेक्ट्रॉन मुक्त करती है। अतः लोहे की वस्तुओं पर जिंक की परत का लेप करके उन्हें जंग लगने से बचाया जा सकता है। इस क्रिया को जिस्तीकरण या गैल्वनीकरण (Galvanisation) कहते हैं।
- विदयतीय धारा दवारा बचाव-जंग लगते समय बनने वाले फैरस आयनों (Fe2+) को विदयुतीय धारा की सहायता से उदासीन किया जाता है। ऐसा करने के लिए जिस वस्तु को जंग से बचाना हो, उसे कैथोड से जोड़ कर विद्युतीय धारा गुज़ारी जाती है।
- जंगरोधी घोलों का उपयोग करके-फॉस्फेट और क्रोमेट के क्षारकीय विलयन जंग रोधी होते हैं। क्षारक की उपस्थिति के कारण आयन बनते हैं और ये आयन वस्तु का ऑक्सीकरण नहीं होने देते और इस तरह वस्तु ऑक्सीजन के संपर्क में नहीं आती। यह विलयन रेडीएटरों तथा इंजन के पुों को जंग लगने से बचाने के लिए प्रयुक्त होते हैं।
- निक्कल तथा क्रोमियम के साथ मिश्रण बनाकर-जब लोहे को निक्कल तथा क्रोमियम के साथ मिलाकर मिश्रित धातु तैयार की जाती है तो (Fe = 73%, Cr= 18%, Ni = 8%) स्टेनलेस स्टील बन जाता है। स्टेनलेस स्टील जंगरोधी होता है। इस प्रकार लोहे को जंग लगने से बचाया जा सकता है।
प्रश्न 7.
आयनिक यौगिकों के सामान्य गुणधर्मों का वर्णन कीजिए।
उत्तर-
आयनिक यौगिकों के सामान्य गुणधर्म ये निम्नलिखित हैं-
- भौतिक प्रकृति-धनात्मक एवं ऋणात्मक आयनों के बीच दृढ़ आकर्षण बल के कारण आयनिक यौगिक ठोस होते हैं। ये यौगिक प्रायः भंगुर होते हैं तथा दबाव देने पर टूट जाते हैं।
- द्रवनांक और क्वथनांक-आयनिक यौगिकों का द्रवनांक और क्वथनांक बहुत अधिक होता है क्योंकि इसके मज़बूत अंतर आयनिक आकर्षण को तोड़ने के लिए ऊर्जा की बहुत बड़ी मात्रा की ज़रूरत होती है।
- विलयशीलता-संयोजक यौगिक प्रायः जल में विलयशील तथा केरोसीन, पेट्रोल आदि जैसे विलायक में अविलयशील होते हैं।
- विद्युत् चालकता-किसी विलयन से विद्युत् के चालन के लिए आवेशित कणों की गतिशीलता ज़रूरी होती है। आयनिक यौगिकों के जलीय विलयन में आयन विद्यमान होते हैं।
जब विलयन में से विद्युत् गुज़ारी जाती है तो ये आयन विपरीत इलेक्ट्रोड की ओर गति करने लगते हैं। ठोस अवस्था में आयनिक यौगिक विद्युत् का चालन नहीं करते हैं क्योंकि ठोस अवस्था के दृढ़ संरचना के कारण आयनों की गति संभव नहीं होती है परंतु आयनिक यौगिक द्रवित अवस्था में विद्युत् का चालन करते हैं क्योंकि द्रवित अवस्था में विपरीत आवेश वाले आयनों के मध्य विद्युत् स्थैतिक आकर्षण बल, ऊष्मा के कारण काफ़ी शिथिल हो जाता है। इसलिए आयन स्वतंत्र रूप से गमन करते हैं एवं विद्युत् का संवहन करते हैं।
प्रश्न 8.
मिश्र धातु किसे कहते हैं ? इनके बनाने के उद्देश्यों का वर्णन करो।
उत्तर-
मिश्र धातु (Alloys)- किसी धातु का किसी अन्य धातु या अधातु के साथ मिलाकर बनाया गया समांगी मिश्रण मिश्र धातु कहलाता है। जैसे टांका में कलई तथा सीसा (लैड) सामान मात्रा में मिलाया जाता है। उदाहरण के लिए स्टेनलेस स्टील, टांका, पीतल, कांसा, बैलमैटल आदि सभी मिश्र धातु हैं।
मिश्र धातुओं के उपयोग-
- कठोरता बढ़ाने के लिए-लोहे में कार्बन की मात्रा मिला कर स्टेनलेस स्टील बनाया जाता है जो लोहे से अधिक कठोर होता है। सोने में तांबा तथा चांदी में सीसा मिलाने से उसकी कठोरता अधिक हो जाती है। ड्यूरेलियम, एल्यूमीनियम से बना एक मिश्र धातु है जो अत्याधिक कठोर होता है।
- शक्ति बढ़ाने के लिए-इस्पात, ड्यूरेलियम आदि मिश्रधातु कठोर होने के कारण शक्तिशाली भी होते हैं।
- संक्षारण रोकने के लिए-जैसे स्टनलैस स्टील, लोहे तथा जिंक से बनी मिश्र धातु पर जंग नहीं लगता।
- ध्वनि उत्पन्न करने के लिए-तांबे तथा कलई से बनाई गई मिश्र धातु बैलमैटल होती है जिससे अधिक ध्वनि उत्पन्न की जाती है।
- गलनांक कम करने के लिए-जैसे रोज-मैटल मिश्र धातु है। इसका गलनांक कम होता है। यह बिस्मथ, कलई और सीसे से बनती है।
- उचित सांचे में ढालने के लिए-कांसा तथा टाइप मैटल।
- रंग परिवर्तन के लिए-तांबे तथा एल्यूमीनियम से बनी एल्यूमीनियम ब्रांज मिश्रधातु का रंग सुनहरी होता है।
- घरेलू उपयोग–घरों, कारखानों, दफ्तरों में सभी जगह मिश्रधातुओं का उपयोग होता है जैसे घर के बर्तन, अलमारी, पंखे, फ्रिज, आभूषण आदि में मिश्रधातुओं का उपयोग होता है।
प्रश्न 9.
धातुओं की अभिक्रियाशीलता क्रम का वर्णन कीजिए।
उत्तर-
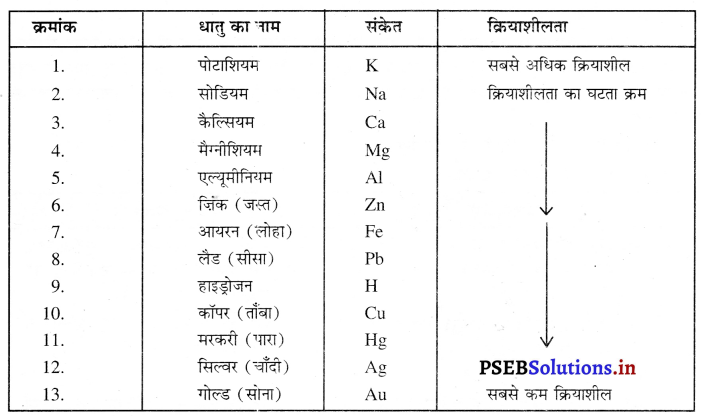
धातुओं की अभिक्रियाशीलता क्रम-सभी धातुओं की अभिक्रियाशीलता की दर भिन्न-भिन्न होती है। कुछ धातुएं जैसे सोडियम, पोटाशियम तथा कैल्शियम आदि अत्यधिक क्रियाशील हैं। ये धातुएं ऑक्सीजन से संयोग करके ऑक्साइड तथा हाइड्रोजन से अभिक्रिया करके हाइड्राइड बनाती हैं। कुछ धातुएं अपेक्षाकृत कम अभिक्रियाशील होती हैं जैसे-लोहा, जिंक आदि परंतु कुछ धातुएं बिलकुल कम क्रियाशील होती हैं जैसे सोना, चांदी। धातुओं की अभिक्रियाशीलता उनके इलेक्ट्रॉन देने की प्रवृत्ति पर निर्भर करती है। धातुओं को अभिक्रियाशीलता के आधार पर उनकी क्रियाशीलता के घटते क्रम के अनुसार लिखा जाता है जिसे धातुओं की अभिक्रियाशीलता क्रम कहते हैं।
अभिक्रियाशीलता क्रम में धातुएं-
प्रश्न 10.
धातुओं के तीन भौतिक तथा दो रासायनिक गुण लिखो। उत्तर-
धातुओं के भौतिक गुणधर्म-
- धात्विक चमक-शुद्ध धातुओं की सतहें चमकीली होती है। इस गुणधर्म को धात्विक चमक (metallic lustre) कहते हैं ; जैसे-सोने में पीले रंग की, ताँबे में लाल-भूरे रंग की, एल्यूमीनियम में सफेद रंग की चमक होती है।
- कठोरता-धातुएँ सामान्यतः कठोर होती हैं। विभिन्न धातुओं की कठोरता भिन्न-भिन्न होती है। कॉपर (ताँबा), आयरन (लोहा), एल्यूमिनियम अत्यंत कठोर धातुएँ हैं, जबकि सोडियम, पोटैशियम मृदु धातुएँ हैं।
- आघातवर्ध्यता- जो धातुएँ हथौड़े द्वारा पीट-पीट कर पतली चादरों में परिवर्तित हो जाती हैं आघातवर्धनीय कहलाती हैं। इस गुणधर्म को आघातवर्ध्यता (malleability) कहते हैं। सोना तथा चाँदी सर्वाधिक आघातवर्धनीय धातुएँ हैं।
- तन्यता- वे धातुएँ जिनसे अत्यंत पतले तार खींचे जा सकते हैं, तन्य कहलाती हैं तथा इस गुणधर्म को तन्यता (ductility) कहते हैं। सोना तथा चाँदी सर्वाधिक तन्य धातुएँ हैं।
- उष्मीय चालकता-धातुएँ सामान्यतः ऊष्मा की सुचालक होती हैं। चाँदी ऊष्मा की सर्वश्रेष्ठ सुचालक है। अन्य धातुएँ जो ऊष्मा की सुचालक हैं के उदाहरण कॉपर, एल्यूमीनियम आदि हैं।
- वैद्युत् चालकता-धातुएँ विद्युत् की सुचालक होती हैं। सिल्वर, कॉपर आदि विद्युत् की सुचालक हैं।
धातुओं के रासायनिक गुणधर्म
1. धातुओं की ऑक्सीजन से अभिक्रिया-सभी धातुएँ ऑक्सीजन से संयोग करके धात्विक ऑक्साइड बनाती हैं। क्योंकि सभी धातुओं की अभिक्रियाशीलता भिन्न-भिन्न है। इसलिए वे अलग-अलग ताप पर ऑक्सीजन से संयोग करते हैं।
(i) सामान्य ताप पर Na तथा K ऑक्सीजन से संयोग करके ऑक्साइड बनाते हैं जो पानी में घुलने पर हाइड्रोक्साइड बनाते हैं।
4Na (s) + O2 (g) → 2Na2O (s)
Na2O (s) + H2O → 2NaOH (aq)
(ii) मैग्नीशियम रिबन वायु में जलकर मैग्नीशियम ऑक्साइड बनाता है।
![]()
(iii) तांबा तथा लोहा शुष्क वायु में उच्च तापक्रम पर ऑक्सीजन से संयोग करते हैं।

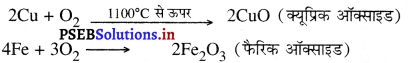
2. धातुओं की तनु अम्लों से अभिक्रिया-धातुएं तनु अम्लों से अभिक्रिया करके हाइड्रोजन गैस मुक्त करती हैं। विभिन्न धातुओं अम्लों के साथ अभिक्रियाशीलता की दर भिन्न-भिन्न होती है।
(i) Na, K, Zn, Mg, Fe आदि अवरोही क्रम में अभिक्रियाशील हैं।
2Na + 2HCl → 2NaCl + H2↑
Mg + 2HCl → MgCl2+ H2↑
Zn + H2SO4 → ZnSO4 + H2↑
(ii) तनु नाइट्रिक अम्ल Cu, Ag, Pb, Hg धातुओं के साथ क्रिया करके NO (नाइट्रोजन ऑक्साइड) बनाता
3Cu + 8HNO3 → 3Cu (NO3)2 + 2NO + 4H2O
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
(iii) Mg तथा Mn के साथ तनु नाइट्रिक अम्ल हाइड्रोजन गैस मुक्त करते हैं।
Mg + 2HNO3 → Mg(NO3)2 + H2 ↑
(iv) सोना तथा प्लाटीनम तनु अम्ल से अभिक्रिया नहीं करते।
3. धातुओं की क्लोरीन से अभिक्रिया-धातुएं, क्लोरीन से संयोग करके अपने क्लोराइड बनाती हैं।
Ca + Cl2 → CaCl2
4. धातुओं की हाइड्रोजन से अभिक्रिया-क्रियाशील धातुएं Na, K, Ca आदि हाइड्रोजन से संयोग करके अपने हाइड्राइड बनाती हैं।
2Na + H2 → 2NaH (सोडियम हाइड्राइड)
Ca + H2 → CaH2 (कैल्शियम हाइड्राइड)
5. धातुओं की पानी से अभिक्रिया –
(i) जब पानी सामान्य ताप पर हो तो Na, K, Ca आदि क्रिया करके हाइड्रोजन गैस मुक्त करती है।

(ii) जब पानी उबलता हो तो Mg, Zn, Fe अभिक्रिया करके ऑक्साइड बनाते हैं।
Mg + H2O → MgO + H2↑
3Fe + 4H2O → Fe3O4 + 4H2↑
लघु उत्तरात्मक प्रश्न (Short Answer Type Questions)
प्रश्न 1.
दो धातुओं के नाम बताओ जो ऊष्मा तथा विद्युत् की सुचालक हों। ऊष्मा की सबसे अधिक तथा सबसे कम चालक धातुओं के नाम लिखो।
उत्तर-
कॉपर और एल्यूमीनियम दोनों धातुएं ऊष्मा और विद्युत् की सुचालक हैं। चांदी ऊष्मा की सर्वोत्तम चालक है जबकि सीसा धातुओं में सबसे कम चालक है।
प्रश्न 2.
धातुओं की तन्यता गुण को उदाहरण सहित परिभाषित करें।
उत्तर-
तन्यता- धातु के पतले तार के रूप में खींचने की क्षमता को तन्यता कहा जाता है। सोना सबसे अधिक तन्य धातु है।
प्रश्न 3.
धातुओं का कौन-सा गुण उनको लाक्षणिक रासायनिक गुण प्रदान करता है ?
उत्तर-
धातुएं अपने इलेक्ट्रॉन को खोकर धनात्मक आयन बनाती हैं, इसलिए ये विद्युत् धनात्मक तत्व हैं। धातुओं का यह आयनीकरण गुण उनको रासायनिक गुण प्रदान करता है। जैसे-Mg धातु को इलेक्ट्रॉन खोकर Mg का धनात्मक आयन बनाता है।
Mg →Mg2+ + 2e
![]()
प्रश्न 4.
आयनिक यौगिक किस अवस्था में पाए जाते हैं ? आयनिक यौगिकों के क्वथनांक एवं द्रवनांक पर टिप्पणी लिखिए।
उत्तर-
धातु से अधातु में इलेक्ट्रॉन के स्थानांतरण द्वारा बने यौगिकों को आयनिक यौगिक या वैद्युत् संयोजक यौगिक कहते हैं। उदाहरण-NaCl, CaCl2, CaO, MgCl2, | आयनिक यौगिकों का क्वथनांक एवं द्रवनांक बहुत अधिक होता है क्योंकि इसके मज़बूत अंतर आयनिक आकर्षण को तोड़ने के लिए ऊर्जा की अत्याधिक मात्रा की आवश्यकता होती है।
प्रश्न 5.
खनिज और अयस्क में अंतर लिखिए।
उत्तर-
खनिज और अयस्क में अंतर –
| खनिज (Minerals) | अयस्क (Ores) |
| (1) जिन प्राकृतिक पदार्थों में धातुओं के यौगिक पाए जाते हैं वह खनिज कहलाते हैं। | (1) जिन खनिजों से लाभदायक तथा सुविधापूर्वक ढंग से धातुएँ प्राप्त की जा सकती हैं उन खनिजों को अयस्क कहते हैं। |
| (2) अनेक खनिजों में धातु की प्रतिशत मात्रा काफ़ी बड़ी मात्रा होती है जबकि अन्य में धातु की प्रतिशत मात्रा बहुत कम होती है। | (2) धातुओं की प्रतिशत मात्रा सभी अयस्कों में पर्याप्त होती है। |
| (3) कुछ खनिजों में बहुत अधिक अशुद्धियाँ होती हैं जो धातु के निष्कर्षण में रुकावट डालती हैं। | (3) अयस्कों में कोई भी आपत्तिजनक अशुद्धियाँ नहीं होती। |
| (4) सभी खनिजों को धातु निष्कर्षण के लिए उपयोग नहीं किया जा सकता। सभी खनिज अयस्क नहीं होते। | (4) सभी अयस्कों को धातु निष्कर्षण के लिए उपयोग किया जा सकता है। |
प्रश्न 6.
विभिन्न धातुओं की जल के साथ अभिक्रिया का वर्णन करें।
उत्तर-
धातुओं की जल के साथ अभिक्रिया-जल के साथ अभिक्रिया करके धातु, हाइड्रोजन गैस तथा धातु ऑक्साइड बनाते हैं। ये जल में घुलकर धातु हाइड्रोक्साइड बनाते हैं परंतु सभी धातु जल के साथ अभिक्रिया नहीं करते हैं। पोटैशियम एवं सोडियम जैसे धातु ठंडे जल के साथ तेज़ अभिक्रिया करते हैं। सोडियम तथा पोटैशियम की अभिक्रिया इतनी तेज़ तथा ऊष्माक्षेपी होती है कि इससे उत्सर्जित हाइड्रोजन तत्काल आग पकड़ लेती है।
2K (s) + 2H2O (l) → 2KOH (aq) + H2 (g) + ऊष्मीय ऊर्जा
2Na (s) + 2H2O (l) → 2NaOH (aq) + H2 (g) + ऊष्मीय ऊर्जा
जल के साथ कैल्सियम की अभिक्रिया थोड़ी मंद होती है। इसमें उत्सर्जित ऊष्मा हाइड्रोजन के प्रज्वलित होने के लिए पर्याप्त नहीं होती है। .
Ca (s) + 2H2O (l) → Ca (OH)2(aq) + H2 (g)
एल्यूमीनियम, लोहा तथा जिंक जैसे धातु न तो ठंडे जल के साथ और न ही गर्म जल के साथ अभिक्रिया करते हैं। लेकिन भाप के साथ अभिक्रिया करके यह धातु ऑक्साइड तथा हाइड्रोजन प्रदान करते हैं।
2Al (s) + 3H2O (g) → Al2O3 (s) + 3H2(g)
3Fe (s) + 4H2 O (g)→ Fe3O4 (s) + 4H2 (g)
सीसा, कॉपर, चांदी तथा सोना आदि जैसे धातु जल के साथ अभिक्रिया नहीं करते हैं।
प्रश्न 7.
अधातुओं की निम्नलिखित के साथ अभिक्रियाएं लिखिए(a) ऑक्सीजन (b) अम्ल (c) क्लोरीन (d) हाइड्रोजन।
उत्तर-
अधातुएं वैद्युत् ऋणात्मक होती हैं। वे इलेक्ट्रॉनों को आसानी से ग्रहण कर लेती हैं तथा ऋणात्मक रूप से आवेशयुक्त आयन बनाती हैं।
(a) अधातुओं की ऑक्सीजन से अभिक्रिया-अधातुएँ ऑक्सीजन से संयोग करके सहसंयोजक ऑक्साइड बनाती हैं, जो पानी में घुलने पर अम्ल बनाती है।
C+ O2 → CO2
CO2 + H2O → H2CO3 (कार्बोनिक अम्ल)
(ii) S+ O2 → SO2
SO2 + H2O → H2SO (सल्फ्यू रस अम्ल)
(iii)
2H2 + O2 → 2H2O (उदासीन ऑक्साइड)
2C + O2 → 2CO (उदासीन ऑक्साइड)
(b) अम्लों से अभिक्रिया-अधातुएं अम्लों में हाइड्रोजन को पुनः स्थापित नहीं करती हैं। इस प्रक्रिया को पूर्ण करने के लिए अम्ल H+ आयन के लिए इलेक्ट्रॉन उपलब्ध होने चाहिएं परंतु अधातु स्वयं इलेक्ट्रॉनों को ग्रहण करती हैं। अतः वे H+ आयन को इलेक्ट्रॉन उपलब्ध नहीं करा सकती हैं। इसलिए अधातुओं की तनु अम्ल के साथ कोई अभिक्रिया नहीं होती है।
(c) क्लोरीन के साथ अभिक्रिया-क्लोरीन के साथ अधातुएं सहसंयोजक आबंध वाले क्लोराइड बनाती हैं।
2P2 + 6Cl2 → 4PCl3 (फॉस्फोरस ट्राइक्लोराइड)
![]()
C + 2Cl2 → CCl4 (कार्बन टेट्राक्लोराइड)
(d) हाइड्रोजन के साथ अभिक्रिया-अधातुएं, हाइड्रोजन के साथ क्रिया करके हाइड्राइड बनाती हैं।
H2 + S → HS (हाइड्रोजन सल्फाइड)
H+ Cl2 → 2HCl (हाइड्रोजन क्लोराइड)
C + 2H2 → CH4 (मीथेन)
ये हाइड्राइड इलेक्ट्रॉनों की साझेदारी (सहसंयोजन आबंध) से बनते हैं।
प्रश्न 8.
भर्जन क्रिया क्या है ? इसका उपयोग कब किया जाता है ? इसमें होने वाले परिवर्तनों के लिए रासायनिक क्रियाएं लिखो।
उत्तर-
भर्जन प्रक्रिया (Roasting)-सांद्रण के पश्चात् अयस्क को वायु की उपस्थिति में गर्म करना भर्जन प्रक्रिया कहलाता है। जिंक तथा सीसा के सल्फाइडों को उनके ऑक्साइड में बदलने के लिए भर्जन प्रक्रिया प्रयुक्त की जाती है।
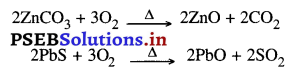
प्रश्न 9.
यदि सिल्वर नाइट्रेट के घोल में कॉपर की पत्ती को कुछ देर के लिए डुबो कर रखा जाए तो क्या होता है ? हो रही क्रिया का आयनी समीकरण भी लिखो।
उत्तर-
कॉपर, सिल्वर से अधिक क्रियाशील है। जब कॉपर की पत्ती को कुछ देर के लिए सिल्वर नाइट्रेट के घोल में डुबो कर रखा जाता है तो सिल्वर निम्नलिखित क्रिया द्वारा जमा (deposit) हो जाती है और घोल का रंग नीला हो जाता है।

प्रश्न 10.
कॉपर सल्फेट के घोल को लोहे के बर्तन में रखने से कुछ दिनों पश्चात् बर्तन में कुछ छिद्र हो गए। इस अभिक्रिया को लिखिए। इस अभिक्रिया को अभिक्रियाशीलता के आधार पर स्पष्ट कीजिए।
उत्तर-
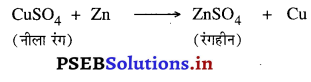
अभिक्रियाशीलता के क्रम में लोहा पहले आता है अर्थात् लोहा, कॉपर की अपेक्षा अधिक क्रियाशील है। इसलिए CuSO, के घोल में से लोहा, कॉपर को विस्थापित कर देता है, जिसके कारण लोहे के बर्तन में छिद्र हो जाते हैं। रासायनिक अभिक्रिया
CuSO4 + Fe → FeSO4 + Cu
Cu2+ (aq) + Fe (s) →Fe+2(aq) + Cu (s)
प्रश्न 11.
कॉपर को वायु में खुला छोड़ने पर वह हरे रंग का हो जाता है। क्यों ?
उत्तर-
कॉपर, वायु में उपस्थित आर्द्र कार्बन डाइऑक्साइड के साथ अभिक्रिया करता है, जिससे इसकी सतह से भूरे रंग की चमक धीरे-धीरे खत्म हो जाती है तथा इस पर हरे रंग की परत चढ़ जाती है। यह हरा पदार्थ कॉपर कार्बोनेट होता है।
Cu + CO2 + H2O + O2 → CuCO3.Cu(OH)2
प्रश्न 12.
24 कैरेट सोना क्या है ?
उत्तर-
24 कैरेट सोना-शुद्ध सोने को 24 कैरेट कहते हैं तथा ये काफ़ी नर्म होता है। इसलिए आभूषण बनाने के लिए ये उपयुक्त नहीं होता है। इसे कठोर बनाने के लिए चाँदी या कॉपर के साथ मिलाया जाता है। हमारे देश में प्रायः आभूषण बनाने के लिए 22 कैरेट सोने का उपयोग होता है। इसका मतलब है कि 22 भाग शुद्ध सोने में 2 भाग कॉपर या चाँदी मिश्रित की जाती है।
प्रश्न 13.
सल्फाइड अयस्क को सांद्रण करने में उपयोग होने वाले प्रक्रम का नाम बताइए। सांद्रित सल्फाइड अयस्क को धातु में बदलने में उपयोग होने वाले दो चरणों का संक्षिप्त वर्णन करो।
उत्तर-
सल्फाइड अयस्क के बड़े टुकड़ों को बारीक पीसकर, चूर्ण बना लिया जाता है। अब इसको ‘झाग प्लावन विधि’ द्वारा सांद्रित कर लिया जाता है। सांद्रित सल्फाइड अयस्क को धातु में बदलने के लिए निम्नलिखित दो चरण इस प्रकार हैं-
1. भर्जन- सांद्रित अयस्कों को वायु की उपस्थिति में गर्म करके ऑक्साइडों में परिवर्तित कर लिया जाता है। इस विधि को भर्जन कहते हैं।
![]()
2. अपचयन-सांद्रित अयस्क के ऑक्साइड को अपचायक के साथ गर्म करने से धातु ऑक्सीजन से मुक्त हो जाती है।
ZnO + C → Zn + CO
प्रश्न 14.
कोई अयस्क गर्म करने पर सल्फर डाइऑक्साइड (SO2) गैस देता है। ऐसे अयस्क से धातु निकालने में सम्मिलित नियम को संक्षेप में लिखो।
उत्तर-
कॉपर धातु के अयस्क कॉपर पाइराइट को गर्म करने पर SO2 गैस बनती है। इस अयस्क से धातु प्राप्त करने के लिए निम्नलिखित चरण अपनाए जाते हैं
(i) अयस्क को बारीक चूर्ण करके इसमें पानी तथा पाइन आयल मिला दिया जाता है। अब इसमें से वायु को उच्च दाब अधीन प्रवाहित किया जाता है ताकि अशुद्धियां अलग हो जाएं। इस प्रकार अयस्क सांद्रित हो जाती है। यह विधि झाग प्लावन विधि कहलाती है।
(ii) अब सांद्रित अयस्क को भर्जित किया जाता है जबकि CuS का कुछ भाग CuO में बदल जाता है।
![]()
कुछ समय पश्चात् वायु की आपूर्ति रोक दी जाती है।
![]()
इस प्रकार प्राप्त तांबा तरल अवस्था में है और इसे वैद्युत् परिष्करण विधि द्वारा शुद्ध किया जाता है।
(iii) वैद्युत् परिष्करण-इस प्रक्रिया में अशुद्ध कॉपर की छड़ एनोड पर तथा शुद्ध कॉपर की प्लेट कैथोड बनाकर अम्ल की उपस्थिति में कॉपर सल्फेट में से विद्युत् गुजारी जाती है।

प्रश्न 15.
थर्मिट अभिक्रिया से क्या तात्पर्य है ? लिखिए।
उत्तर-
कुछ विस्थापन अभिक्रियाएं बहुत अधिक ऊष्माक्षेपी होती हैं। इन अभिक्रियाओं में उत्सर्जित ऊष्मा की मात्रा इतनी अधिक होती है कि धातुएँ गलित अवस्था में प्राप्त होती हैं। जब आयरन (III) ऑक्साइड (Fe2O3) के साथ एल्यूमीनियम की अभिक्रिया की जाती है तो अत्याधिक ऊष्मा उत्पन्न होती है।
Fe2O3(s) + 2Al (s) → 2Fe(I) + Al2O3 (s) + ऊष्मा
इसे थर्मिट अभिक्रिया कहते हैं। इसके उपयोग से रेलवे पटरियों और मशीनी दरारों को जोड़ा जाता है।
![]()
प्रश्न 16.
अधातुओं के पाँच प्रमुख उपयोग लिखिए।
उत्तर-
अधातुओं के उपयोग-
- हाइड्रोजन को वनस्पति तेलों से वनस्पति घी बनाने में प्रयुक्त किया जाता है।
- कार्बन प्रमुख अधातु है जो हमें विटामिन, प्रोटीन, कार्बोहाइड्रेट्स, एंजाइम आदि प्रदान करती है। ग्रेफाइट विभिन्न प्रकार के सैलों में इलेक्ट्रोड के रूप में प्रयुक्त होता है।
- नाइट्रोजन का उपयोग अमोनिया, नाइट्रिक अम्ल और उर्वरक बनाने में होता है। वायु में नाइट्रोजन की उपस्थिति दहन की दर को नियंत्रित करती है।
- ऑक्सीजन की उपस्थिति हमारे जीवन का आधार है। दहन क्रिया भी इसी की उपस्थिति के कारण संभव होती है।
- गंधक अनेक प्रकार की दवाइयां तथा बारूद बनाने में काम आती है।
प्रश्न 17.
भर्जन और निस्तापन में अंतर लिखिए।
उत्तर-
भर्जन और निस्तापन में अंतर –
| भर्जन (Roasting) | निस्तापन (Calcination) |
| (1) भर्जन का प्रयोग सल्फाइड अयस्कों के लिए अयस्कों के लिए किया जाता है। | (1) निस्तापन का प्रयोग कार्बोनेट और हाइड्रेटिड किया जाता है। |
| (2) भर्जन में अयस्क को वायु की उपस्थिति में गर्म किया जाता है। | (2) निस्तापन में अयस्क को वायु की अनुपस्थिति में गर्म किया जाता है। |
| (3) इसमें SO2 गैस उत्पन्न होती है। | (3) इसमें CO2 गैस उत्पन्न होती है। |
| (4) उदाहरण सांद्रित जिंक के अयस्क को वाय की उपस्थिति में गर्म करके जिंक ऑक्साइड में परिवर्तित किया जाता है। | (4) उदाहरण-जिंक कार्बोनेट अयस्क को वाय की अनुपस्थिति में गर्म करके जिंक ऑक्साइड में परिवर्तित किया जाता है। |
प्रश्न 18.
आयनिक यौगिक सोडियम क्लोराइड, सोडियम और क्लोरीन से कैसे बनता है ?
उत्तर-
सोडियम आयन और क्लोराइड आयन विपरीत आवेशित होने के कारण एक-दूसरे की ओर आकृष्ट होते हैं और मज़बूत. स्थिर वैद्युत् बल से बंध कर सोडियम क्लोराइड (NaCl) के रूप में उपस्थित रहते हैं। सोडियम क्लोराइड अणु के रूप में नहीं पाया जाता बल्कि यह विपरीत आयनों का समुच्चय होता है।

प्रश्न 19.
विद्युत् अपघटनी शोधन से आप क्या समझते हैं ?
उत्तर-
विद्युत् अपघटनी शोधन-कॉपर, जिंक, टिन, निक्कल, चाँदी, सोना आदि जैसी अनेक धातुओं का शोधन विद्युत् अपघटन द्वारा किया जाता है। इस प्रक्रिया में अशुद्ध धातु को ऐनोड तथा शुद्ध धातु की पतली परत को कैथोड बनाया जाता है। धातु के लवण विलयन का उपयोग विद्युत्-अपघट्य के रूप में होता है। विद्युत्अपघट्य में से जब विद्युत् धारा प्रवाहित होती है तब एनोड पर स्थित शुद्ध धातु विद्युत् अपघट्य में घुल जाती है तथा इतनी ही मात्रा में शुद्ध धातु विद्युत्-अपघट्य से कैथोड पर निक्षेपित हो जाती है। विलयशील अशुद्धियाँ विलयन में चली जाती हैं तथा अविलयशील अशुद्धियाँ ऐनोड के नीचे निक्षेपित हो जाती हैं जिसे ऐनोड अवपंक कहते हैं।
प्रश्न 20.
अपचयन प्रक्रिया से क्या तात्पर्य है ? धातुओं के निष्कर्षण में इस प्रक्रिया की कौन-कौन सी विधियां अपनाई जाती हैं ?
उत्तर-
अपचयन (Reduction)-धातुओं के यौगिकों से धातु प्राप्त करने की प्रक्रिया अपचयन कहलाती है। धातुओं की अभिक्रियाशीलता श्रेणी के अनुसार ही विभिन्न धातुओं के लिए निम्नलिखित विधियां अपनाई जाती हैं-
(1) अभिक्रियाशीलता क्रम में नीचे आने वाली धातुओं को केवल वायु में गर्म करने पर ही धातु प्राप्त हो जाती है। जैसे–पारे का अयस्क सिनाबार वायु में गर्म करने पर भर्जित होकर पारा मुक्त कर देता है।
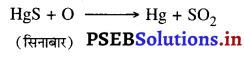
(2) अभिक्रियाशीलता के मध्य में आने वाली धातुओं के यौगिकों को मुख्यतः कोक से गर्म करके अपचयित किया जाता है। जैसे-लोहा, जिंक, निकिल, टिन धातुएं आदि।।
2ZnO2 + C → 2Zn + CO2
(3) कुछ धातुओं का अपचयन अधिक क्रियाशील धातु द्वारा किया जाता है। जैसे-मैंगनीज़ ऑक्साइड को एल्यूमीनियम द्वारा अपचयित करके मैंगनीज़ प्राप्त किया जाता है।
3MnO2 + 4Al → 3Mn + 2Al2O3
प्रश्न 21.
सोडियम हाइड्रोक्साइड के भंडारण के लिए एल्यूमीनियम के बर्तनों का उपयोग क्यों नहीं किया जाता ?
उत्तर-
सोडियम हाइड्रोक्साइड के भंडारण के लिए एल्यूमीनियम के बर्तनों का उपयोग नहीं किया जाता क्योंकि एल्यूमीनियम सोडियम हाइड्रॉक्साइड के साथ क्रिया करके घुलनशील लवण बनाता है।

प्रश्न 22.
एल्यूमीनियम के उपयोग बताओ।
उत्तर-
एल्यूमीनियम के उपयोग –
- एल्यूमीनियम हल्की धातु होने के कारण, हवाई जहाज़ों की बॉडी और मोटर इंजन बनाने के काम आती है।
- एल्यूमीनियम बर्तन, फोटोफ्रेम तथा घरेलू उपयोग की अनेक वस्तुएं बनाने के काम आती हैं।
- एल्यूमीनियम बिजली का सुचालक है इसलिए आजकल बिजली के संचारण के लिए प्रयुक्त बिजली की तारें बनाने के काम आता है।
- एल्यूमीनियम की पत्तियां खाने का सामान, दवाइयां, दूध की बोतलें आदि पैक करने में प्रयुक्त की जाती हैं।
- एल्यूमीनियम पाउडर सिल्वर पेंट बनाने के काम आता है।
- एल्यूमीनियम पाउडर एलुमिनो-थरैमी में प्रयुक्त होता है। यह प्रक्रम लोहे की पटरियों तथा मशीनों के टूटे भागों को जोड़ने के काम आता है।
प्रश्न 23.
क्या होता है, जब :
(i) लोहे के ऑक्साइड को कोक से मिलाकर गर्म किया जाता है।
(ii) मैग्नीशियम को तनु लवण के अम्ल से मिलाया जाता है ?
(iii) नीले थोथे के घोल में ज़िंक मिलाया जाता है ?
उत्तर-
(i) लोहे के ऑक्साइड को कोक से मिलाकर जब गर्म किया जाता है तो लोहे का ऑक्साइड अपचयित होकर लोहे में परिवर्तित हो जाता है।
C+O2 → CO2
CO2 + C → 2CO
Fe2O3 + 3CO → 2Fe + 3CO2
(ii) जब मैग्नीशियम को तनु लवण अम्ल से मिलाया जाता है तब हाइड्रोजन गैस उत्पन्न होती है।
![]()
(iii) जब नीले थोथे के विलयन में ज़िंक मिलाया जाता है तब विलयन का नीला रंग समाप्त हो जाता है।
![]()
प्रश्न 24.
एक क्रिया-कलाप द्वारा दर्शाओ कि लोहे को जंग लगने के लिए पानी और ऑक्सीजन की आवश्यकता होती है ?
अथवा
प्रयोग द्वारा सिद्ध करो कि लोहे को जंग लगने के लिए हवा/ऑक्सीजन तथा नमी का होना आवश्यक है। चित्र भी बनाएं।
उत्तर-
क्रिया-कलाप–तीन परखनलियां ‘A’, ‘B’ और ‘C’ लें। ‘क’ परखनली में लोहे की कुछ कीलें डालें। ‘क’ में पानी डालें। ‘C’ परखनली में कुछ कीलें डालो तथा उसमें कैल्शियम क्लोराइड डालो।
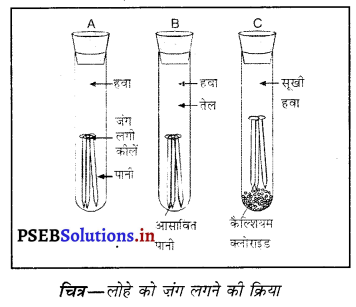
हवा कैल्शियम क्लोराइड एक जल अवशोषक पदार्थ है। जंग ‘B’ परखनली में कुछ कीलें डालकर, इसमें पानी लगी कीलें डालो। साथ में कुछ तेल भी डालो। कुछ दिन बाद पानी आप देखोगे कि परखनली ‘A’ में पड़ी कीलों को जंग लगना शुरू हो गया। परंतु ‘B’ तथा ‘C’ में रखी कीलों
आसावित पर जंग नहीं लगता क्योंकि ‘B’ में रखी कीलों को क्लोराइड आक्सीजन तथा ‘C’ में पड़ी कीलों को नमी प्राप्त नहीं होती। ‘A’ परखनली में पड़ी कीलों को ऑक्सीजन चित्र-लोहे को जंग लगने की क्रिया तथा पानी (नमी) दोनों प्राप्त होते हैं।
प्रश्न 25.
मिश्रधातु क्या होती है ? यह क्यों बनाई जाती हैं ?
उत्तर-
मिश्र धातु (Alloys)- किसी धातु का किसी अन्य धातु या अधातु के साथ मिलाकर बनाया गया समांगी मिश्रण मिश्र धातु कहलाता है। जैसे टांका में कलई तथा सीसा (लैड) सामान मात्रा में मिलाया जाता है। उदाहरण के लिए स्टेनलेस स्टील, टांका, पीतल, कांसा, बैलमैटल आदि सभी मिश्र धातु हैं।
मिश्र धातुओं के उपयोग-
- कठोरता बढ़ाने के लिए-लोहे में कार्बन की मात्रा मिला कर स्टेनलेस स्टील बनाया जाता है जो लोहे से अधिक कठोर होता है। सोने में तांबा तथा चांदी में सीसा मिलाने से उसकी कठोरता अधिक हो जाती है। ड्यूरेलियम, एल्यूमीनियम से बना एक मिश्र धातु है जो अत्याधिक कठोर होता है।
- शक्ति बढ़ाने के लिए-इस्पात, ड्यूरेलियम आदि मिश्रधातु कठोर होने के कारण शक्तिशाली भी होते हैं।
- संक्षारण रोकने के लिए-जैसे स्टनलैस स्टील, लोहे तथा जिंक से बनी मिश्र धातु पर जंग नहीं लगता।
- ध्वनि उत्पन्न करने के लिए-तांबे तथा कलई से बनाई गई मिश्र धातु बैलमैटल होती है जिससे अधिक ध्वनि उत्पन्न की जाती है।
- गलनांक कम करने के लिए-जैसे रोज-मैटल मिश्र धातु है। इसका गलनांक कम होता है। यह बिस्मथ, कलई और सीसे से बनती है।
- उचित सांचे में ढालने के लिए-कांसा तथा टाइप मैटल।
- रंग परिवर्तन के लिए-तांबे तथा एल्यूमीनियम से बनी एल्यूमीनियम ब्रांज मिश्रधातु का रंग सुनहरी होता है।
- घरेलू उपयोग–घरों, कारखानों, दफ्तरों में सभी जगह मिश्रधातुओं का उपयोग होता है जैसे घर के बर्तन, अलमारी, पंखे, फ्रिज, आभूषण आदि में मिश्रधातुओं का उपयोग होता है।
प्रश्न 26.
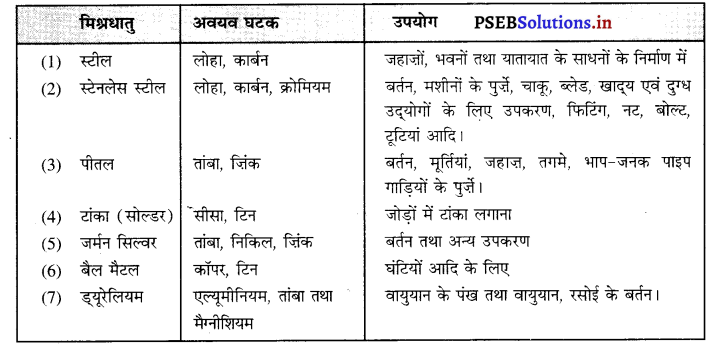
प्रमुख मिश्र धातुओं के नाम, उनके घटक तथा उपयोग लिखिए।
उत्तर–
प्रमुख मिश्रधातु –
प्रश्न 27.
निम्नलिखित मिश्र धातुओं की रचना तथा गुण लिखो
(i) पीतल
(ii) एलनिको
(iii) ड्यूरेलुमिन।
उत्तर-
मिश्र धातु की संरचना और गुण नीचे दिए गए हैं।
(i) पीतल (Brass)-इसमें 70% कॉपर (Cu) तथा 30% जिंक (Zn) होता है। यह बर्तन बनाने के काम आता है।
(ii) एलनिको (Alnico)-इसमें 63% आयरन (Fe), 20% निकल (Ni), 12% एल्यूमीनियम (AI) और 5% कोबाल्ट (Co) होता है। यह स्थायी चुंबक बनाने के काम आता है।
(iii) ड्यूरेलुमिन- इसमें ताँबा (Cu) 4%, एल्यूमीनियम (Al) 95.5% और मैंगनीज़ (Mn) 5% होता है। इसे हवाई जहाज़ों के पुर्जे बनाने के लिए प्रयोग किया जाता है।
प्रश्न 28.
लोहे को जंग लगने से बचाने के लिए तीन ढंग लिखो।
उत्तर-
लोहे का जंग लगना (Rusting of Iron)- यह क्रिया निम्नलिखित चरणों में पूरी होती है –
(i) आयरन इलैक्ट्रॉन खो देने पर फैरस आयन बनाता है।
Fe + 2e– → Fe2+
(ii) ये फैरस आयन ऑक्सीजन और जल के साथ क्रिया करके फैरिक ऑक्साइड की परत बनाते हैं तथा 8 हाइड्रोजन आयन मुक्त होते हैं।
4Fe2+ + O2 + 4H2O → 2Fe2O3 + 8H+ फैरिक ऑक्साइड
(iii) फैरिक ऑक्साइड जलयोजित (hydrate) होकर जंग बनाता है।
Fe2O3 + x H2O → Fe2O3. x H2Oजलयोजित फैरिक ऑक्साइड
(iv) हाइड्रोजन के आयन इलैक्ट्रॉन प्राप्त करके हाइड्रोजन गैस बनाते हैं।
8H+ + 8e– → 4H2
जंग न चिपकने वाला एक यौगिक है। यह परत के बाद दूसरी परत बनकर उड़ता रहता है। इस तरह जंग की एक परत उड़ने के बाद लोहे की मुक्त हुई परत पर फिर जंग लगने लगता है। इस तरह पूरा लोहा जंग से प्रभावित होकर नष्ट हो जाता है। जंग लगने की रोकथाम-संक्षरण एक आर्थिक समस्या है। मानवीय जीवन के लिए जंग लगना बहुत हानिकारक है।
![]()
इसकी रोकथाम के लिए निम्नलिखित विधियाँ हैं-
- पेंट करना-लोहे की वस्तुओं को पेंट करके या ग्रीस लगाकर जंग लगने से बचाया जा सकता है। ऐसा करने से लोहे की सतह का वातावरण की ऑक्सीजन से संपर्क टूट जाता है।
- धात्वीय परत चढ़ाना-लोहे की अपेक्षा अधिक सरलता से इलेक्ट्रॉन प्रदान करने वाली धातु की परत चढ़ाकर जंग लगने से रोका जा सकता है। उदाहरणस्वरूप जिंक धातु लोहे की अपेक्षा सरलता से इलेक्ट्रॉन मुक्त करती है। अतः लोहे की वस्तुओं पर जिंक की परत का लेप करके उन्हें जंग लगने से बचाया जा सकता है। इस क्रिया को जिस्तीकरण या गैल्वनीकरण (Galvanisation) कहते हैं।
- विदयतीय धारा दवारा बचाव-जंग लगते समय बनने वाले फैरस आयनों (Fe2+) को विदयुतीय धारा की सहायता से उदासीन किया जाता है। ऐसा करने के लिए जिस वस्तु को जंग से बचाना हो, उसे कैथोड से जोड़ कर विद्युतीय धारा गुज़ारी जाती है।
- जंगरोधी घोलों का उपयोग करके-फॉस्फेट और क्रोमेट के क्षारकीय विलयन जंग रोधी होते हैं। क्षारक की उपस्थिति के कारण आयन बनते हैं और ये आयन वस्तु का ऑक्सीकरण नहीं होने देते और इस तरह वस्तु ऑक्सीजन के संपर्क में नहीं आती। यह विलयन रेडीएटरों तथा इंजन के पुों को जंग लगने से बचाने के लिए प्रयुक्त होते हैं।
- निक्कल तथा क्रोमियम के साथ मिश्रण बनाकर-जब लोहे को निक्कल तथा क्रोमियम के साथ मिलाकर मिश्रित धातु तैयार की जाती है तो (Fe = 73%, Cr= 18%, Ni = 8%) स्टेनलेस स्टील बन जाता है। स्टेनलेस स्टील जंगरोधी होता है। इस प्रकार लोहे को जंग लगने से बचाया जा सकता है।
अति लघु उत्तरात्मक प्रश्न (Very Short Answer Type Questions)
प्रश्न 1.
किसी धातु का उदाहरण दीजिए जो कमरे के तापमान पर द्रव होती है ?
उत्तर-
मरकरी (पारा)।
प्रश्न 2.
एक धातु और एक अधातु का नाम लिखिए जो सामान्य तापमान पर द्रव अवस्था में पायी जाती है ?
उत्तर-
धातु : मरकरी (पारा)
अधातु : ब्रोमीन।
प्रश्न 3.
निम्नलिखित में से कौन-सी धातुएं शरीर के ताप (37°C)पर पिघल जाती है ? गैलियम, मैग्नीशियम, सीज़ियम, एल्यूमीनियम।
उत्तर-
गैलियम तथा सीज़ियम।
प्रश्न 4.
एक ऐसी अधातु का नाम बताइए जो विद्युत् की सुचालक है।
उत्तर-
ग्रेफाइट (कार्बन का अपरूप)।
प्रश्न 5.
एक अधातु X दो विभिन्न रूपों Y तथा Z में उपलब्ध है। Y कठोरतम पदार्थ है जबकिZ विद्युत् का सुचालक है। Y और Z की पहचान बतायें।
उत्तर-
Y-हीरा (डॉयमंड)
Z-ग्रेफाइट
हीरा और ग्रेफाइट, कार्बन के अपरूप हैं
∴ X कार्बन है।
![]()
प्रश्न 6.
एक तत्व X ऑक्सीजन से क्रिया करके X2O बनाता है। यह ऑक्साइड जल में विलेय है तथा नीले लिटमस को लाल कर देता है। तत्त्व की प्रकृति बताइए अर्थात् क्या यह तत्व धातु है या अधातु ? ।
उत्तर-
क्योंकि तत्व X का ऑक्साइड नीले लिटमस को लाल बना देता है। इसकी प्रकृति अम्लीय है। अतः तत्व X अधातु है।
प्रश्न 7.
धातुओं के ऑक्साइड की प्रकृति क्या होती है ?
उत्तर-
धातुओं के ऑक्साइड की प्रकृति क्षारीय होती है।
प्रश्न 8.
दो उच्च आघातवर्ध्य धातुओं के नाम बताइए।
उत्तर-
चांदी (सिल्वर) तथा सोना (गोल्ड)।
प्रश्न 9.
दो मेटालॉयड्स (उपधातुओं) का नाम बताओ।
उत्तर-
- सिलिकॉन,
- आर्सेनिक।
प्रश्न 10.
धातुओं को वायु में खुला छोड़ने पर उनका रंग फीका क्यों पड़ जाता है ?
उत्तर-
उनकी सतह पर ऑक्साइड, कार्बोनेट तथा सल्फाइड की परत के निर्माण के कारण होता है।
प्रश्न 11.
ऐसी धातुओं के नाम बताओ जिन्हें चाकू से आसानी से काटा जा सकता है ?
उत्तर-
सोडियम, पोटाशियम तथा मैग्नीशियम।
प्रश्न 12.
धातुओं को विभिन्न आकार देना क्यों संभव है ?
उत्तर-
धातुओं के आघातवर्ध्यता तथा तन्यता गुणों के कारण।
प्रश्न 13.
सबसे कम एक ऊष्मा चालक धातु का नाम बताओ।
उत्तर-
सीसा (लैड)।
प्रश्न 14.
कौन-सी धातु विद्युत् प्रवाह का अधिक प्रतिरोध करती है ?
उत्तर-
पारा (मरकरी)।
प्रश्न 15.
किन्हीं चार धातुओं के नाम बताओ, जिनकी तारें खींची जा सकती हैं ?
उत्तर-
कॉपर, एल्यूमीनियम, एल्यूमीनियम, आयरन।
प्रश्न 16.
क्षार क्या है ? क्षार की एक उदाहरण दीजिए।
उत्तर-क्षार-
धात्विक हाइड्रोक्साइड जो जल में विलयशील हैं, क्षार कहलाते हैं। उदाहरण-सोडियम हाइड्रोक्साइड (NaOH)।
प्रश्न 17.
दो उभयधर्मी (Amphoteric Oxides) ऑक्साइडों के नाम बताओ।
उत्तर-
- एल्यूमिनियम ऑक्साइड
- ज़िंक ऑक्साइड।
प्रश्न 18.
क्या होता है जब मैग्नीशियम को इसके ज्वलन ताप तक गर्म किया जाता है ?
उत्तर-
मैग्नीशियम सफ़ेद प्रकाश के साथ जलने लगता है और मैग्नीशियम ऑक्साइड बनाता है।
प्रश्न 19.
कौन-सी धातु तनु अम्ल के साथ अभिक्रिया नहीं करती है ?
उत्तर-
कॉपर।
प्रश्न 20.
उन धातुओं के नाम बताओ जो हाइड्रोजन के साथ अभिक्रिया करती हैं ?
उत्तर-
सोडियम, पोटाशियम और कैल्शियम।
प्रश्न 21.
जब कैल्सियम धातु के किसी टुकड़े को पानी में डाला जाता है तो संपन्न होने वाली अभिक्रिया के लिए समीकरण लिखिए।
उत्तर-
Ca + 2H2O → Ca (OH)2 + 4H2
प्रश्न 22.
लाल गर्म लोहे के ऊपर से भाप गुजारने से होने वाली रासायनिक अभिक्रिया के लिए समीकरण लिखिए।
उत्तर-
3Fe + 4H2O → Fe3O4 + H2
प्रश्न 23.
जब कॉपर धातु की पत्ती के जिंक का सल्फेट के विलयन में डाला जाता है तो घटित होने वाली रासायनिक अभिक्रिया की समीकरण लिखिए।
उत्तर-
Zn + CuSO4 → ZnSO4 + Cu.
प्रश्न 24.
दो धातुओं के नाम बताइए जो प्रकृति में मुक्त अवस्था में मिलती हैं ?
उत्तर-
- सोना
- प्लैटिनम।
प्रश्न 25.
धातुओं के संक्षारण से आप क्या समझते हैं ?
उत्तर-
संक्षारण- वायु तथा नमी (आर्द्रता) का उपस्थिति में धातुओं की ऊपरी परत का क्षीण होना धातु का संक्षारण कहलाता है।
![]()
प्रश्न 26.
आघातवर्ध्यता की परिभाषा लिखो।
उत्तर-
आघातवर्ध्यता (Mallbeability)-यह धातुओं का वह गुण है जिसके कारण धातुओं को हथौड़े से पीटकर बिना इसके टूटे धातुओं को पतली चादर के रूप में बदला जाता है।
प्रश्न 27.
तन्यता की परिभाषा लिखो।
उत्तर-
तन्यता (Ductility)-यह धातुओं का वह गुण है जिसके कारण धातुओं को पतली तारों के रूप में बदला जा सकता है।
प्रश्न 28.
हम लोहे से बनी वस्तुओं पर पेंट क्यों करते हैं ?
उत्तर-
लोहे से बनी वस्तुओं पर पेंट किया जाता है ताकि लोहे से बनी वस्तुओं को संक्षारण से बचाया जा सके।
प्रश्न 29.
ऐसी अधातु का उदाहरण दो जो :
(i) विद्युत की सुचालक हो
(ii) चमकीली हो।
उत्तर-
विद्युत की सुचालक अधातु-ग्रेफाइट। चमकीली अधातु-आयोडीन।
वस्तुनिष्ठ प्रश्न (Objective Type Questions)
बहु-विकल्पीय प्रश्न
प्रश्न 1.
सामान्य अवस्था में द्रव अवस्था में पाई जाने वाली अधातु है
(a) क्लोरीन
(b) ब्रोमीन
(c) फ्लू ओरीन
(d) आयोडीन।
उत्तर-
(b) ब्रोमीन।
प्रश्न 2.
उभयधर्मी ऑक्साइड है
(a) Na2O
(b) BaO
(c) ZnO
(d) K2O.
उत्तर-
(c) ZnO.
प्रश्न 3.
धातुओं को पीट कर पतली चादर बनाया जा सकता है ? इस गुणधर्म को क्या कहते हैं ?
(a) आघातवर्ध्यता
(b) तन्यता
(c) धात्विक चमक
(d) कठोरता।
उत्तर-
(a) आघातवर्ध्यता।
प्रश्न 4.
सक्रियता श्रेणी में सबसे अधिक अभिक्रियाशील धातु कौन-सी है ?
(a) Na
(b) Mg
(c) Au
(d) K.
उत्तर-
(d) K.
प्रश्न 5.
Fe2O3 + 2Al → 2Fe + Al2O3+ ऊष्मा, इस अभिक्रिया का नाम है
(a) एनोडीकरण
(b) थर्माइट
(c) यशदलेपन
(d) उपरोक्त सभी।
उत्तर-
(b) थर्माइट।
प्रश्न 6.
यशदलेपन में किस धातु की परत चढ़ाई जाती है ?
(a) गेलियम
(b) ऐलुमिनियम
(c) जिस्त
(d) चाँदी।
उत्तर-
(c) जिस्त।
रिक्त स्थानों की पूर्ति कीजिए-
(i) अधिक सक्रिय धातु द्वारा कम सक्रिय धातु को उसके लवण के विलयन से विस्थापित करने की क्रिया …………………………. कहलाती है।
उत्तर-
विस्थापन
(ii) मिश्रधातु दो या दो से अधिक धातु अथवा धातु एवं अधातु का ……………. मिश्रण होता है।
उत्तर-
समाँगी
(iii) लोहे के पैन को जंग से बचाने के लिए ……………………. की परत चढ़ाई जाती है।
उत्तर-
जिंक
![]()
(iv) सल्फाइड अयस्क को वायु की उपस्थिति में अधिक ताप पर गर्म करने पर यह ऑक्साइड में परिवर्तित हो जाती है। इस प्रक्रिया को …………… कहते हैं।
उत्तर-
भर्जन
(v) धातु के पतले तार के रूप में खींचने की क्षमता को …………………… कहते हैं।
उत्तर-
तन्यता।
