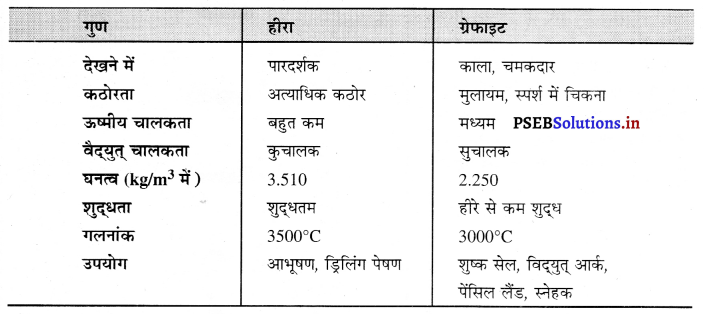
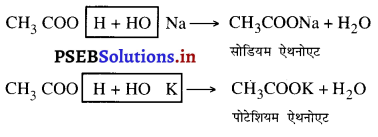
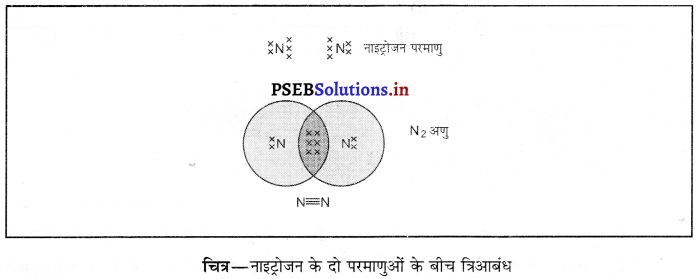
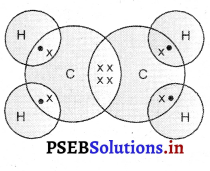
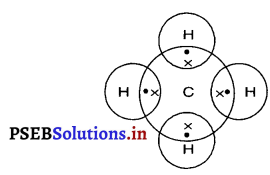
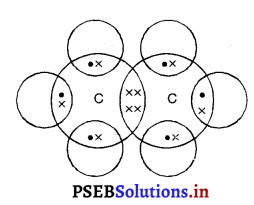
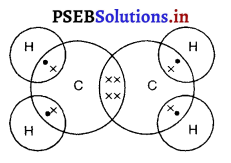
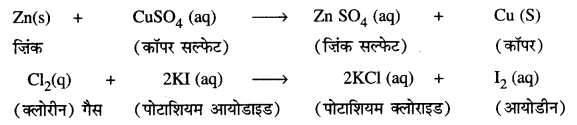
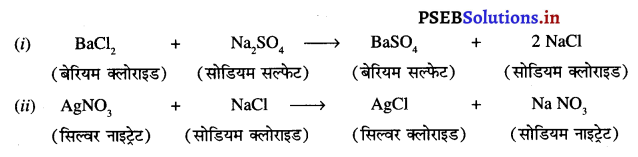
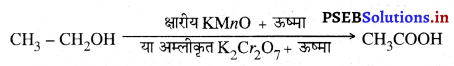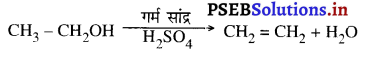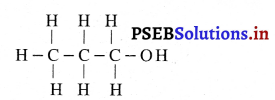Punjab State Board PSEB 10th Class Science Important Questions Chapter 5 तत्वों का आवर्त वर्गीकरण Important Questions and Answers.
PSEB 10th Class Science Important Questions Chapter 5 तत्वों का आवर्त वर्गीकरण
दीर्घ उत्तरात्मक प्रश्न (Long Answer Type Questions)
प्रश्न 1.
न्यूलैंड का अष्टक नियम क्या है ? उदाहरण देकर समझाओ। यह भी बताओ कि इस नियम का क्या योगदान है ?
उत्तर-
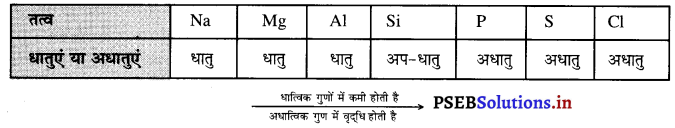
(क) न्यूलैंड का अष्टक नियम (Newland’s Law of Octave)-जॉन न्यूलैंड ने तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम अनुसार व्यवस्थित किया। उसने देखा कि प्रत्येक आठवें तत्व के गुण पहले तत्व के गुणों के समान हैं। समान गुणों वाले तत्वों के पुनः दोहराने की विधि उसी प्रकार है जिस प्रकार संगीत स्केल के सुर प्रत्येक आठवें सुर के पीछे दोहराए जाते हैं। संगीत स्केल के आधार पर न्यूलैंड ने अष्टक नियम को प्रतिपादित किया। न्यूलैंड्स द्वारा तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित करने से तत्वों के गुणों का दोहराया जाना अष्टक का नियम कहलाता है। न्यूलैंड के अष्टक नियम अनुसार व्यवस्थित किए आठ तत्वों के संग्रह को न्यूलैंड का अष्टक कहते हैं।
सारणी-न्यूलैंड के अष्टक नियम अनुसार कुछ तत्वों की व्यवस्था-
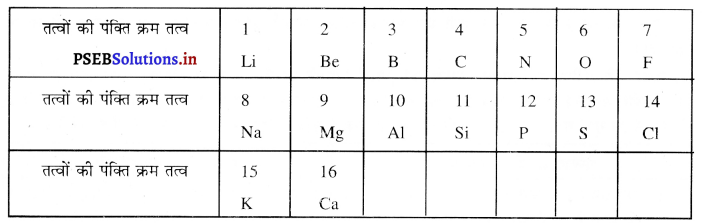
सोडियम जो आठवें स्थान पर स्थित है उसके गुण पहले स्थान पर स्थित लिथियम से मिलते-जुलते हैं। इसी प्रकार की पोटैशियम जो सोडियम से आठवां तत्व है, उसके गुण सोडियम से मिलते हैं।
(ख) न्यूलैंड के अष्टक नियम का योगदान-न्यूलैंड के अष्टक नियम अनुसार तत्वों को सारणी में व्यवस्थित करने से स्पष्ट हो गया कि तत्वों के गुणों में आवर्तता स्पष्ट करने के लिए आवश्यक है कि तत्वों को क्षितिज तथा लम्बात्मक पंक्तियों में व्यवस्थित किया जाए।
प्रश्न 2.
मेंडलीफ की मूल आवर्त सारणी क्या है ? इसके प्रमुख लक्षण बताइए।
उत्तर-
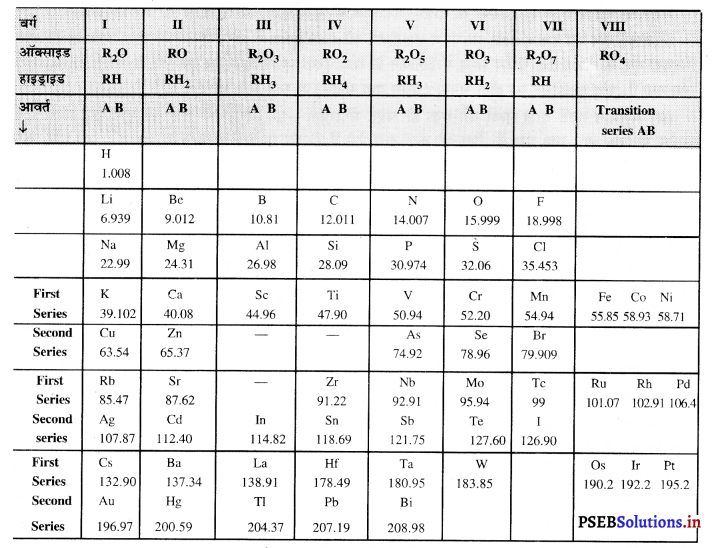
मेंडलीफ की मूल आवर्त सारणी- एक रूसी वैज्ञानिक प्रोफेसर डिमिट्री इवानोविच मेंडलीफ ने तत्वों के परमाणु द्रव्यमानों तथा उनके भौतिक व रासायनिक गुणधर्मों के मध्य एक संबंध का भली-भाँति अध्ययन किया। उस समय कुल 63 तत्व ज्ञात थे। मेंडलीफ ने उन तत्वों को उनके परमाणु द्रव्यमानों के आधार पर व्यवस्थित किया। इस प्रकार मेंडलीफ ने तत्वों को उनके द्वारा बनाए यौगिकों; जैसे-ऑक्साइड, हाइड्राइड आदि के सूत्रों में समानताओं के आधार पर व्यवस्थित किया। उन्होंने यह प्रेक्षित किया कि अधिकतर तत्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में रखने पर आवर्ती पुनरावृत्ति अथवा आवर्तिता प्रदर्शित होती है अर्थात् प्रत्येक आठवें तत्व के गुणधर्म प्रथम तत्व के गुणधर्म के समान होते हैं।
इस आधार पर मेंडलीफ ने यह आवर्त नियम प्रस्तावित किया “तत्वों के भौतिक एवं रासायनिक गुणधर्म उनके परमाणु भारों (परमाणु-द्रव्यमानों) के आवर्ती फलन होते हैं।” मेंडलीफ की मूल आवर्त सारणी में ऊर्ध्वाधर स्तंभ (समूह) तथा क्षैतिज कतारें (आवर्त) थीं। इस सारणी में यद्यपि सभी तत्वों को उनके बढ़ते हुए परमाणु द्रव्यमानों के क्रम में व्यवस्थित किया गया। कुछ तत्वों के युग्मों को उनके परमाणु द्रव्यमानों के व्युत्क्रम में रखा गया। उदाहरणार्थ-कोबाल्ट (परमाणु द्रव्यमान 53.93) तथा निकिल (58.7), टेल्यूरियम (127.6) और आयोडीन (126.90)।
आवर्त सारणी में यह व्युत्क्रमण तत्व के रासायनिक गुणधर्मों की उस समूह के तत्वों के साथ समानताओं के कारण किया गया जिसमें उस तत्व को रखा गया था। उदाहरणार्थ-टेल्यूरियम (Te) को आयोडीन से पहले रखा गया, जबकि Te का परमाणु द्रव्यमान अधिक है। ऐसा इसलिए किया गया; क्योंकि आयोडीन के गुणधर्म ब्रोमीन के गुमधर्म के समान हैं, न कि सेलेनियम (Se) के गुणधर्म के समान हैं। इस सारणी में छोड़े गए रिक्त स्थानों को भरने के लिए भविष्य में खोजे जाने वाले तत्वों के गुणधर्मों की भविष्यवाणी उसने तत्वों की आवर्त सारणी में स्थिति के आधार पर की।
मेंडलीफ की मूल आवर्त सारणी के सामान्य लक्षण-मेंडलीफ की मूल आवर्त सारणी के सामान्य लक्षण निम्नलिखित हैं
- प्रत्येक आवर्त में तत्व अपने बढ़ते परमाणु भारों के क्रम में व्यवस्थित हैं।
- एक ही समूह के सभी तत्वों के गुणधर्म समान होते हैं।
- प्रत्येक आवर्त में बाएँ से दाएँ चलने पर तत्वों की ऋण विद्युत् संयोजकता कम होती जाती है, जबकि धन विद्युत् संयोजकता बढ़ती जाती है।
- तत्व का परमाणु भार उसका मौलिक गुण है।
- कम परमाणु भार वाले तत्व, जैसे-H, C, O, N अपेक्षाकृत प्रकृति में अधिक मात्रा में पाए जाते हैं।
- सारणी में रिक्त स्थानों के तत्वों के गुणधर्मों को पहले ही बताया जा सकता है।
- आवर्त सारणी में कुछ तत्व ऐसे स्थानों पर रखे गए थे जिसके अनुसार उनके गुण नहीं थे। इन तत्वों के परमाणु द्रव्यमानों में संशोधन हुआ तथा तब इन्हें सारणी में तर्कसंगत स्थान प्राप्त हुआ।
- सारणी में किसी भी तत्व के स्थान के अनुसार उसके गुणों को बताया जा सकता है।
मेंडलीफ की मूल आवर्त सारणी के दोष-मेंडलीफ की मूल आवर्त सारणी के प्रमुख दोष निम्नलिखित हैं-
(i) हाइड्रोजन का स्थान-इस सारणी में हाइड्रोजन को प्रथम समूह में क्षार-धातुओं के साथ उनके समान धनविद्युती गुण के कारण तथा सप्तम समूह में हैलोजेन के साथ उनके समान ऋण-विद्युती गुण के कारण दो स्थानों पर रखा गया है, परंतु हाइड्रोजन को दोनों समूहों (प्रथम तथा सप्तम) में रखा जाना दोषपूर्ण है।
(ii) असमान गुणों वाले तत्वों को एक ही समूह में रखना-इस सारणी में तत्वों को गुणों की समानता के आधार पर एक साथ रखा गया है, फिर भी कुछ तत्व ऐसे हैं जिनके गुणों में असमानताएं हैं। दूसरे शब्दों में, कुछ तत्व भिन्न-भिन्न गुणों वाले होते हुए भी एक समूह में रखे गए हैं; जैसे-I-A के तत्वों (क्षार धातुएँ) तथा I-B के तत्वों (सिक्का धातुएँ) को एक ही समूह में रखा गया है, जबकि इनके गुणों में भिन्नता है।
(iii) समान गुणों वाले तत्वों को भिन्न-भिन्न समूहों में रखना-मेंडलीफ की आवर्त सारणी में समान गुण वाले तत्वों को भिन्न-भिन्न स्थानों पर रखा गया है; जैसे-Pt (195.09) तथा Au (196.97) के गुणों में समानताएँ हैं, फिर भी उन्हें आठवें तथा पहले समूह में भिन्न-भिन्न रखा गया है। इसके अतिरिक्त कॉपर व पारा; बेरियम व लेड इत्यादि के गुण समान होते हुए भी उन्हें भिन्न-भिन्न समूहों में रखा गया है।
(iv) भारी तत्वों को हल्के तत्वों से पहले रखना-मेंडलीफ की आवर्त सारणी में कुछ भारी तत्वों को हल्के तत्वों से पहले रखा गया। जैसे
- कोबाल्ट (परमाणु भार = 58.93), निकिल (परमाणु भार = 58.71) से पहले रखा गया है।
- टेल्यूरियम (परमाणु भार = 127.6), आयोडीन (परमाणु भार = 126.9) से पहले रखा गया है।
मेंडलीफ की मूल आवर्त सारणी में परमाणु भारों के बढ़ते हुए क्रम में इस प्रकार के परिवर्तन मेंडलीफ के मूल आवर्त नियम के विपरीत हैं।
(v) दुर्लभ मृदा तत्वों का स्थान-दुर्लभ मृदा तत्वों के रासायनिक गुणों में समानताएँ हैं, परंतु इनके परमाणु भार भिन्न हैं। फिर भी इन 84.14 तत्वों की तीसरे उपसमूह B (छठे आवर्त) में एक साथ रखा गया है, जो उचित नहीं है।
(vi) समस्थानिकों का स्थान-समस्थानिकों तथा समभारिकों की खोज से यह स्पष्ट हो गया कि तत्वों का मूल लक्षण उनका परमाणु भार नही होता। समस्थानिकों के परमाणु भार भिन्न होते हैं, परंतु उनके गुण समान होते हैं। समभारिकों के परमाणु एक समान होते हैं, परंतु उनके गुण भिन्न होते हैं। अतः मेंडलीफ की मूल आवर्त सारणी में समस्थानिकों का स्थान निश्चित नहीं है।
(vii) आठवें समूह के तत्वों को तीन ऊर्ध्वाधर स्तंभों में रखा जाना तर्कसंगत नहीं है।
![]()
प्रश्न 3.
आधुनिक आवर्त सारणी क्या है ? यह दीर्घ सारणी मेंडलीफ की आवर्त सारणी से किस प्रकार भिन्न है ? आधुनिक आवर्त सारणी द्वारा मेंडलीफ की मूल आवर्त सारणी की विसंगतियों का निराकरण किस प्रकार किया गया ?
उत्तर-
आधुनिक आवर्त सारणी-मेंडलीफ ने तत्वों को न केवल उनके गुणों के आधार पर ही वर्गीकृत करने का प्रयास किया, बल्कि किसी ऐसे आधार की खोज करने की कोशिश की जो किसी निश्चित तत्व के बहुत-से गुणों की भविष्यवाणी कर सके। परमाणु भार ही एक ऐसा गुण था जिसने उन्हें पूर्ण रूप से सहायता की।
चित्र में आवर्त सारणी का आधुनिक रूप दिखाया गया है जिसमें 105 तत्वों को उचित स्थान दिया गया है। मेंडलीफ द्वारा दी गई आवर्त सारणी दोषपूर्ण थी। बहुत-से तत्वों के आइसोटोप मिलते थे जिनके परमाणु पुंज भिन्न-भिन्न थे। अतः सारणी में हरेक के लिए अलग-अलग स्थान होना चाहिए, परंतु ऐसा नहीं किया जा सकता था। इसी दौरान मेंडलीफ को अपनी त्रुटि का आभास हो गया। इस सारणी की मेंडलीफ की आवर्त सारणी से तुलना करने पर आप पायेंगे कि वे तत्व जिनको उसने वर्गीकृत किया, अब भी अपने उसी स्थान पर हैं। सारणी को देखने पर पता चलता है कि परमाणु क्रमांक एक तत्व से दूसरे तत्व तक बढ़ता जाता है। परमाणु भार में जो अनियमितताएं थीं, इस दीर्घ सारणी में हल हो गईं।
मेंडलीफ ने संशोधित आवर्त नियम प्रस्तुत किया, जिसे आधुनिक आवर्त नियम कहा गया है। इस नियम के अनुसार तत्वों के गुण अपने परमाणु क्रमांकों के आवर्ती फलन (Periodic Functions) हैं।
तत्वों का वर्गीकरण परमाणु क्रमांक के आधार पर
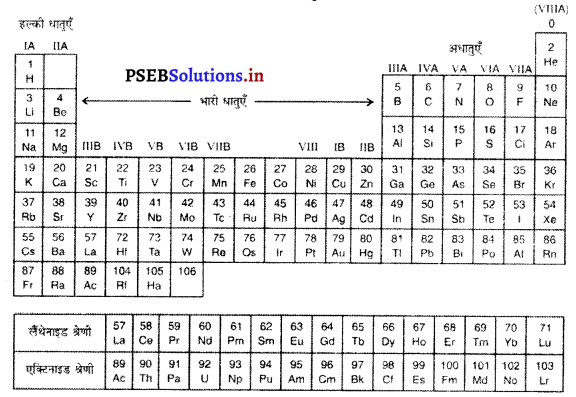
आधुनिक आवर्त सारणी में समूह (Groups) तथा आवर्त (Periods)-सारणी के किसी ग्रुप में ऊपर से नीचे की ओर आते समय तत्वों के परमाणों में शैलों की संख्या बढ़ती है, पर वैलेंस शैल में उपस्थित इलैक्ट्रॉनों की संख्या समान ही रहती है। इन इलैक्ट्रॉनों की समान संख्या के कारण उनके ग्रुप भी समान होते हैं। आवर्त सारणी में कुल 18 ग्रुप हैं। s, p, d तथा f उपशैल के आधार पर सारणी को 4 ब्लॉकों में वर्गीकृत किया गया है।
- ग्रुप 1-2 s-ब्लॉक
- ग्रुप 13-15 p-ब्लॉक
- ग्रुप 3-12 d-ब्लॉक
- परमाणु संख्या 58-71 तथा 90-103 के तत्व f-ब्लॉक में रखे गए हैं।
मेंडलीफ की आवर्ती सारणी का विवरण-सारणी से स्पष्ट है कि इसमें क्षैतिज पंक्तियां और उर्ध्वाधर कालम हैं। क्षैतिज पंक्तियों को समूह और ऊर्ध्वाधर कालमों में पीरियड कहते हैं। इस सारणी में 6 पीरियड और 18 समूह हैं। पहले 7 समूहों में साधारण तत्व और 8 समूह में प्रतिनिधि तत्व हैं जिन्हें समूह A और समूह B में वर्गीकृत किया गया है। परंतु इस आवर्ती सारणी में अक्रियाशील गैसें और प्रतिनिधि तत्व नहीं थे क्योंकि उस समय इनके बारे में कोई जानकारी नहीं थी।
प्रश्न 4.
निम्नलिखित किसी आवर्त और किसी समूह में कैसे परिवर्तन करते हैं ?
(i) आयनन ऊर्जा
(ii) परमाण्विक अर्ध-व्यास
(iii) इलैक्ट्रॉन बंधुता
(iv) तत्वों के धात्विक और अधात्विक अभिलक्षण।
उत्तर-
(i) आयनन ऊर्जा- किसी तत्व के विलगित परमाणु से अथवा आयन से एक इलैक्ट्रान को पूर्ण रूप से उत्सर्जित करने के लिए आवश्यक ऊर्जा को आयनन ऊर्जा कहते हैं।
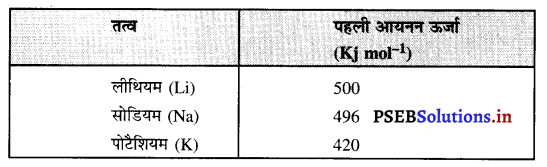
(क) समूह में ऊर्जा का परिवर्तन-आवर्त सारणी के समूह (ग्रुप) में ऊपर से नीचे जाते समय तत्वों की आयनन ऊर्जा कम होती है। इस कथन की पुष्टि नीचे दी गई समूह 1 की सारणी में तत्वों से संबंधित आययन ऊर्जा से होती है। किसी समूह में ऊपर से नीचे की ओर जाते समय तत्वों की आयनन ऊर्जाओं में कमी उनके परमाणुओं के आकार में वृदधि के कारण होती है। किसी समूह में नीचे की ओर जाते समय परमाणुओं में बाहयतम शैल (कोष) के इलैक्ट्रॉन न्यूक्लियसों से दूर होते जाते हैं जिसके फलस्वरूप इलैक्ट्रॉनों के प्रति न्यूक्लियस का आकर्षण कम हो जाता है। ऐसा होने से इलैक्ट्रॉन कम ऊर्जा द्वारा ही सुगमता से हटाए जा सकते हैं।
समूह 1 के तत्वों की प्रथम आयनन ऊर्जाएंतत्व
(ख) आवर्त (पीरियड) में आयनन ऊर्जा का परिवर्तन)-आवर्त सारणी के आवर्त (पीरियड) में बाएं से दाएं तरफ जाते समय आयनन ऊर्जाओं में वृद्धि होती है। उदाहरणतः दूसरे आवर्त के तत्वों की सारणी से इस तथ्य की पुष्टि होती है कि प्रथम आयनन ऊर्जा में बाएं से दाएं ओर जाते समय आयनन ऊर्जाओं में वृद्धि होती है। दूसरे आवर्त ( पीरियड) के तत्वों की प्रथम आयनन ऊर्जाएं

तत्वों की आवर्त सारणी के आवर्त में बाएं से दाएं की ओर जाते हुए तत्वों की आयनन ऊर्जाओं में वृद्धि इस कारण होती है कि परमाणु संख्या में वृद्धि होने के कारण धन आवेश में वृद्धि होती है तथा परमाणु अर्धव्यास कम हो जाता है। परमाणु के अर्धव्यास कम होकर परमाणु के इलैक्ट्रॉन अधिक बल के साथ आकर्षित होते हैं जिसके परिणामस्वरूप इलैक्ट्रॉन का विलय की ओर आकर्षण बढ़ जाता है अर्थात् आयनन ऊर्जा में वृद्धि होती है।
(ii) परमाण्विक अर्ध-व्यास-पृथक् परमाणु ने न्यूक्लियस के केंद्र बिंदु तथा बाह्यत्म शैल के बीच की दूरी को परमाणु अर्ध-व्यास कहते हैं।
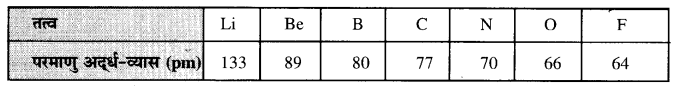
(क) समूह में परमाण्विक अर्धव्यस का परिवर्तन- एक समूह में ऊपर से नीचे जाने पर तत्वों के परमाणुओं का परमाणु अर्ध-व्यास धीरे-धीरे बढ़ता है। जैसे

(ख) एक आवर्त में परमाणु अर्ध-व्यास में परिवर्तन-किसी आवर्त में बाएं से दाएं जाने पर तत्वों के परमाणुओं का परमाणु अर्ध-व्यास घटता जाता है। जैसे
(iii) इलैक्ट्रॉन बंधुता-जब किसी तत्व का उदासीन परमाणु एक इलैक्ट्रॉन को सुगमता से ग्रहण करके ऋणायन में परिवर्तित हो जाता है तो इस प्रक्रिया में ऊर्जा का उत्सर्जन होता है, जिसे इलैक्ट्रॉन बंधुता कहते हैं।
(क) ग्रुप में इलैक्ट्रॉन बंधुता का परिवर्तन-आवर्त सारणी के किसी समूह में ऊपर से नीचे जाते समय तत्वों की इलैक्ट्रॉन बंधुता कम हो जाती है। यह कभी परमाणुओं के आकार में वृद्धि के कारण होती है। परमाणु के आकार में वृद्धि के फलस्वरूप इलैक्ट्रॉन के लिए आकर्षण बल कम हो जाता है। पहले समूह के तत्वों से स्पष्ट हो जाता है कि लिथियम के इलैक्ट्रॉन आकर्षण हाइड्रोजन के इलैक्ट्रान आकर्षण से कम है। इसलिए कुछ अपवाद भी हैं जैसे कि क्लोरीन का आकार छोटा है।
(ख) आवर्त में इलैक्ट्रॉन बंधुता का परिवर्तन-तत्वों की आवर्त सारणी के आवर्त में बाएं से दाएं जाते समय तत्वों के इलैक्ट्रॉन बंधुता का मूल्य बढ़ता है। इलैक्ट्रॉन बंधुता की यह वृद्धि परमाणु संख्या के बढ़ने के कारण परमाणु आकार में कमी होने के कारण होता है।
(iv) धात्विक और अधात्विक अभिलक्षण में परिवर्तन
(क) ग्रुप में तत्वों के धात्विक तथा अधात्विक गुणों का बढ़ना-दीर्घ आवर्त सारणी के समूह में ऊपर से नीचे की ओर जाते हुए तत्वों के धात्विक गुणों में वृद्धि होती है, परंतु अधात्विक गुणों में कमी आती है। इसका कारण यह है कि समूह (ग्रुप) में ऊपर से नीचे की ओर जाते हुए धात्विक तत्वों का परमाणु आकार बढ़ता है और इलैक्ट्रॉनों का आकर्षण बल कम होता है। इसलिए वेलैंस शैल के इलैक्ट्रॉन को सुगमता से हटा कर विद्युतीय धन आवेशित आयन बन जाते हैं अर्थात् धात्विक गुणों में वृद्धि होती जाती है।
समूह 17 के अधात्विक तत्वों को देग्नने से पता चलता है कि फ्लोरीन से आयोडीन तक अधात्विक तथा ऋण विद्युत आवेश में कमी होती है। इसकारण यह है कि समूह में ऊपर से नीचे जाते हुए परमाणुओं के आकार में वृद्धि के कारण विद्युतीय ऋण आवेशित आयन बनाने वाले इलैक्ट्रॉन के लिए आकर्षण बल कम हो जाता है जिसके परिणामस्वरूप तत्वों के अधात्विक लक्षण में कमी हो जाती है।
(ख) आवर्त (पीरियड) में तत्वों धात्विक तथा अधात्विक गणों का बदलना-दीर्घ आवर्त सारणी के आवर्त में बाएं से दाएं ओर जाते हुए तत्वों के अधात्विक लक्षण में कमी होती है तथा धात्विक गुणों में वृद्धि होती है। इस तथ्य को स्पष्ट करने के लिए आओ तीसरे आवर्त के तत्वों पर विचार करें।
लघु उत्तरात्मक प्रश्न (Short Answer Type Questions)
प्रश्न 1.
तत्वों के वर्गीकरण की आवश्यकता क्यों हुई ?
उत्तर-
तत्वों की अत्यधिक संख्या होने के कारण उनके गुणों तथा उपयोगों का पृथक-पृथक अध्ययन करना सम्भव नहीं है। अतः तत्वों को विशेष रूप में व्यवस्थित करके प्रत्येक तत्व के विषय में अध्ययन करने के लिए इनका वर्गीकरण करना आवश्यक हुआ।
![]()
प्रश्न 2.
डॉबेराइनर द्ववारा दिए गए वर्गीकरण क्या आधार था ?
उत्तर-
सन् 1817 ई०में डॉबेराइन ने लगभग समान गुणधर्म वाले अनेक तत्वों को तीन-तीन के समूहों में उनके परमाणु द्रव्यमान में वृद्धि के क्रमानुसार रखा तथा स्पष्ट किया कि प्रत्येक समूह के बीच वाले तत्व का परमाणु द्रव्यमान प्रथम एवं तृतीय तत्वों के परमाणु द्रव्यमानों के योग का लगभग मध्यमान होता है। यह डॉबेराइनर का त्रिक नियम कहलाता है और इस प्रकार के समूह त्रिक (traid) कहलाते है, जैसे(i) तत्व :

यह वर्गीकरण सर्वमान्य न हो सका क्योंकि उस समय तक ज्ञात सभी तत्वों को ऐसे त्रिक समूहों में विभाजित नहीं किया जा सका।
प्रश्न 3.
मेंडलीफ के मूल वर्गीकरण को उस समय प्रचलित अन्य वर्गीकरणों से अधिक उपयुक्त क्यों माना गया ?
उत्तर–
मेंडलीफ के मूल वर्गीकरण को उस समय प्रचलित अन्य वर्गीकरणों से अधिक उपयुक्त माना गया, क्योंकि-
- मेंडलीफ का आवर्त नियम समान गुण वाले तत्वों के एक समान रखने पर बल देता है न कि केवल उनके परमाणु द्रव्यमानों के आधार पर।
- मेंडलीफ की आवर्त सारणी में भविष्य में खोजे जाने वाले तत्वों को पूर्वानुमान के आधार पर रिक्त स्थान उपलब्ध था। इनके गुण समीपवर्ती तत्वों के गुणों के अनुसार बताए गए थे।
- मेंडलीफ ने समान. गुण वाले तत्वों को एक साथ रखने हेतु उनके परमाणु द्रव्यमानों में भी सुधार किया। उपर्युक्त विशिष्टताओं के कारण ही मेंडलीफ का वर्गीकरण सर्वोच्च म ना गया।
प्रश्न 4.
मेंडलीफ ने अपनी आवर्त सारणी में कुछ स्थान छोड़ दिए थे। उनका उल्लेख कीजिए तथा इसका कारण बताइए।
अथवा
मेंडलीफ की मूल आवर्त सारणी की अद्वितीय उपयोगिता क्या है ?
उत्तर-
मेंडलीफ ने अपनी आवर्त सारणी में कुछ स्थान रिक्त रखे थे। मेंडलीफ का विश्वास था कि उन स्थानों पर उस समूह में पहले उपस्थित तत्व के समान गुणधर्म वाले तत्व अस्तित्व में हैं, परंतु तब तक उनकी खोज न हो सकी। मेंडलीफ ने इन तत्वों के नाम पहले वाले तत्व के नाम से संस्कृत उपसर्ग ‘एका’ लगाकर किया, जैसेएकाबोरेन, एका-ऐल्युमिनियम तथा एका–सिलिकॉन। उनके अनुमान के अनुसार क्रमशः स्कैंडियम, गैलियम एवं जर्मेनियम की बाद में खोज हुई। यह मेंडलीफ की मूल आवर्त सारणी की अद्वितीय उपयोगिता थी।
प्रश्न 5.
किसी तत्व का परमाणु क्रमांक उसके परमाणु भार से अधिक महत्त्वपूर्ण क्यों माना जाता है ?
उत्तर-
किसी तत्व के परमाणु क्रमांक के आधार पर उसमें प्रोटॉनों, इलैक्ट्रॉनों की संख्या ज्ञात की जा सकती है। तत्व की संयोजकता एवं तत्व के वर्ग की जानकारी हमें परमाणु क्रमांक से ही प्राप्त होती है तथा परमाणु क्रमांक के आधार पर इलैक्ट्रॉनिक विन्यास भी लिखे जा सकते हैं। स्पष्ट है कि परमाणु क्रमांक द्वारा ही तत्वों के गुणधर्मों का निर्धारण करने में सरलता होती है इसलिए ये अधिक महत्त्वपूर्ण माने जाते हैं।
प्रश्न 6.
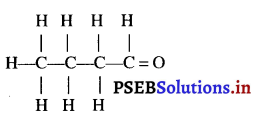
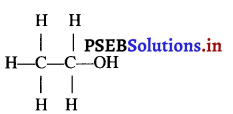
आवर्त सारणी के समूह-15 में नाइट्रोजन (परमाणु संख्या 7) तथा फॉस्फोरस (परमाणु संख्या 15) स्थित हैं। इन दो तत्वों के इलैक्ट्रॉनिक विन्यासों को K, L, M, N कोशों के आधार पर दीजिए। इन तत्वों के धात्विक एवं अधात्विक प्रकृति के बारे में भी प्रागुक्ति कीजिए।
उत्तर-
नाइट्रोजन तथा फॉस्फोरस के इलैक्ट्रॉनिक विन्यास-
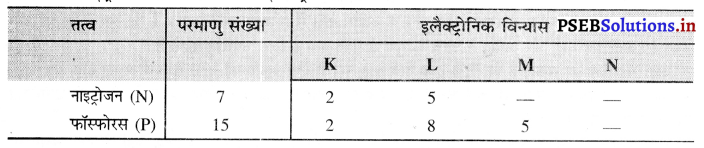
नाइट्रोजन व फॉस्फोरस के इलेक्ट्रॉनिक विन्यास से पता चलता है कि इनके बाह्यतम कोश में 5 इलैक्ट्रॉन हैं जो अधातु का लक्षण है, क्योंकि अधातु तत्वों के परमाणुओं के बाह्यतम कोश में सामान्यतया 4-8 इलैक्ट्रॉन विद्यमान होते हैं। अतः नाइट्रोजन व फॉस्फोरस तत्व अधातु हैं।
![]()
प्रश्न 7.
(क) उन तत्वों के नाम बताइए जो आवर्त सारणी के तीसरे आवर्त में हैं और उनका धातु व अधातु में वर्गीकरण कीजिए।
(ख) आवर्त सारणी के किस ओर आप धातुओं को पाते हैं ?
(ग) आवर्त सारणी के किस ओर आप अधातुओं को पाते हैं ?
उत्तर-
(क) आवर्त सारणी के तीसरे आवर्त में निम्नलिखित तत्व होते हैं-
तीसरा आवर्त-सोडियम (Na), मैग्नीशियम (Mg), ऐल्यूमिनियम (AI), सिलिकॉन (Si), फॉस्फोरस (P), सल्फर (S), तथा क्लोरीन (Cl)।
उपर्युक्त तत्वों का धातुओं तथा अधातुओं में वर्गीकरण निम्नवत् किया जा सकता हैधातु-सोडियम (Na), मैग्नीनियम (Mg), ऐल्यूमिनियम (Al) अधातु-सिलिकॉन (Si), फॉस्फोरस (P), सल्फर (S), तथा क्लोरीन (Cl)।
(ख) आवर्त सारणी में बाईं ओर हम धातुओं को पाते हैं। (ग) आवर्त सारणी में दाईं ओर हम अधातुओं को पाते हैं।
प्रश्न 8.
आधुनिक आवर्त सारणी में निम्नलिखित को बताइए
(क) हैलोजेन परिवार में सबसे अधिक क्रियाशील अधातु का नाम व सूत्र।
(ख) क्षारीय समूह में सबसे अधिक क्रियाशील अधातु का नाम व सूत्र।
(ग) वह अधातु जो द्रव अवस्था में रहती है।
उत्तर-
(क) हैलोजेन परिवार में फ्लुओरीन (F), छोटे परमाणु तथा कम बंधन ऊर्जा के कारण सबसे अधिक क्रियाशील अधातु है।
(ख) क्षारीय समूह में सबसे अधिक क्रियाशील धातु पोटैशियम (K) है।
(ग) ब्रोमीन सामान्य ताप पर द्रव अवस्था में रहती है।
प्रश्न 9.
दो तत्व ‘X’ तथा ‘Y’ जिनके परमाणु क्रमशः 11 व 17 हैं –
(क) ये तत्व आवर्त सारणी के किस वर्ग में हैं ?
(ख) इन तत्वों में से कौन-सी धातु तथा कौन-सी अधातु है ? (ग) ये तत्व आवर्त सारणी के किस आवर्त में हैं ?
उत्तर-
(क) तत्व ‘X’ प्रथम वर्ग या वर्ग संख्या 1 में तथा तत्व ‘Y’ सप्तम वर्ग या वर्ग संख्या 17 में है।
(ख) तत्व ‘X’ धातु तथा तत्व ‘Y’ अधातु है।
(ग) ये दोनों तत्व आवर्त सारणी के तीसरे आवर्त में हैं।
प्रश्न 10.
आवर्त सारणी के समूह-14 के एक तत्व की परमाणु संख्या 14 है। कारण सहित समझाइए कि तत्व में धात्विक गुणधर्म विद्यमान होगा अथवा नहीं।
उत्तर-
आवर्त सारणी के समूह-14 के एक तत्व X की परमाणु संख्या 14 है। इसका इलेक्ट्रॉन विन्यास निम्न प्रकार से होगा
X (14) = 2, 8, 4
इस इलैक्ट्रॉनिक विन्यास से स्पष्ट है कि तत्व के अंतिम कक्ष में इलैक्ट्रॉन की संख्या 4 है जो सारणी के दाईं ओर स्थित है। अतः यह धातु और अधातु के बीच के गुण से युक्त तत्व है जिसे उपधातु कहते हैं। अतः यह कहा जा सकता है कि दिया हुआ तत्व धातु नहीं है तथा प्रकृति की दृष्टि से तत्व अधातु होता है। .
प्रश्न 11.
आवर्त में बाएं से दाएं चलने पर परमाणु आकार में क्या परिवर्तन होता है ? अपने उत्तर का स्पष्टीकरण दीजिए।
उत्तर-
परमाणु आकार से तात्पर्य परमाणु की त्रिज्या से है। अत: आवर्त के अनुदिश बाएं से दाएं चलने पर परमाणु आकार अथवा परमाणु त्रिज्या घटती है। इसका कारण यह है कि तत्वों के परमाणुओं का नाभिकीय आवेश बढ़ जाता है जिसे नाभिक इलैक्ट्रॉन को अधिक बल से खींचता है तथा फलस्वरूप इलैक्ट्रॉनों का नाभिक के समीप हो जाने के कारण परमाणु आकार कम हो जाता है।
प्रश्न 12.
स्पष्ट कीजिए कि आर्गन परमाणु का आकार क्लोरीन परमाणु से बड़ा क्यों होता है ?
उत्तर-
आर्गन (Ar) परमाणु एक सक्रिय गैस परमाणु है जो संरचनात्मक रूप से स्थायी होता है चूंकि इसके बाह्यतम कोश में इलैक्ट्रॉनों का अष्टक (आठ इलैक्ट्रॉन) होता है। इसका आकार क्लोरीन से बड़ा होता है, क्लोरीन (हैलोजेन) परमाणु के बाह्यतम कोश में केवल 7 इलैक्ट्रॉन होते हैं जो इसके नाभिक पर अत्यधिक धनावेश का कारण है। इसके परिणामस्वरूप इसके इलैक्ट्रॉन नाभिक की ओर खिंचते हैं तथा नाभिक के समीप आ जाते हैं जिससे इसका आकार कम हो जाता है।
![]()
प्रश्न 13.
बेरियम ( परमाणु क्रमांक = 56) की आवर्त सारणी में स्थिति की विवेचना कीजिए तथा निम्नलिखित के उत्तर दीजिए।
(i) यह धातु है या अधातु ?
(ii) यह सीजियम से बड़ा है या छोटा ?
(iii) इसकी संयोजकता क्या है ?
(iv) बेरियम क्लोराइड का सूत्र लिखिए।
उत्तर-
Ba (परमाणु क्रमांक = 56) 2, 8, 18, 18, 8, 2 यह छठे आवर्त तथा II-A, वर्ग में स्थित है। (चूंकि कोशों की संख्या 6 है तथा संयोजी इलेक्ट्रॉन की संख्या 2 है)।
(i) बेरियम एक धातु है क्योंकि यह आवर्त सारणी में बाईं ओर तथा वर्ग में नीचे की ओर स्थित है।
(ii) बेरियम परमाणु का आकार सीजियम (Cs) से छोटा है क्योंकि आवर्त में बाएं से दाएं चलने पर परमाणु आकार घटता है। बेरियम (Ba) तथा सीजियम (Cs) एक ही आवर्त में स्थित है तथा बेरियम (Ba), सीज़ियम (Cs) के दाईं ओर स्थित है।
(iii) इसकी संयोजकता 2 है क्योंकि इसमें 2 संयोजी इलैक्ट्रॉन हैं। यह दो इलैक्ट्रॉन त्याग कर के द्विसंयोजक धनात्मक बन जाता है।
(iv) बेरियम क्लोरड का सूत्र है : BaCl
प्रश्न 14.
निम्नलिखित दिए गए प्रथम वर्ग के तत्वों की परमाणु त्रिज्याओं में परिवर्तन का अध्ययन कीजिए
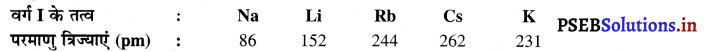
(i) उन तत्वों के नाम बताइए जिनके परमाणु सबसे बड़े तथा सबसे छोटे हैं ?
(ii) वर्ग में परमाणु त्रिज्या किस प्रकार परिवर्तित होती है ?
उत्तर-
(i) सोडियम (Na) के परमाणु सबसे छोटे हैं। सीजियम (Cs) के परमाणु सबसे बड़े हैं।
(ii) वर्ग में नीचे जाने पर परमाणु त्रिज्या बढ़ती है।
प्रश्न 15.
किसी तत्व के धन आयन का आकार उसी तत्व के परमाणु से बड़ा होता है या छोटा ? अपने उत्तर की पुष्टि कीजिए।
उत्तर-
किसी तत्व के धन आयन का आकार उस तत्व के परमाणु से छोटा होता है। इसके निम्नलिखित कारण होते हैं
- जब धन आयन बनता है तो उस तत्व का परमाणु कुछ इलैक्ट्रॉन का त्याग करता है जबकि नाभिक में प्रोटॉनों की संख्या पूर्ववत् रहती है जिससे नाभिक तथा इलैक्ट्रॉनों के बीच आकर्षण बढ़ जाता है। आकर्षण बल की अधिकता से इलैक्ट्रॉन नाभिक के समीप आ जाते हैं और फलस्वरूप परमाणु का आकार छोटा हो जाता है।
- कभी कभी इलैक्ट्रॉन निकल जाने से धनायन बनाने पर कोशों की संख्या में भी कमी आ जाती है, उक्त दोनों कारणों के कारण धनायन का आकार तत्व के परमाणु से छोटा होता है। उदाहरणार्थ, धनायन (Na+) का आकार परमाणु (Na) से छोटा होता है।
प्रश्न 16.
किसी तत्व की परमाणु संख्या 33 है। उसकी आवर्त सारणी में स्थिति ज्ञात कीजिए। ..
उत्तर-
तत्व की परमाणु संख्या 33 है अर्थात् इसका इलैक्ट्रॉनिक विन्यास 2, 8, 18, 5 है। चूंकि इस तत्व में कुल चार इलैक्ट्रॉन कोश हैं, इसलिए यह आवर्त सारणी के चौथे आवर्त में स्थित है | इस तत्व में संयोजकता इलैक्ट्रॉनों (बाह्य कोश में इलैक्ट्रॉनों) की संख्या 5 है, इसलिए यह V-A वर्ग में स्थित है। इस प्रकार परमाणु संख्या 33 वाला तत्व चौथे आवर्त तथा V-A वर्ग में स्थित है।
प्रश्न 17.
न्यूलैंड के अष्टक नियम का वर्णन करो।
उत्तर-
सन् 1864 में न्यूलैंड ने तत्वों के वर्गीकरण का अष्टक नियम स्थापित किया। इसके अनुसार जब तत्वों को बढ़ते परमाणु द्रव्यमान के अनुसार दर्शाया जाता है तो संगीत के सुरों की भांति प्रत्येक आठवें तत्व के गुण पहले तत्व के गुणों के समान होते हैं। ये गिनती किसी भी तत्व से शुरू की जा सकती है।
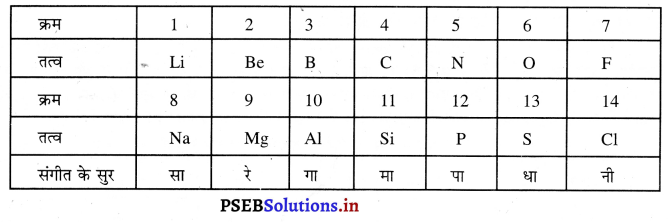
इस वर्गीकरण के अनुसार सोडियम का क्रम 8 है। उसके गुण पहले क्रम में उपस्थित तत्व लिथियम (Li) के गुणों से मिलते-जुलते होंगे। इस प्रकार बोरॉन (B) से आठवां तत्व एल्यूमीनियम (Al) है तथा इन दोनों तत्वों के गुण एकदूसरे से परस्पर मिलते-जुलते होंगे।
![]()
प्रश्न 18.
निम्न लिखित कथन का क्या भाव है ? “तत्वों के गुण उनके परमाणु अंकों के आवर्ती फलन (Periodic Functions) हैं।”
उत्तर-
कथन-“तत्वों के गुण उनके परमाणुओं के आवर्ती फलन (Functions) हैं।” आधुनिक आवर्त नियम कहलाता है।
आवर्तता या आवर्त फलन (Periodic function)-आवर्त फलन का अर्थ है कि जब तत्वों को एक विशेष समूह ऊर्ध्वाधर पंक्ति में उनके परमाणुओं के बढ़ते क्रम में व्यवस्थित किया जाता है, तो उनके गुणों की पुनरावृत्ति होती है। ऊर्ध्वाधर पंक्ति में रखे गए तत्वों के गुणों की 2, 8, 8, 18, 18, 32 परमाणु अंकों के लगातार अंतर से पुनरावृत्ति होती है। इन अंकों को जादुई अंक (Magic Numbers) कहते हैं।
तत्वों के गुण उनके परमाणु के विभिन्न ऊर्जा स्तरों में इलैक्ट्रॉनों के विभाजन मुख्यतः संयोजक ऊर्जा स्तर में इलैक्ट्रॉनों के विभाजन पर निर्भर करते हैं। उन परमाणुओं को, जिनके संयोजक ऊर्जा स्तर में इलैक्ट्रॉन विन्यास एक जैसा होता है, एक जैसे गुण प्रदर्शित करते हैं। जब तत्वों को आवर्त सारणी में उनके परमाणु अंकों के बढ़ते क्रम के आधार पर व्यवस्थित किया जाता है तो तत्वों के संयोजकता ऊर्जा स्तर में समान इलैक्ट्रॉन विन्यास की मैजिक अंक 2, 8, 8, 18, 18 और 32 के बाद क्रमशः एक विशेष लंबात्मक पंक्ति (समूह) में पुनरावृत्ति होती है।
प्रश्न 19.
आवर्त सारणी के कोई दो लाभ बताएं।
उत्तर-
- आवर्त सारणी ने रसायन विज्ञान को सुगम तथा सरल बना दिया है क्योंकि एक जैसे गुणों वाले तत्व एक वर्ग में रखे गए हैं।
- आवर्त सारणी ने कुछ तत्वों के परमाणु द्रव्यमानों में सुधार किया है।
प्रश्न 20.
निम्नलिखित तत्वों के जोड़ों में से किस तत्व का आकार छोटा है? अपने उत्तर के पक्ष में प्रमाण दें।
(i) सोडियम या पौटेशियम
(ii) मैग्नीशियम या क्लोरीन।
उत्तर-
(i) सोडियम तथा पौटेशियम दोनों एक ही वर्ग/समूह (Group) I के तत्व हैं। समूह में ऊपर से नीचे की ओर जाने पर पहले सोडियम और फिर तत्व | त्रिज्या (pm) पौटेशियम स्थित है। सोडियम तथा पौटेशियम का इलैक्ट्रॉनिक विन्यास क्रमश: (2, 8, 1) तथा (2, 8, 8, 1) है। इलैक्ट्रॉनिक विन्यास देखने से स्पष्ट हो जाता है कि सोडियम में तीन इलैक्ट्रॉनिक शैल (कोश) तथा पौटेशियम में चार इलैक्ट्रॉनिक शैल हैं। हम देखते हैं कि समूह में ऊपर से नीचे जाने पर तत्वों के कोशों में वृद्धि के कारण नाभिक और बाहरी कोश की दूरी, जिसे परमाणु की त्रिज्या कहते हैं, बढ़ जाती है अर्थात् परमाणु का आकार बढ़ जाता है। इससे स्पष्ट है कि सोडियम परमाणु का आकार पौटेशियम परमाणु के आकार की अपेक्षा छोटा है।
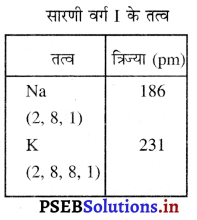
(ii) मैग्नीशियम तथा क्लोरीन दोनों आवर्त (Period) तीन के तत्व हैं। आवर्त में बाईं ओर से दाईं ओर जाने पर पहले मैग्नीशियम और फिर अंत में क्लोरीन स्थित है। हम जानते हैं कि आवर्त (Period) में बाईं ओर से दाईं ओर जाने पर परमाणु का अर्धव्यास/त्रिज्या घटती है। इसका कारण है कि नाभिक में आवेश बढ़ने से नाभिक इलैक्ट्रॉनों को अपनी ओर आकर्षित करता है जिससे परमाणु का आकार छोटा हो जाता है। अत: मैग्नीशियम की अपेक्षा क्लोरीन का आकार छोटा है।
सारणी-तीसरे आवर्त के तत्वों की परमाणु त्रिज्या तीसरे आवर्त के तत्व
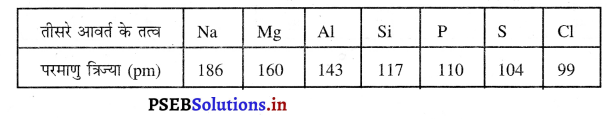
प्रश्न 21.
निम्नलिखित की परिभाषा दें :
(i) परमाण्विक अर्ध-व्यास
(ii) आयनन ऊर्जा।
(iii) इलैक्ट्रॉन बंधुता
(iv) वेलैंस इलैक्ट्रॉन।
उत्तर-
(i) परमाण्विक अर्ध-व्यास-किसी एक परमाणु के न्यूक्लियस के परमाणु बिंदु तथा बाह्यतम शैल की मध्य की दूरी का माप होता है। इसे साधारणतः पीकोमीटर (10-12m) में मापा जाता है।
(ii) आयनन ऊर्जा- किसी तत्व के एक गैसीय परमाणु आयन से कमजोर रूप से बंधित इलैक्ट्रॉन पूरी तरह हटाने के लिए आवश्यक ऊर्जा को आयनन ऊर्जा कहते हैं। इसे संक्षेप में I.E. लिखा जाता है। आयनन ऊर्जा को किलो जूल प्रति मोल में मापा जाता है।
(iii) इलैक्ट्रॉन बंधुता- जब किसी तत्व के एक उदासीन गैसीय परमाणु द्ववारा इलैक्ट्रॉन ग्रहण किया जाता है तो ऊर्जा की मात्रा में हुए परिवर्तन को इलैक्ट्रॉन कहते हैं। इसे संक्षेप में E.A. लिखा जाता है। इसे किलो जूल प्रति मोल में मापा जाता है।
(iv) वेलैंस इलैक्ट्रॉन-किसी तत्व के परमाणु के बाह्यतम कोश में जितने इलैक्ट्रॉन उपस्थित होते हैं, उन्हें संयोजक इलैक्ट्रॉन अथवा वेलैंस इलैक्ट्रॉन कहा जाता है।
प्रश्न 22.
निम्नलिखित से क्या अभिप्राय है :
(i) आवर्तता
(ii) आवर्ती सारणी
(iii) तत्वों का वर्गीकरण
(iv) न्यूलैंड के अष्टक
(v) आवर्त सारणी का समूह
(vi) आवर्त सारणी का आवर्त
(vii) क्षारीय गुणों वाले धातु
(viii) क्षार धातु
(ix) प्राकृतिक तत्व
(x) धातु
(xi) अपधातु
(xii) धात्विक तत्व का परमाण्विक अर्ध-व्यास।
उत्तर-
(i) आवर्तता-तत्वों को उनके परमाणु अंकों के बढ़ते क्रम में व्यवस्थित करने से उनके गुणों का निश्चित गैप (अवधि) के पश्चात् दोहराए जाने को तत्वों के गुणों की आवर्तता कहते हैं। तत्वों के गुणों में आवर्तता का कारण उनके परमाणुओं के वेलैंस शैलों के निश्चित अवधि के बाद एक जैसी इलैक्ट्रॉनिक विन्यास का दोहराया जाना है।
(ii) आवर्ती सारणी-तत्वों की आवर्त सारणी तत्वों का सारणीय रूपी चार्ट है जिसको इस प्रकार से रचा गया है कि एक जैसे गुणों वाले तत्व कुछ गैप (अवधि) के पश्चात् ऊर्ध्वाधर कॉलम में उपस्थित होते हैं क्योंकि एक जैसे गुणों वाले चार्ट में निश्चित अवधि के पश्चात् उपस्थित होते हैं और तत्वों को सारणी के रूप में व्यवस्थित किया गया था। इसलिए इसे आवर्त सारणी (Periodic Table) का नाम दिया गया है।
(iii) तत्वों का वर्गीकरण-ज्ञात तत्वों को ऐसे ढंग से व्यवस्थित करना कि समान गुणों वाले तत्व एक साथ हो जाएं जबकि भिन्न गुणों वाले तत्व अलग समूह में एकत्रित हो जाएं तो उसे तत्वों का वर्गीकरण कहते हैं।
(iv) न्यूलैंड के अष्टक- तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित करने से आठ तत्वों के संग्रह को न्यूलैंड के अष्टक कहते हैं।
(v) आवर्त सारणी का समूह- तत्वों की आवर्त सारणी में तत्वों के ऊर्ध्वाधर (लंबात्मक पंक्ति) कॉलम को समूह (Group) कहते हैं। –
(vi) आवर्त सारणी का आवर्त- तत्वों की आवर्त सारणी में तत्वों की क्षितिज पंक्तियों को आवर्त (Period) कहते हैं।
(vii) क्षारीय गुणों वाले धातु-ये आवर्त सारणी के s-ब्लॉक के दूसरे ग्रुप के तत्व हैं जिनका सामान्य सूत्र ns2 है। ये तत्व बैरीलियम, मैग्नीशियम, कैल्शियम, स्ट्रांशियम, बेरियम तथा रेडॉन हैं।
(vii) क्षार धातु-ये आवर्त सारणी के s-ब्लॉक के पहले ग्रुप के तत्व हैं जिनका सामान्य सूत्र ns1 है। इनमें लिथियम, सोडियम, पोटैशियम आदि धातुएं हैं। ये धातुएं बहुत नरम होती हैं और इनकी आयनन ऊर्जा बहुत कम होती है।
(ix) प्राकृतिक तत्व-वे तत्व जो प्रकृति में मिलते हैं, उन्हें प्राकृतिक तत्व कहा जाता है।
(x) धातु- वे तत्व जो साधारणत: कठोर, अघातवर्ध्य तथा तन्यशील, चमकदार, विद्युत् तथा ताप के सुचालक हैं और जो सुगमता से इलैक्ट्रॉन को त्याग कर विद्युतीय धन-आवेशित आयन (कैटायन) बना सकते हों, उन्हें धातु कहते हैं।
(xi) अपधातु-तत्वों की दीर्घ आवर्त सारणी में धातुओं और अधातुओं को पृथक् करने वाली सीमा के ऊपर दोनों धातुओं और अधातुओं के गुण रखने वाले तत्वों को अप-धातु कहते हैं।
(xii) धात्विक तत्व का परमाण्विक अर्ध-व्यास-तत्व के धात्विक क्रिस्टल में दो परमाणु एक-दूसरे के संपर्क में धात्विक आयनों (परमाणुओं) के न्यूक्लियसों की दूरी के आधे के बराबर मानी गई दूरी को धात्विक तत्व का परमाण्विक अर्ध-व्यास कहते हैं।
![]()
प्रश्न 23.
मेंडलीफ की आवर्त सारणी की कोई दो विशेषताएं और दो विषमताएं बताएं।
उत्तर-
मेंडलीफ की आवर्त सारणी की विशेषताएं-
- मेंडलीफ की आवर्त सारणी ने तत्वों के रसायन विज्ञान को सरल बना दिया है क्योंकि एक समान गुण वाले सभी तत्वों को एक समूह में एकत्रित कर दिया जाता है ताकि समूह के एक सदस्य के गुणों से दूसरे सदस्यों के गुणों का अनुमान लगाया जा सके।
- मेंडलीफ की आवर्त सारणी में कुछ तत्वों के परमाणु द्रव्यमान ठीक करने के लिए योगदान डाला है। उदाहरणत: बैरीलियम का द्रव्यमान 13.5 से ठीक करके 9 कर दिया है।
मेंडलीफ की आवर्त सारणी की विषमताएं –
- मेंडलीफ की आवर्त सारणी में तत्वों के विभिन्न समस्थानिकों के लिए उचित स्थान नहीं है।
- कुछ तत्वों के युग्मों को उनके परमाणु द्रव्यमान (Atomic) के बढ़ते क्रम में नहीं रखा गया है, परंतु उनके गुणों को ध्यान में रख कर स्थान निश्चित किया गया है।
- यद्यपि हाइड्रोजन अधातु है, परंतु इसके बावजूद इसको लिथियम, सोडियम, पोटैशियम आदि धातुओं के . साथ रखा गया है।
- उत्कृष्ट गैसों की खोज के बाद इनके लिए इस सारणी में कोई स्थान नहीं है।
प्रश्न 24.
इलैक्ट्रॉन आकर्षण किसे कहते हैं ? इलैक्ट्रॉन आकर्षण किस बात पर निर्भर करता है ?
उत्तर-
इलैक्ट्रॉन आकर्षण- जब किसी तत्व के उदासीन गैसीय परमाणु द्वारा इलैक्ट्रॉन ग्रहण किया जाता है तो ऊर्जा की मात्रा में हुए परिवर्तन को इलैक्ट्रॉन आकर्षण कहते हैं। दूसरे शब्दों में, इलैक्ट्रॉन आकर्षण किसी तत्व के परमाणु की इलैक्ट्रॉन के लिए आकर्षण है। इस प्रक्रिया के दौरान उत्पन्न हुए ऋण आवेशित हुए आयन को ऐनायन कहते हैं। इलैक्ट्रॉन आकर्षण (Electron Affinity) को संक्षेप में E.A के रूप में प्रदर्शित किया जाता है। इसे किलो जूल प्रति मोल (Kilo Joule per mole या KJ mol-1) से मापा जाता है।

इलैक्ट्रॉन आकर्षण की निर्भरता- इलैक्ट्रॉन आकर्षण अधिकांश न्यूक्लीय आवेश, इलैक्ट्रॉन विन्यास तथा परमाणु आकार पर निर्भर करता है।
- न्यूक्लीय आवेश बढ़ने के साथ इलैक्ट्रॉन आकर्षण बढ़ता है।
- परमाणु आकार के कम होने से इलैक्ट्रॉन आकर्षण बढ़ता है।
- जब इलैक्ट्रॉन ग्रहण करने वाले तत्व के परमाणु की इलैक्ट्रॉनिक विन्यास पहले से ही स्थायी हो तो इलैक्ट्रॉनिक आकर्षण का मूल्य शून्य (0) होता है।
प्रश्न 25.
आधुनिक आवर्त सारणी के किसी आवर्त में बाएं से दाएं जाते समय (i) परमाणु आकार और (ii) धात्विक गुण कैसे बदलते हैं ?
उत्तर-
(i) आवर्त के अनुदिश बाएं से दाएं जाते समय परमाणु आकार अथवा परमाणु त्रिज्या घटती है।
(ii) आवर्त सारणी के किसी आवर्त में बाएं से दाएं जाने पर तत्त्वों की धात्विक प्रकृति घटती है या कम होती है।
प्रश्न 26.
आधुनिक आवर्त सारणी के किसी ग्रुप में ऊपर से नीचे जाते समय
(i) परमाणु आकार और
(ii) धात्विक गुण कैसे बदलते हैं ?
उत्तर-
(i) आवर्त सारणी के किसी समूह में ऊपर से नीचे जाते समय परमाणु के आकार में वृद्धि होती है।
(ii) आवर्त सारणी के किसी समूह (ग्रुप) में ऊपर से नीचे की ओर जाने पर तत्त्वों का धात्विक स्वभाव अधिक होता जाता (बढ़ता) है।
प्रश्न 27.
तत्त्वों की आधुनिक आवर्त सारणी में किसी पीरियड में
(i) धात्विक स्वभाव और
(ii) संयोजकता बायें से दायें जाने पर कैसे बदलते हैं ?
उत्तर-
(i) आवर्त सारणी के आवर्त (पीरियड) में बायें से दायें जाने पर तत्त्वों के धात्विक गुणों में वृद्धि होती है।
(ii) आवर्त सारणी के किसी पीरियड में बायें से दायें जाने पर संयोजकता पहले 1 से 4 तक बढ़ती है और फिर 4 से कम होती होती शून्य हो जाती है।
प्रश्न 28.
एक परमाणु का इलैक्ट्रॉनी विन्यास 2, 8, 7 है।
(1) इस तत्व की परमाणु संख्या क्या है ? तत्व का नाम भी बताओ।
(2) निम्न में से किस तत्व के साथ इसकी रासायनिक समानता होगी ?
N(7), F (9), P(15), Ar(18).
उत्तर-
(1) तत्व की परमाणु संख्या = 2 + 8 + 7 = 17 तत्व का नाम-क्लोरीन।
(2) इस तत्व की समानता N (7) तथा F (9) के साथ है।
प्रश्न 29.
तत्वों के वर्गीकरण के लिए न्यूलैंड का अष्टक का नियम लिखें।
उत्तर-
न्यूलैंड का अष्टक का नियम-इस नियम के अनुसार जब तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम अनुसार व्यवस्थित किया जाता है तो प्रत्येक आठवें तत्व के गुण पहले तत्व के गुणों के समान होते हैं। समान गुणों वाले तत्वों के पुनः दोहराने की विधि उसी प्रकार है जिस प्रकार संगीत स्केल के सुर पीछे आठवें सुर से दोहराए जाते हैं।
प्रश्न 30.
सोडियम [Na] तथा गंधक/सल्फर [S] दोनों आधुनिक आवर्त सारणी के तीसरे आवर्त में हैं। इनमें से कौन-सा अधिक धात्विक है और क्यों ?
उत्तर-
तत्व सोडियम [Na] अधिक धात्विक होगा। किसी आवर्त में बायें से दायें जाते समय तत्वों के धात्विक लक्षण में कमी होती है। ऐसा इस लिए होता है कि तत्वों की इलैक्ट्रॉन त्यागने की प्रवृत्ति धीरे-धीरे कम होती जाती है।
![]()
प्रश्न 31.
तत्वों के वर्गीकरण का मेंडलीफ आवर्त नियम लिखो।
उत्तर-
तत्वों के वर्गीकरण का मेंडलीफ आवर्त नियम-मेंडलीफ ने सभी तत्वों को आवर्त सारणी में उनके परमाणु पुंज के चढ़ते क्रम में व्यवस्थित किया जिससे एक समान भौतिक तथा रासायनिक गुणों वाले भिन्न-भिन्न तथा एक निश्चित पीरियड के बाद दोबारा आ जाते हैं। इस आधार को मुख्य रख कर मेंडलीफ ने आवर्त सारणी बनाई जिसका नियम है : “तत्वों के गुण उनके परमाणु पुंज के आवर्त फंक्शन (फलन ) होते हैं।”
अति लघु उत्तरात्मक प्रश्न (Very Short Answer Type Questions)
प्रश्न 1.
बृहत् आवर्त सारणी का आधार क्या है ?
उत्तर-
परमाणु संख्या और इलैक्ट्रॉन का वितरण।
प्रश्न 2.
हैलोजन परिवार के तत्वों में कितने संयोजकता इलैक्ट्रॉन होते हैं ?
उत्तर-
इसमें सात संयोजकता इलैक्ट्रॉन होते हैं।
प्रश्न 3.
चौथे आवर्त में कितने तत्व विद्यमान होते हैं ?
उत्तर-
चौथे आवर्त में कुल 18 तत्व हैं।
प्रश्न 4.
Mg2+ आयन में कितने इलैक्ट्रॉन विद्यमान हैं ?
उत्तर-
इसमें दस इलैक्ट्रॉन विद्यमान हैं।
प्रश्न 5.
Na और Mg में से किसका आकार बड़ा है ?
उत्तर-
सोडियम (Na) का आकार मैग्नीशियम (Mg) से बड़ा होता है।
प्रश्न 6.
नाइट्रोजन की संयोजकता क्या है ?
उत्तर-
इसकी संयोजकता तीन (3) है।
प्रश्न 7.
Li और Na में से कौन अधिक सक्रिय है ?
उत्तर-
Na अधिक सक्रिय है।
![]()
प्रश्न 8.
उन तत्वों का उल्लेख कीजिए जिनकी खोज मेंडलीफ की आवर्त सारणी बनाने के बाद हुई।
उत्तर-
स्कैडियम (Sc), गैलियम (Ga) तथा जर्मेनियम (Ge) आदि ऐसे उदाहरण है जिन्हें आवर्त सारणी बनाने के बाद खोजा गया था।
प्रश्न 9.
मेंडलीफ की आवर्त सारणी में वर्गों तथा आवर्तों की संख्या लिखिए।
उत्तर-
नौ वर्ग (समूह) तथा सात आवर्त हैं।
प्रश्न 10.
आवर्त सारणी के एक-ही आवर्त के तत्वों के परमाणु के आकार किस प्रकार परिवर्तित होते हैं ?
उत्तर-
आवर्त सारणी के एक-ही आवर्त के तत्वों के परमाणु के आकार बाईं से दाईं ओर क्रमिक रूप से घटते हैं।
प्रश्न 11.
किसी तत्व का इलैक्ट्रॉनिक विन्यास 2, 8, 3 है। इसे आवर्त सारणी के किस समूह में रखना उचित होगा?
उत्तर-
इसे आवर्त सारणी के तृतीय समूह में रखना उचित होगा।
प्रश्न 12.
तीन तत्वों X, Y, Z में से X और Z के परमाणु भार 35.5 और 127 हैं। डॉबेरेनर के त्रिक के आधार पर Y का परमाणु भार ज्ञात करो।
उत्तर-
Y का परमाणु भार = \(\frac{35.5+127}{2}\) = 81.25
प्रश्न 13.
आवर्त सारणी में फॉस्फोरस को किस आवर्त और किस समूह में रखा गया है ?
उत्तर-
आवर्त सारणी में फॉस्फोरस को तृतीय आवर्त तथा V-A समूह में रखा गया है।
प्रश्न 14.
किसी तत्व के इलैक्ट्रॉनिक विन्यास 2, 8, 8, 2 हैं। इसे आवर्त सारणी के किस वर्ग एवं आवर्त में रखना उचित है ?
उत्तर-
इस तत्व की वर्ग संख्या II-A तथा आवर्त संख्या चार है।
प्रश्न 15.
एक तत्व M आवर्त सारणी के तीसरे समूह में हैं, इसे ऑक्साइड का सूत्र लिखिए।
उत्तर-
M2O3.
प्रश्न 16.
तत्वों की आधुनिक आवर्त सारणी को कितने समूहों एवं आवों में विभक्त करते हैं ?
उत्तर-
तत्वों की आधुनिक आवर्त सारणी को 7 आवर्तों और 18 वर्गों में विभाजित किया गया है। आवर्त को क्षैतिज स्तंभ तथा वर्गों की ऊर्ध्वाधर स्तंभ भी कहते हैं।
प्रश्न 17.
मेंडलीफ का आवर्त नियम लिखिए।
उत्तर-
तत्वों के भौतिक और रासायनिक गुण उनके परमाणु भार के आवर्ती फलन होते हैं।
![]()
प्रश्न 18.
मेंडलीफ ने अपनी सारणी किसे ध्यान में रखकर बनाई थी ?
उत्तर-
तत्वों के परमाणु द्रव्यमान की वृद्धि क्रम को ध्यान में रख कर।
प्रश्न 19.
मेंडलीफ आवर्त सारणी में कुल कितने वर्ग हैं ?
उत्तर-
मेंडलीफ आवर्त सारणी में I से VIII तक तथा इसके बाद शून्य (0) समूह को मिलाकर कुल नौ वर्ग हैं।
प्रश्न 20.
आवर्त में फॉस्फोरस के बाद आने वाले तत्व का नाम बताइए।
उत्तर-
इस तत्व का नाम सल्फर (S) है।
प्रश्न 21.
नाइट्रोजन और फॉस्फोरस किस वर्ग से संबंधित हैं ?
उत्तर-
ये दोनों वर्ग VA से संबंधित हैं।
प्रश्न 22.
Mg और AI में कौन-सा अधिक धात्वीय है ?
उत्तर-
मैग्नीशियम (Mg) अधिक धात्वीय है।
प्रश्न 23.
निष्क्रिय तत्व आवर्त सारणी के किस वर्ग में हैं ?
उत्तर-
सभी निष्क्रिय तत्व आवर्त सारणी के शून्य वर्ग में हैं।
वस्तुनिष्ठ प्रश्न (Objective Type Questions)
बहु-विकल्पीय प्रश्न
प्रश्न 1.
अष्टक नियम का प्रतिपादन किया –
(a) न्यूलैंड ने
(b) डॉबेराइनर ने
(c) मेंडलीफ ने
(d) लोथर मेयर ने
उत्तर-
(a) न्यूलैंड ने।
प्रश्न 2.
आवर्त नियम के जनक थे.
(a) न्यूलैंड
(b) डॉबेराइनर
(c) मेंडलीफ
(d) लोथर मेयर।
उत्तर-
(c) मेंडलीफ।
प्रश्न 3.
एक तत्व का इलेक्ट्रॉनिक विन्यास 2, 8, 1 है, तत्व उपस्थित है.
(a) समूह 2 में
(b) समूह 18 में
(c) समूह 8 में
(d) समूह 10 में।
उत्तर-
(b) समूह 18 में।
![]()
प्रश्न 4.
निम्नलिखित में से कौन-सा विन्यास धात्विक गुण प्रदर्शित करता है?
(a) 2,8,2
(b) 2,8,4
(c) 2,8,8
(d) 2,7.
उत्तर-
(a) 2,8,2.
प्रश्न 5.
मेंडलीफ आवर्त नियम के अनुसार, आवर्त सारणी में तत्वों की व्यवस्था है
(a) परमाणु संख्या के बढ़ते क्रम में
(b) परमाणु संख्या के घटते क्रम में
(c) परमाणु द्रव्यमान के बढ़ते क्रम में
(d) परमाणु द्रव्यमान के घटते क्रम में।
उत्तर-
(c) परमाणु द्रव्यमान के बढ़ते क्रम में।
प्रश्न 6.
मेंडलीफ आवर्त सारणी में, बाद में खोजे जाने वाले तत्वों के लिए स्थान छोड़े गए थे। आवर्त सारणी में निम्नलिखित तत्वों में से किसने बाद में स्थान प्राप्त किया? ।
(a) जर्मेनियम
(b) क्लोरीन
(c) ऑक्सीजन
(d) सिलिकॉन।
उत्तर-
(a) जर्मेनियम।
प्रश्न 7.
निम्नलिखित में से कौन-सा आवर्त-2 के तत्वों के लिए बाह्यतम कोश है ?
(a) K – कोश
(b) L- कोश
(c) M – कोश
(d) N – कोश
उत्तर-
(b) L – कोश।
प्रश्न 8.
निम्नलिखित तत्वों में से किसकी परमाणु त्रिज्या सबसे बड़ी होगी ?
(a) Mg
(b) Na
(c) K
(d) Ca.
उत्तर-
(c) K.
प्रश्न 9.
आवर्त सारणी में किसी आवर्त में बाएं से दाएं जाने पर परमाणु साइज –
(a) बढ़ता है
(b) घटता है
(c) पर्याप्त नहीं बदलता है
(d) पहले बढ़ता है और फिर घटता है।
उत्तर-
(b) घटता है।
प्रश्न 10.
मेंडलीफ ने बेरॉन तथा ऐलुमीनियम के बीच में नए तत्व के लिए खाली स्थान छोड़ा था जो बाद में खोजा गया था यह तत्व है
(a) Na
(b) Ca
(c) Ga
(d) Ba.
उत्तर-
(c) Ga.
![]()
रिक्त स्थानों की पूर्ति कीजिए
(i) …………………. का इलेक्ट्रॉनिक विन्यास 2, 8, 2 है।
उत्तर-
मैग्नीशियम
(ii) डाबेराइनर ने तीन-तीन तत्व वाले कुछ समूहों को चुना एवम् इन समूहों को …………………………. कहा।
उत्तर-
त्रिक्
(iii) आधुनिक आवर्त सारणी में …………………………. क्षैतिज पंक्तियाँ हैं।
उत्तर-
7
(iv) आधुनिक आवर्त सारणी में टेढ़ी-मेढ़ी रेखा धातुओं को ………………………… से अलग करती है।
उत्तर-
अधातुओं
(v) सन् 1866 में अंग्रेज़ वैज्ञानिक जॉन न्यूलैंड्स ने ज्ञात तत्वों को ……………………………….. के आरोही क्रम में व्यवस्थित किया।
उत्तर-
परमाणु द्रव्यमान।