Punjab State Board PSEB 5th Class Welcome Life Book Solutions Chapter 2 ਭਾਈਚਾਰਕ ਸਾਂਝ Textbook Exercise Questions and Answers.
PSEB Solutions for Class 5 Welcome Life Chapter 2 ਭਾਈਚਾਰਕ ਸਾਂਝ
Welcome Life Guide for Class 5 PSEB ਭਾਈਚਾਰਕ ਸਾਂਝ Textbook Questions and Answers
(ਓ) ਜਮਾਤ ਪੱਧਰ ‘ਤੇ
ਪਿਆਰੇ ਬੱਚਿਓ, ਅੱਜ ਆਪਾਂ ‘ਭਾਈਚਾਰਕ ਸਾਂਝ’ ਵਿਸ਼ੇ ‘ਤੇ ਗੱਲਬਾਤ ਕਰਾਂਗੇ ਸਾਨੂੰ ਪਤਾ ਹੈ ਕਿ ਇੱਕ ਬੱਚੇ ਦਾ ਅਰਥ ਜਮਾਤ ਨਹੀਂ ਹੁੰਦੀ ਕਈ ਬੱਚਿਆਂ ਨਾਲ ਇੱਕ ਜਮਾਤ ਬਣਦੀ ਹੈ, ਜਿਵੇਂ ਤੁਹਾਡੀ ਜਮਾਤ। ਘਰ, ਸਕੂਲ, ਪਿੰਡ ਤੋਂ ਲੈ ਕੇ ਦੇਸ ਤੱਕ ਅਸੀਂ ਇਕੱਲੇ ਨਹੀਂ ਰਹਿ ਸਕਦੇ ਸਾਡੀਆਂ ਬਹੁਤ ਸਾਰੀਆਂ ਜ਼ਰੂਰਤਾਂ ਹਨ, ਜਿਸ ਕਰਕੇ ਅਸੀਂ ਹੋਰਨਾਂ ਲੋਕਾਂ ਨਾਲ ਸੰਬੰਧ ਵਧਾਉਂਦੇ ਹਾਂ ਸਾਡੀਆਂ ਲੋੜਾਂ ਹੀ ਭਾਈਚਾਰਕ ਸਾਂਝ ਪੈਦਾ ਕਰਦੀਆਂ ਹਨ ਭਾਈਚਾਰਕ ਸਾਂਝ ਇੱਕ ਵਿਅਕਤੀ ਦਾ ਦੂਜੇ ਪ੍ਰਤੀ ਵਿਸ਼ਵਾਸ, ਪਿਆਰ, ਆਦਾਨ-ਪ੍ਰਦਾਨ ਅਤੇ ਸਮਰਪਣ ਹੈ ਆਓ, ਆਪਾਂ ਕੋਈ ਸਮੂਹਿਕ ਕਾਰਜ ਕਰੀਏ
ਅਧਿਆਪਕ ਵੱਲੋਂ ਕੰਮ : ਤੁਸੀਂ ਬੱਚੇ ਮਿਲ ਕੇ ਇੱਕ ਚਾਰਟ ਤਿਆਰ ਕਰੋ, ਜਿਸ ਵਿੱਚ ਸਮਾਜ ਨੂੰ ਚੰਗੀ ਸੇਧ ਦਿੰਦੇ ਮਾਟੋ ਸ਼ਾਮਲ ਹੋਣ ਇਹ ਸਕੂਲ ਦੀ ਦੀਵਾਰ ‘ਤੇ ਲਾਵਾਂਗੇ ਬਾਕੀ ਬੱਚਿਆਂ ਨੂੰ ਮੈਂ ਹੋਰ ਕੰਮ ਦਿੰਦਾ ਹਾਂ

(ਇਸ ਕੰਮ ਲਈ ਬੱਚੇ ਆਪਸ ਵਿੱਚ ਸਲਾਹ ਕਰਦੇ ਹਨ ਕਿ ਇਹ ਕੰਮ ਕਿਵੇਂ ਕਰਨਾ ਹੈ)

ਗੁਰਲੀਨ : ਮੇਰੇ ਕੋਲ ਗੁਲਾਬੀ ਰੰਗ ਦਾ ਖੂਬਸੂਰਤ ਚਾਰਟ ਹੈ, ਮੈਂ ਉਹ ਤੁਹਾਨੂੰ ਦਿੰਦੀ ਹਾਂ।
ਸ਼ਿਵਮ : ਮੇਰੇ ਕੋਲ ਰੰਗ ਹਨ ਆਪਾਂ ਇਸ ਚਾਰਟ ਲਈ ਰੰਗ ਵਰਤਾਂਗੇ ਮੈਂ ਰੰਗ ਭਰਨ ਵਿੱਚ ਤੁਹਾਡੀ ਮਦਦ ਕਰਾਂਗਾ
ਕਰਨਬੀਰ ਸਿੰਘ : ਮੈਂ ਪੇਂਟਿੰਗ ਕਰ ਸਕਦਾ ਹਾਂ ਤੇ ਸੁੰਦਰ ਲਿਖਾਈ ਵੀ
ਬਲਕਾਰ ਸਿੰਘ : ਆਹ ਲਵੋ ਪੈਨਸਿਲ, ਫੁੱਟਾ, ਘਾਤੂ ਅਤੇ ਰਬੜ
ਗਗਨਦੀਪ : ਪਰ ਇਸ ਚਾਰਟ ’ਤੇ ਜੋ ਲਿਖਣਾਹੈ ਉਹਨਾਅਰੇ ਤਾਂ ਆਪਣੇ ਕੋਲ ਹੈ ਨਹੀਂ?
ਸ਼ਰਨਜੀਤ ਕੌਰ : ਮੇਰੇ ਤੇ ਜਸਪ੍ਰੀਤ ਕੋਲ ਬਹੁਤ ਸਾਰੇ ਮਾਟੋ ਨੇ ਆਪਣੇ ਮੁੱਖ-ਅਧਿਆਪਕ ਜੀ ਸਵੇਰ ਦੀ ਸਭਾ ਵਿੱਚ ਬੋਲਦੇ ਹੁੰਦੇ ਨੇ ਉਹ ਅਸੀਂ ਕਾਪੀ ਤੇ ਲਿਖੇ ਨੇ
ਜਸਪ੍ਰੀਤ ਸਿੰਘ : ਹਾਂ! ਹਾਂ! ਮੇਰੇ ਕੋਲ ਵੀਨੇ, ਮੇਰੇ ਵੱਡੇ ਭਰਾ ਨੇ ਵੀ ਮੈਨੂੰ ਲਿਖਵਾਏ ਸੀ
ਹਰਸਿਮਰਨ ਤੇ ਨਵਜੋਤ : ਬਣਾਓ-ਬਣਾਓ ,ਅਸੀਂ ਤੁਹਾਨੂੰ ਸੈਲੋ-ਟੇਪ ਤੇ ਗੁੰਦ ਦਿੰਦੇ ਹਾਂ
(ਸਾਰੇ ਬੱਚੇ ਚਾਰਟ ਤਿਆਰ ਕਰਨ ਲਈ ਜਮਾਤ ਵਿੱਚ ਬੈਠ ਜਾਂਦੇ ਹਨ ਚਾਰਟ ਵਿਚਕਾਰ ਰੱਖ ਕੇ ਕੰਮ ਸ਼ੁਰੂ ਕਰਦੇ ਹਨ ਕਰਨਬੀਰ ਚਾਰਟ ’ਤੇ ਲਾਈਨਾਂ ਮਾਰ ਕੇ ਲਿਖਣ ਦੀ ਤਿਆਰੀ ਕਰਦਾ ਹੈ ਦੂਸਰੇ ਬੱਚੇ ਪੂਰੇ ਉਤਸੁਕ ਹਨ)

ਸ਼ਰਨਜੀਤ ਕੌਰ : ਲਿਖੋ
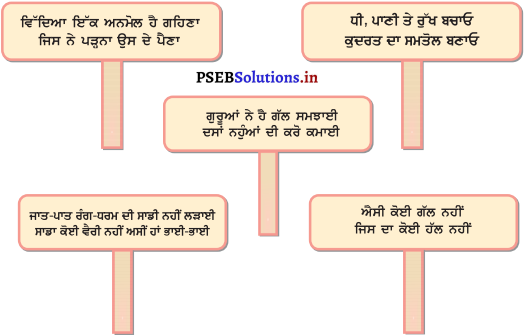
ਵਿੱਦਿਆਇੱਕ ਅਨਮੋਲ ਹੈਗਹਿਣਾ
ਜਿਸਨੇ ਪੜ੍ਹਨਾਉਸ ਦੇ ਪੈਣਾ
(ਕਰਨਬੀਰ ਸਿੰਘ ਲਿਖਣਾ ਸ਼ੁਰੂ ਕਰਦਾ ਹੈ।)
ਸ਼ਰਨਜੀਤ ਕੌਰ : (ਕੁਝ ਰੁਕ ਕੇ) ਆਹ ਵਿਚਾਰ ਬਹੁਤ ਸੋਹਣਾ ਹੈ, ਆਪਣੇ ਸਰ ਬੋਲਦੇ ਹੁੰਦੇ ਨੇ
ਧੀ, ਪਾਣੀ ਤੇ ਰੁੱਖ ਬਚਾਓ
ਕੁਦਰਤ ਦਾ ਸਮਤੋਲ ਬਣਾਓ

ਗਗਨਦੀਪ ਸਿੰਘ : ਸ਼ਰਨ ਦੀਦੀ, ਤੁਸੀਂ ਇਹ ਰਫ਼ ਕਾਪੀ ‘ਤੇ ਸਾਫ਼-ਸਾਫ਼ ਲਿਖ ਕੇ ਦੇ ਦੋ, ਕਰਨ ਤੋਂ ਜਲਦੀ-ਜਲਦੀ ਨਹੀਂ ਲਿਖਿਆ ਜਾ ਰਿਹਾ
ਕਰਨਬੀਰ ਸਿੰਘ : ਹਾਂ ! ਮੈਨੂੰ ਲਿਖ ਕੇ ਦੇ ਦੋ
(ਸ਼ਰਨਜੀਤ ਕੌਰ ਆਪਣੀਕਾਪੀ ’ਤੇ ਲਿਖਦੀ ਹੈ)
ਗੁਰੂਆਂਨੇ ਹੈ ਗੱਲ ਸਮਝਾਈ
ਦਸਾਂ ਨਹੁੰਆਂ ਦੀ ਕਰੋ ਕਮਾਈ
ਜਾਤ-ਪਾਤ, ਰੰਗ-ਧਰਮ ਦੀ ਸਾਡੀ ਨਹੀਂ ਲੜਾਈ
ਸਾਡਾ ਕੋਈ ਵੈਰੀਨਹੀਂ, ਅਸੀਂ ਹਾਂ ਭਾਈ-ਭਾਈ
ਜਸਪ੍ਰੀਤ ਸਿੰਘ : ਦੀਦੀ ਇੱਕ ਆਹਵਿਚਾਰ ਲਿਖ ਲੈ
ਐਸੀ ਕੋਈ ਗੱਲ ਨਹੀਂ।
ਜਿਸ ਦਾ ਕੋਈ ਹੱਲ ਨਹੀਂ
(ਸ਼ਰਨਜੀਤ ਕੌਰ ਲਿਖਦੀ ਹੈ ਅਤੇ ਸਾਰੇ ਬੱਚੇ ਮਿਲ ਕੇ ਚਾਰਟ ਤਿਆਰ ਕਰਦੇ ਹਨ।)

ਅਧਿਆਪਕ ਲਈ : ਉਪਰੋਕਤ ਕਿਰਿਆ ਦੀ ਵਿਆਖਿਆ ਕੀਤੀ ਜਾਵੇਗੀ ਤੇ ਭਾਈਚਾਰਕ ਸਾਂਝ ਦੇ ਅਰਥ ਦੱਸੇ ਜਾਣਗੇ ਸਮੂਹਿਕ ਸਾਂਝ ਨਾਲ਼ ਅਸੀਂ ਵੱਡੇ ਤੋਂ ਵੱਡੇ ਕੰਮ ਕਰ ਸਕਦੇ ਹਾਂ
ਜਮਾਤ ਵਿੱਚ ਕੀਤੇ ਜਾਣ ਵਾਲੇ ਕੰਮਾਂ ਦੀ ਸੂਚੀ :
1. ਕਮਰਾ ਸਜਾਉਣਾ
2. ਰਜਿਸਟਰ ਤੇ ਕਵਰ ਚੜਾਉਣਾ
3. ਵਿਦਿਆਰਥੀ ਦਾ ਜਨਮਦਿਨ ਮਨਾਉਣਾ
4. ਕੋਈ ਵਿਸ਼ੇਸ਼ ਦਿਨ ਮਨਾਉਣਾ

ਆਪਣੇ ਵਿਚਾਰ ਦੱਸ :
1) ਮਾਟੋ ਇੱਕ ਵਿੱਚ ਵਿੱਦਿਆ ਬਾਰੇ ਕੀ ਗੱਲ ਕਹੀ ਗਈ ਹੈ?
ਉੱਤਰ :
ਵਿੱਦਿਆ ਇੱਕ ਅਨਮੋਲ ਗਹਿਣਾ ਹੈ ਜੋ ਵਿਦਿਆਰਥੀ ਪੜ੍ਹਾਈ ਵਿੱਚ ਮਿਹਨਤ ਕਰ ਲੈਣਗੇ ਉਹਨਾਂ ਨੂੰ ਹੀ ਵਿੱਦਿਆ ਦਾ ਗਹਿਣਾ ਪ੍ਰਾਪਤ ਹੋਣਾ ਹੈ।
2) ਮਾਟੋ ਦੋ ਵਿੱਚ ਕਿਹੜੀਆਂ-ਕਿਹੜੀਆਂ ਚੀਜ਼ਾਂ ਨੂੰ ਬਚਾਉਣ ਦੀ ਗੱਲ ਕਹੀ ਗਈ ਹੈ ਅਤੇ ਕਿਉਂ?
ਉੱਤਰ :
ਆਟੋ ਵਿੱਚ ਧੀ, ਪਾਣੀ ਅਤੇ ਰੁੱਖਾਂ ਨੂੰ ਬਚਾਉਣ ਦੀ ਗੱਲ ਕੀਤੀ ਗਈ ਹੈ। ਕਿਉਂਕਿ ਲੋਕ ਧੀਆਂ ਨੂੰ ਕੁੱਖ ਵਿੱਚ ਹੀ ਖ਼ਤਮ ਕਰ ਰਹੇ ਹਨ, ਪਾਣੀ ਦੂਸ਼ਿਤ ਕੀਤਾ ਜਾ ਰਿਹਾ ਹੈ ਅਤੇ ਰੁੱਖਾਂ ਨੂੰ ਤੇ ਜੰਗਲਾਂ ਨੂੰ ਨਸ਼ਟ ਕੀਤਾ ਜਾ ਰਿਹਾ ਹੈ। ਇਸ ਲਈ ਇਹਨਾਂ ਸਭ ਨੂੰ ਬਚਾਉਣ ਦੀ ਲੋੜ ਹੈ।
3) ਸਾਨੂੰ ਦਸਾਂ ਨਹੁੰਆਂ ਦੀ ਕਿਰਤ ਕਿਉਂ ਕਰਨੀ ਚਾਹੀਦੀ ਹੈ?
ਉੱਤਰ :
ਦਸਾਂ ਨਹੁੰਆਂ ਦੀ ਕਿਰਤ ਤੋਂ ਭਾਵ ਹੈ ਹੱਥੀਂ ਮਿਹਨਤ ਕਰ ਕੇ ਆਪਣਾ ਜੀਵਨ ਨਿਰਬਾਹ ਕਰੋ। ਵਿਹਲੇ ਰਹਿ ਕੇ ਜਾਂ ਲੁੱਟ-ਖਸੁੱਟ ਕੇ ਨਾ ਖਾਓ।
4) ਸਾਨੂੰ ਆਪਸ ਵਿੱਚ ਕਿਵੇਂ ਰਹਿਣਾ ਚਾਹੀਦਾ ਹੈ?
ਉੱਤਰ :
ਸਾਨੂੰ ਆਪਸ ਵਿਚ ਪਿਆਰ ਨਾਲ, ਸਾਂਝੀਵਾਲਤਾ ਨਾਲ ਅਤੇ ਭਾਈਚਾਰੇ ਨਾਲ ਰਹਿਣਾ ਚਾਹੀਦਾ ਹੈ।
5) “ਐਸੀ ਕੋਈ ਗੱਲ ਨਹੀਂ, ਜਿਸ ਦਾ ਕੋਈ ਹੱਲ ਨਹੀਂ ਇਸ ਤੋਂ ਕੀ ਭਾਵ ਹੈ?
ਉੱਤਰ :
ਅਸੀਂ ਕੋਈ ਸਮੱਸਿਆ ਆਉਣ ‘ਤੇ ਘਬਰਾ ਜਾਂਦੇ ਹਾਂ, ਇੱਥੇ ਇਹ ਦੱਸਿਆ ਗਿਆ ਹੈ ਕਿ ਹਰ ਸਮੱਸਿਆ ਦਾ ਹੱਲ ਹੋ ਜਾਂਦਾ ਹੈ। ਸਾਨੂੰ ਘਬਰਾਉਣਾ ਨਹੀਂ ਚਾਹੀਦਾ।

(ਅ) ਸਕੂਲ ਪੱਧਰ ‘ਤੇ
ਹੱਥ-ਲਿਖਤ ਰਸਾਲਾ ਤਿਆਰ ਕਰਨਾ
(ਨੋਟ :- ਮੁੱਖ ਅਧਿਆਪਕ ਜੀ ਵੱਲੋਂ ਕਿਹਾ ਗਿਆ ਹੈ ਕਿ ਇੱਕ ਹੱਥ-ਲਿਖਤ ਰਸਾਲਾ ਤਿਆਰ ਕਰੋ, ਜਿਸ ਵਿੱਚ ਤੁਹਾਡੀਆਂ ਆਪਣੀਆਂ ਲਿਖੀਆਂ ਕਵਿਤਾਵਾਂ, ਕਹਾਣੀਆਂ, ਪੇਂਟਿੰਗ ਹੋਣ)

(ਵਿਹਲੇ ਪੀਰੀਅਡ ਵਿੱਚ ਬੈਠੇ ਬੱਚੇ ਵਿਚਾਰ ਕਰ ਰਹੇ ਹਨ ਕਿ ਰਸਾਲਾ ਕਿਵੇਂ ਕੱਢਿਆ ਜਾਵੇ।)
ਗੁਰਵਿੰਦਰ, ਗੁਰਲੀਨ : ਸਾਡੀ ਲਿਖਾਈ ਬਹੁਤ ਸੁੰਦਰ ਹੈ ਅਸੀਂ ਜਸਮੀਤ ਸਿੰਘ ਸਰ ਤੋਂ ਸਿੱਖੀ ਹੈ ਅਸੀਂ
ਅਤੇ ਦੀਪਜੋਤ ਰਚਨਾਵਾਂ ਨੂੰ ਸੁੰਦਰ ਕਰਕੇ ਲਿਖਾਂਗੇ
ਫ਼ਰੀਦਾ ਤੇ ਸਿਮਰਨ : ਅਸੀਂ ਕਵਿਤਾਵਾਂ, ਕਹਾਣੀਆਂ ਪੜ੍ਹ ਕੇ ਇਨ੍ਹਾਂ ਦੇ ਚਿੱਤਰ ਬਣਾਵਾਂਗੇ, ਜਿਸ ਨਾਲ ਸਾਡਾਮੈਗਜ਼ੀਨ ਬਹੁਤ ਸੁੰਦਰ ਬਣ ਜਾਵੇਗਾ
ਗੁਰਸੇਵਕ : ਮੈਂ ਇਸਦਾ ਮੁੱਖ ਪੰਨਾ(ਟਾਈਟਲ ਪੇਜ) ਬਣਾਵਾਂਗਾ, ਬਹੁਤ ਹੀ ਸੋਹਣਾ
ਤਾਨੀਆ ਅਤੇ ਅਰੁਣ : ਅਸੀਂ ਆਪਣੇ ਆਪ ਕੁਝ ਕਵਿਤਾਵਾਂ ਬਣਾਈਆਂ ਨੇ, ਮੰਮੀ, ਫ਼ੌਜੀ ਚਾਚਾ, ਕੁਲਫ਼ੀ, ਤਿਤਲੀਬਾਰੇ, ਉਹ ਦੇਵਾਂਗੇ।
ਸਾਹਿਲ : ਮੈਂ ਕਹਾਣੀਆਂ ਲਿਖੀਆਂ ਨੇ ਘਰ ਤੇ ਆਪਣੇ ਸਕੂਲ ਬਾਰੇ ਵਿਸ਼ਨੂੰ ਤੇ ਹਰਪ੍ਰੀਤ ਨੇ ਵੀ ਕਹਾਣੀਆਂ ਬਣਾਈਆਂ ਨੇ ਉਹਵੀਲਾਵਾਂਗੇ
ਖੁਸ਼ੀ : ਮੇਰੀ ਦਾਦੀ ਮੈਨੂੰ ਬੁਝਾਰਤਾਂ ਪਾਉਂਦੀ ਹੁੰਦੀ ਹੈ ਮੇਰੀ ਕਾਪੀ ’ਤੇ ਲਿਖੀਆਂ ਹੋਈਆਂਨੇ ਮੈਂ ਉਹ ਲਿਖ ਕੇ ਦੇਵਾਂਗੀ
ਅਨਿਲ : ਮੈਂ ਅੱਜ ਦਾ ਵਿਚਾਰ’ ਕਾਪੀ ‘ਤੇ ਲਿਖੇ ਹੋਏ ਹਨ ਸਾਡੇ ਮੈਡਮ ਜੀ ਲਿਖਵਾਉਂਦੇ ਹੁੰਦੇ ਸਨ, ਲੈ ਲੈਣਾ
ਪ੍ਰੀਤੀ : ਮੇਰੇ ਕੋਲ ਵੱਡਾ ਰਜਿਸਟਰ ਹੈ ਤੇ ਰੰਗ ਹਨ।ਉਹ ਲੈ ਲਵੋ। ਪੈਨਸਿਲ, ਗੂੰਦ, ਫੁੱਟਾ ਸਭ ਕੁਝ ਹੈ, ਕੰਮ ਸ਼ੁਰੂ ਕਰੋ

(ਬੱਚੇ ਮਿਲ ਕੇ ਹੱਥ-ਲਿਖਤ ਰਸਾਲਾ ਤਿਆਰ ਕਰਦੇ ਹਨ ਸਾਰੇ ਬਹੁਤ ਮਿਹਨਤ ਕਰਦੇ ਹਨ ਕੁਝ ਦਿਨਾਂ ਬਾਅਦ ਬੱਚੇ ਆਪਣੀ ਅਧਿਆਪਕਾ ਕੋਲ ਜਾਂਦੇ ਹਨ।)

ਸੱਤ-ਅੱਠ ਬੱਚੇ : ਮੈਡਮ ਜੀ, ਅਸੀਂ ਰਸਾਲਾ ਤਿਆਰ ਕਰ ਲਿਆ ਹੈ।
ਅਧਿਆਪਕਾ : (ਰਸਾਲਾ ਦੇਖਦੇ ਹੋਏ) ਸ਼ਾਬਾਸ਼ ਬੱਚਿਓ! ਆਹ ਤਾਂ ਤੁਸੀਂ ਕਮਾਲ ਹੀ ਕਰ ਦਿੱਤਾ ਥੋੜ੍ਹੇ ਦਿਨਾਂ ਵਿੱਚ ਐਨਾ ਕੰਮ, ਵਾਹ! (ਕੁਝ ਰੁਕ ਕੇ) ਹੁਣ ਆਪਾਂ ਇਸ ਵਿੱਚ ਆਪਣੇ ਰਾਸ਼ਟਰੀ ਝੰਡੇ ਦੀ ਤਸਵੀਰ ਵੀ ਲਾਵਾਂਗੇ, ਸ਼ਹੀਦਾਂ, ਗੁਰੂਆਂ, ਪੀਰਾਂ, ਖਿਡਾਰੀਆਂ, ਲੇਖਕਾਂ ਦੀਆਂ ਤਸਵੀਰਾਂ ਲਗਾਵਾਂਗੇ ਇਸ ਵਿੱਚ ਤੁਹਾਡੀਆਂ ਤੇ ਸਕੂਲ ਦੇ ਹੋਣਹਾਰ ਵਿਦਿਆਰਥੀਆਂ ਦੀਆਂ ਤਸਵੀਰਾਂਵੀਲਾਵਾਂਗੇ
ਬੱਚੇ : ਜੀ ਮੈਡਮ ਜੀ, ਜ਼ਰੂਰ ਲਾਵਾਂਗੇ
ਅਧਿਆਪਕਾ : ਇਸ ਨੂੰ ਬਿਲਕੁਲ ਮੁਕੰਮਲ ਕਰ ਲਵੋ ਅਗਲੇ ਹਫ਼ਤੇ ਅਸੀਂ ਇਸ ਮੈਗਜ਼ੀਨ ਨੂੰ। ਆਪਣੇ ਮੁੱਖ ਅਧਿਆਪਕ ਜੀ ਤੋਂ ਰਿਲੀਜ਼ ਕਰਵਾਵਾਂਗੇ
ਬੱਚੇ : ਜੀ ਮੈਡਮ ਜੀ
ਅਧਿਆਪਕਾ : ਪਰ ਬੱਚਿਓ!ਇਸ ਮੈਗਜ਼ੀਨ ਦਾ ਕੀਨਾਂ ਰੱਖਿਆ?
ਤਾਨੀਆ : ਜੀ, ਅਸੀਂ ਨਾਂ ਰੱਖਿਆ ਹੈ, “ਸਾਂਝ ਵਧਾਈਏ।
ਅਧਿਆਪਕਾ : ਇਹ ਨਾਂ ਕੁਝ ਢੁੱਕਵਾਂ ਨਹੀਂ, ਆਪਾਂ ਨਾਮ ਰੱਖੀਏ ‘ਨਿੱਕੇ-ਨਿੱਕੇ ਤਾਰੇ’ ਤੁਸੀਂ ਸਾਰੇ ਤਾਰੇ ਹੋ, ਸਾਨੂੰ ਪਿਆਰੇ ਹੋ

ਅਗਲੇ ਹਫ਼ਤੇ ਦਾ ਦ੍ਰਿਸ਼ – ਸਕੂਲ ਦਾ ਮੈਗਜ਼ੀਨ ਨਿੱਕੇ-ਨਿੱਕੇ ਤਾਰੇ ਰਿਲੀਜ਼ ਕਰਦੇ ਹੋਏ
ਪ੍ਰਸ਼ਨ :
1) ਤੁਹਾਡੇ ਸਕੂਲ ਦੇ ਹੱਥ-ਲਿਖਤ ਰਸਾਲੇਦਾ ਕੀ ਹੈ?
ਉੱਤਰ :
ਨਿੱਕੇ-ਨਿੱਕੇ ਤਾਰੇ।

2) ਕੀ ਤੁਹਾਡੀ ਕੋਈ ਰਚਨਾ ਸਕੂਲ ਦੇ ਰਸਾਲੇ ‘ਚ ਛਪੀ ਹੈ? ਜੇਕਰ ਹਾਂ ਤਾਂ ਉਸਦਾ ਨਾਂ ਦੱਸੇ ਤੇਸੁਣਾਉ
ਉੱਤਰ :
ਹਾਂ, ਛਪੀ ਹੈ, ਇੱਕ ਕਵਿਤਾ ਹੈ ਜਿਸ ਦਾ ਨਾਂ ਹੈ-ਮੱਛਰ।
ਮੱਛਰ
ਇਹ ਛੋਟਾ ਜਿਹਾ ਕਰਦਾ ਰਹਿੰਦਾ ਭੀ ਕੀਂ ਸਾਡੇ ਕੰਨਾਂ ਵਿਚ, ਤੰਗ ਕਰ ਦਿੰਦਾ ਹੈ ਸਾਨੂੰ।
ਪਾਪਾ ਨੂੰ ਪੁੱਛਿਆ ਇਹੀ ਸਵਾਲ ਕਿ ਇਹ ਕਿਸ ਤਰ੍ਹਾਂ ਲਭਦਾ ਹੈ ਸਾਨੂੰ ਉਹਨਾਂ ਦੱਸਿਆ ਕਿ ਇਹ ਸਾਡੇ ਸਰੀਰ ਦੀ ਗਰਮੀ ਨਾਲ ਲੈਂਦਾ ਹੈ ਲਭ ਸਾਨੂੰ।
ਹੁੰਦਾ ਹੈ ਇਹ ਬਹੁਤ ਖਤਰਨਾਕ ਕਰ ਸਕਦਾ ਹੈ। ਇਸ ਦਾ ਇਕ ਡੰਗ ਬਿਮਾਰ ਸਾਨੂੰ ਹੋ ਸਕਦਾ ਹੈ ਮਲੇਰੀਆ, ਡੇਂਗੂ ਅਤੇ ਚਿਕਨਗੁਨੀਆਂ ਸਾਨੂੰ ਇਸ ਤੋਂ ਬਚਾਅ ਲਈ ਕਿਤੇ ਵੀ ਪਾਣੀ ਨਾ ਹੋਣ ਦਿਓ ਇਕੱਠਾ ਕਰ ਦਿਓ ਇਸ ਦਾ ਕੰਮ ਤਮਾਮ ਸੋਨੂੰ।
3) ਜਿਸ ਬੱਚੇ ਨੂੰ ਬੁਝਾਰਤ ਆਉਂਦੀ ਹੈ, ਸੁਣਾਉ? ਬਾਕੀ ਬੱਚੇ ਬੁੱਝਣਗੇ
ਉੱਤਰ :
ਮੋਰ !
4) ਸੁੰਦਰ ਲਿਖਾਈਵਾਲੇ ਬੱਚਿਆਂ ਅਤੇ ਸਿਖਾਉਣ ਵਾਲੇ ਅਧਿਆਪਕ ਦਾ ਨਾਂ ਦੱਸੇ
ਉੱਤਰ :
ਜਸਮੀਤ ਸਿੰਘ ਸਰ।
5) ਕੁੱਝ ਬਾਲ-ਰਸਾਲਿਆਂ ਦੇ ਨਾਂ ਦੱਸੋ।
ਉੱਤਰ :
ਪ੍ਰਾਇਮਰੀ ਸਿੱਖਿਆ, ਪੰਖੜੀਆਂ, ਆਲੇਭੋਲੇ।

(ਈ) ਪਿੰਡ ਪੱਧਰ ‘ਤੇ
(i) ਰੈਲੀ ਕੱਢਣੀ

(ਅਧਿਆਪਕ ਦੱਸੇਗਾ ਕਿ ਪਿੰਡ ਦੇ ਵਿਕਾਸ ਲਈ, ਦਸਵੀਂ-ਬਾਰੂਵੀਂ ਤੱਕ ਦੇ ਬੱਚੇ ਆਪਣੇ ਅਧਿਆਪਕ, ਪਿੰਡ ਦੇ ਮੁੱਖ ਸੂਝਵਾਨ ਲੋਕਾਂ ਨਾਲ ਮਿਲ ਕੇ ਰੈਲੀ ਕੱਢ ਰਹੇ ਹਨ, ਜਿਸ ਵਿੱਚ ਗੱਤੇ ਦੀਆਂ ਤਖ਼ਤੀਆਂ ਬਣਾ ਕੇ, ਉਨ੍ਹਾਂ ਨੂੰ ਲੱਕੜ ਦੇ ਡੰਡਿਆਂ ਨਾਲ ਜੋੜ ਕੇ, ਗੱਤੇ ਤੇ ਮਾਟੋ ਲਿਖ ਕੇ ਲਿਜਾਏ ਜਾਣਗੇ ਹਰ ਵਿਦਿਆਰਥੀ ਕੋਲ ਮਾਟੋ ਹੋਵੇਗਾ ਅਤੇ ਉਹ ਨਾਅਰੇ ਲਗਾਉਂਦੇ ਹੋਏ ਜਾਣਗੇ ਮਾਟੋਆਂ ਵਿੱਚ ਮਨੁੱਖੀ ਕਦਰਾਂ-ਕੀਮਤਾਂ, ਪੜ੍ਹਾਈ, ਪਾਣੀ ਦੀ ਬੱਚਤ, ਸ਼ੁੱਧ ਹਵਾ, ਰੁੱਖ ਬਚਾਓ, ਨਸ਼ੇ ਤਿਆਗੋ, ਖੇਡਾਂ, ਸਾਫ਼ਸਫ਼ਾਈ ਆਦਿ ਬਾਰੇ ਜ਼ਿਕਰ ਹੋਵੇਗਾ)
ਵਿਸ਼ੇਸ਼ ਤੌਰ ‘ਤੇ ਬੱਚਿਆਂ ਦੁਆਰਾ ਕਿਰਿਆ-1 ਵਿੱਚ ਤਿਆਰ ਕੀਤਾ ਗਿਆ ਪੋਸਟਰ ਜਿਸ ਵਿੱਚ ਮਾਟੋ ਲਗਾਏ ਹਨ ਉਨ੍ਹਾਂ ਦੀਆਂ ਤਖ਼ਤੀਆਂ ਬਣਾਉਣੀਆਂ
ਨਵੇਂ ਮਾਟੋ ਅਤੇ ਨਾਅਰੇ :

1. ਧੀ ਬਚਾਓ-ਧੀ ਪੜਾਓ
2. ਸਰਕਾਰੀ ਸਕੂਲਾਂ ‘ਚਦਾਖ਼ਲੇ ਕਰਾਓ
ਹਰ ਬੱਚੇ ਨੂੰ ਮੁਫ਼ਤ ਪੜਾਓ
3. ਹਰ ਬੱਚੇ ਨੇ ਸਹੁੰ ਇਹ ਖਾਈ
ਪਿੰਡ ਦੀ ਰੱਖਣੀ ਬਹੁਤ ਸਫ਼ਾਈ
4. ਆਓ ਮੈਡੀਕਲ ਕੈਂਪ ਲਗਾਈਏ
ਸਿਹਤ ਨੂੰ ਤੰਦਰੁਸਤ ਬਣਾਈਏ
5. ਲੋਕੋ ਜਾਗੋ – ਨਸ਼ੇ ਤਿਆਗੋ


(ii) ਪਿੰਡ ਦਾ ਇਨਾਮ-ਵੰਡ ਸਮਾਰੋਹ
(ਪਿੰਡ ਵਿਚ ਸਮਾਗਮ ਹੈ ਬਹੁਤ ਸਾਰੇ ਲੋਕ ਆਏ ਹੋਏ ਹਨ ਸਟੇਜ ਉੱਤੇ ਪਿੰਡ ਦੇ ਸਰਪੰਚ ਸ : ਪ੍ਰੇਮ ਸਿੰਘ, ਮੁੱਖ-ਅਧਿਆਪਕ, ਅਧਿਆਪਕ ਤੇ ਹੋਰ ਪਤਵੰਤੇ ਸੱਜਣ ਇਨਾਮ ਵੰਡਣ ਦੀ ਮੁਦਰਾ ‘ਚ ਖੜ੍ਹੇ ਹੋਏ ਹਨ )
ਅਧਿਆਪਕ : ਅੱਜ ਅਸੀਂ ਉਨ੍ਹਾਂ ਵਿਦਿਆਰਥੀਆਂ ਅਤੇ ਨੌਜਵਾਨਾਂ ਦਾ ਸਨਮਾਨ ਕਰਾਂਗੇ, ਜਿਨ੍ਹਾਂ ਨੇ ਪਿੰਡ ਦਾ ਨਾਂ ਰੌਸ਼ਨ ਕਰਨ ਵਿਚ ਬਹੁਤ ਵੱਡਾ ਯੋਗਦਾਨ ਪਾਇਆ ਹੈ ਬਲਰਾਜ ਅਤੇ ਉਸਦੇ 10 ਦੋਸਤਾਂ ਨੇ ਪਿੰਡ ਨਾਲ ਮਿਲ ਕੇ ਸੌ ਤੋਂ ਵੱਧ ਰੁੱਖ ਲਗਾਏ ਤੇ ਸਾਂਭ ਕੇ ਰੱਖੇ, ਪਾਣੀ ਦਿੱਤਾ ਹੁਣ ਉਹ ਵੱਡੇ ਹੋ ਗਏ ਹਨ ਇਨ੍ਹਾਂ ਨੇ ਪਿੰਡ ਦੀ ਸਫ਼ਾਈ ਕਰਨ ਵਿੱਚ ਵੀ ਯੋਗਦਾਨ ਪਾਇਆਹੈ
11 ਵਿਦਿਆਰਥੀਆਂ ਨੇ ਪਿੰਡ ਵਿਚ ਰੈਲੀ ਕੱਢ ਕੇ ਸਾਰੇ ਪਿੰਡ ਨੂੰ ਚੰਗੀਆਂ ਕਦਰਾਂ-ਕੀਮਤਾਂ ਅਤੇ ਚੰਗੇ ਕੰਮਾਂ ਲਈ ਪ੍ਰੇਰਿਤ ਕੀਤਾ ਇੱਕ ਟੀਮ ਨੇ ਮੈਡੀਕਲ-ਕੈਂਪ ਲਗਵਾਇਆ, ਜਿਸ ਵਿੱਚ ਪਿੰਡ ਦੇ ਪੀੜਤ ਮਰੀਜ਼ਾਂ ਦਾ ਚੈੱਕ-ਅਪ ਕੀਤਾ ਤੇ ਇਲਾਜ ਕਰਵਾਇਆ
15 ਵਿਦਿਆਰਥੀਆਂ ਨੇ ਪਿੰਡ ਦੇ ਅਨਪੜ ਬਜ਼ੁਰਗਾਂ, ਕਮਜ਼ੋਰ ਵਿਦਿਆਰਥੀਆਂ ਨੂੰ ਮੁਫ਼ਤ ਸਿੱਖਿਆ ਦਿੱਤੀ ਇਨ੍ਹਾਂ ਨੂੰ ਵੀ ਸਨਮਾਨਿਤ ਕੀਤਾ ਜਾਵੇ

ਅਧਿਆਪਕ : ਹੁਣ ਮੈਂ ਬੇਨਤੀ ਕਰਾਂਗਾ ਸਾਡੇ ਪਿੰਡ ਦੇ ਸਰਪੰਚ ਸਾਹਿਬ ਨੂੰ ਕਿ ਉਹ ਸਟੇਜ ‘ਤੇ ਆਉਣ ਅਤੇ ਆਪਣੇ ਵਿਚਾਰ ਸਾਡੇ ਨਾਲ ਸਾਂਝੇ ਕਰਨ
ਸਰਪੰਚ : ਪਿੰਡ ਦੇ ਸਤਿਕਾਰਯੋਗ ਬਜ਼ੁਰਗੋ, ਭੈਣਾਂ-ਭਰਾਵੇ, ਅਧਿਆਪਕ ਸਾਹਿਬਾਨ ਅਤੇ ਪਿਆਰੇ ਵਿਦਿਆਰਥੀਓ , ਮੈਨੂੰ ਬਹੁਤ ਖੁਸ਼ੀ ਹੈ ਕਿ ਆਪਣੇ ਪਿੰਡ ਦੇ ਨੌਜਵਾਨਾਂ, ਵਿਦਿਆਰਥੀਆਂ ਨੇ ਪਿੰਡ ਨੂੰ ਬਹੁਤ ਖੂਬਸੂਰਤ, ਸਾਫ਼-ਸੁਥਰਾ, ਸਿਹਤਮੰਦ ਤੇ ਖੁਸ਼ਹਾਲ ਬਣਾ ਦਿੱਤਾ ਹੈ ਇਨ੍ਹਾਂ ਨੌਜਵਾਨਾਂ ਕਰਕੇ ਆਪਣਾ ਪਿੰਡ ਪਹਿਲੇ ਨੰਬਰ ਤੇ ਆਇਆਹੈ ਇਨ੍ਹਾਂ ਲਈ ਜ਼ੋਰਦਾਰ ਤਾੜੀ ਲਾਓ ਤੁਹਾਡਾ ਧੰਨਵਾਦ (ਜ਼ੋਰਦਾਰ ਤਾੜੀਆਂ ਦੀ ਅਵਾਜ਼ ਗੂੰਜਦੀ ਹੈ)

ਅਧਿਆਪਕ : ਧੰਨਵਾਦ ਸਰਪੰਚ ਸਾਹਿਬ ਇਸ ਖੁਸ਼ੀ ਮੌਕੇ ਭਾਈਚਾਰਕ ਸਾਂਝ ਨੂੰ ਸਮਰਪਿਤ ਪੇਸ਼ ਹੈ, ਪੰਜਵੀਂ ਜਮਾਤ ਦੀ ਵਿਦਿਆਰਥਣ ਸ਼ਰਨਜੀਤ ਕੌਰ ਦੀ ਸੁਰੀਲੀ ਅਵਾਜ਼ ਵਿੱਚ ਇੱਕ ਗੀਤ :
ਸ਼ਰਨਜੀਤ ਕੌਰ ਆਪਣਾ ਗੀਤ ਗਾਉਂਦੀ ਹੈ :
ਕੀ ਲੈਣਾ ਆਪਸ ਵਿੱਚ ਲੜ ਕੇ,
ਅਸੀਂ ਆਪਣੀ ਸਾਂਝ ਵਧਾਵਾਂਗੇ।
ਸਭ ਮਾੜੀਆਂ ਰਸਮਾਂ ਛੱਡਾਂਗੇ,
ਅਸੀਂ ਅੱਗੇ ਵਧਦੇ ਜਾਵਾਂਗੇ।
ਧਰਤ, ਹਵਾ ਤੇ ਪਾਣੀ ਨੂੰ,
ਨਾਲੇ ਧੀਆਂ ਤਾਈਂ ਬਚਾਉਣਾ ਹੈ,
ਅਸੀਂ ਗੰਦੇ ਗੀਤ ਨਹੀਂ ਸੁਣਨੇ,
ਏਕੇ ਦਾਗਾਣਾ ਗਾਉਣਾਹੈ।
ਅਸੀਂ ਊਚ-ਨੀਚ ਦੀ ਲਾਹਨਤ ਨੂੰ,
ਰਲ਼-ਮਿਲ਼ ਕੇ ਦੂਰ ਭਜਾਵਾਂਗੇ,
ਕੀ ਲੈਣਾ……….।
ਮਿਲ-ਜੁਲ ਕੇ ਇਹੋ ਦੁਆਕਰੀਏ,
ਖੁਸ਼ਹਾਲ ਰਹੇ ਪੰਜਾਬ ਸਾਡਾ,
ਕਣ-ਕਣ ਵਿੱਚ ਖੁਸ਼ੀਆਂ ਹੀ ਹੋਵਣ,
ਮਹਿਕੀਜਾਏ ਸਦਾ ਗੁਲਾਬ ਸਾਡਾ,
ਨਸ਼ਿਆਂ ਤੋਂ ਰਹਿ ਕੇ ਦੂਰ ਸਦਾ,
ਅਸੀਂ ਹੱਕ ਦੀ ਰੋਟੀ ਖਾਵਾਂਗੇ,
ਕੀ ਲੈਣਾ………..!

(ਤਾੜੀਆਂ ਦੀ ਅਵਾਜ਼)
ਸਵਾਲਨਾਮਾ (i)
ਭਾਈਚਾਰਕ ਸਾਂਝ ਦੇ ਦ੍ਰਿਸ਼


ਸਵਾਲਨਾਮਾ (ii)
ਅਧਿਆਪਕ ਗੱਲਬਾਤ ਕਰੇਗਾ ਕਿ ਭਾਈਚਾਰਕ ਸਾਂਝ ਕਿਹੜੀਆਂ ਤਸਵੀਰਾਂ ਵਿੱਚ ਹੈ


PSEB 5th Class Welcome Life Guide ਭਾਈਚਾਰਕ ਸਾਂਝ Important Questions and Answers
ਹੋਰ ਮਹੱਤਵਪੂਰਨ ਪ੍ਰਸ਼ਨ
ਬਹੁਵਿਕਲਪੀ ਪ੍ਰਸ਼ਨ :
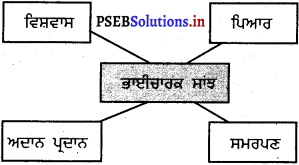
1. ਭਾਈਚਾਰਕ ਸਾਂਝ ਹੈ :
(ੳ) ਇੱਕ ਦੂਜੇ ਪ੍ਰਤੀ ਵਿਸ਼ਵਾਸ
(ਅ) ਪਿਆਰ
(ਇ) ਸਮਰਪਣ
(ਸ) ਸਾਰੇ ਠੀਕ
ਉੱਤਰ :
(ਸ) ਸਾਰੇ ਠੀਕ।

2. ਸ਼ਰਨਜੀਤ ਕੌਰ ਨੇ ਕਿਹੜਾ ਮਾਟੋ ਦੱਸਿਆ ?
(ਉ) ਵਿੱਦਿਆ ਇੱਕ ਅਨਮੋਲ ਹੈ ਗਹਿਣਾ ਜਿਸ ਨੇ ਪੜ੍ਹਨਾ ਉਸ ਦੇ ਪੈਣਾ।
(ਅ) ਧੀ, ਪਾਣੀ ਤੇ ਰੁੱਖ ਬਚਾਓ
(ਈ) ਕੁਦਰਤ ਦਾ ਸਮਤੋਲ ਬਣਾਓ। ਗੁਰੂਆਂ ਨੇ ਹੈ ਗੱਲ ਸਮਝਾਈ ਦਸਾਂ ਨਹੁੰਆਂ ਦੀ ਕਰੋ ਕਮਾਈ।
(ਸ) ਐਸੀ ਕੋਈ ਗੱਲ ਨਹੀਂ।
(ਸ) ਜਿਸ ਦਾ ਕੋਈ ਹੱਲ ਨਹੀਂ।
ਉੱਤਰ :
(ਅ) ਧੀ, ਪਾਣੀ ਤੇ ਰੁੱਖ ਬਚਾਓ ਕੁਦਰਤ ਦਾ ਸਮਤੋਲ ਬਣਾਓ।
3. ਪੇਂਟਿੰਗ ਕੌਣ ਕਰ ਸਕਦਾ ਸੀ ?
(ਉ) ਗੁਰਲੀਨ
(ਆ) ਸ਼ਿਵਮ
(ਈ) ਕਰਨਬੀਰ ਸਿੰਘ
(ਸ) ਗਗਨਦੀਪ।
ਉੱਤਰ :
(ਈ) ਕਰਨਬੀਰ ਸਿੰਘ
4. ਗੁਰਵਿੰਦਰ ਅਤੇ ਗੁਰਲੀਨ ਨੇ ਸੁੰਦਰ ਲਿਖਾਈ ਕਿਸ ਤੋਂ ਸਿੱਖੀ ?
(ਉ) ਜਸਮੀਤ ਸਿੰਘ ਸਰ ਤੋਂ
(ਅ) ਲੈਂਬਰ ਸਿੰਘ ਸਰ ਤੋਂ
(ਈ) ਸ਼ਰਨਜੀਤ ਸਰ ਤੋਂ
(ਸ) ਕਰਮਜੀਤ ਸਰ ਤੋਂ।
ਉੱਤਰ :
(ੳ) ਜਸਮੀਤ ਸਿੰਘ ਸਰ ਤੋਂ।
5. ਸਕੂਲ ਦੇ ਰਸਾਲੇ ਦਾ ਨਾਂ ਕੀ ਸੀ ?
(ਉ) ਪੰਖੜੀਆਂ
(ਅ) ਨਿੱਕੇ-ਨਿੱਕੇ ਤਾਰੇ
(ਈ) ਆਲੇ ਭੋਲੇ
(ਸ) ਕੋਈ ਨਹੀਂ।
ਉੱਤਰ :
(ਅ) ਨਿੱਕੇ-ਨਿੱਕੇ ਤਾਰੇ।

ਖਾਲੀ ਥਾਂਵਾਂ ਭਰੋ :
1. ਕਈ ਬੱਚਿਆਂ ਨਾਲ …………………………………. ਬਣਦੀ ਹੈ।
2. ਸਕੂਲ ਦੇ ਰਸਾਲੇ ਦਾ ਨਾਮ ਸੀ ………………………………….!
3. ਰਸਾਲੇ ਦਾ ਮੁੱਖ ਪੰਨਾ …………………………………. ਨੇ ਬਣਾਉਣ ਬਾਰੇ ਕਿਹਾ
ਉੱਤਰ :
1. ਜਮਾਤ
2. ਨਿੱਕੇ ਨਿੱਕੇ ਤਾਰੇ
3. ਗੁਰਸੇਵਕ।
ਸਹੀ ਲੜ ਦਾ ਨਿਸ਼ਾਨ ਲਗਾਓ :
1. ਗੁਰਵਿੰਦਰ ਦੀ ਲਿਖਾਈ ਸੁੰਦਰ ਹੈ।
2. ਸ਼ਰਨਜੀਤ ਕੌਰ ਨੇ ਗੀਤ ਗਾ ਕੇ ਸੁਣਾਇਆ।
3. ਖ਼ੁਸ਼ੀ ਨੇ ਦਾਦੀ ਦੀਆਂ ਬੁਝਾਰਤਾਂ ਕਾਪੀ ਤੇ ਲਿਖੀਆਂ ਸਨ।
4. ਵਿਸ਼ਨੂੰ ਅਤੇ ਹਰਪ੍ਰੀਤ ਨੇ ਕਵਿਤਾਵਾਂ ਬਣਾਈਆਂ ਸਨ।
ਉੱਤਰ :
1. ਠੀਕ
2. ਠੀਕ
3. ਠੀਕ
4. ਗ਼ਲਤ।
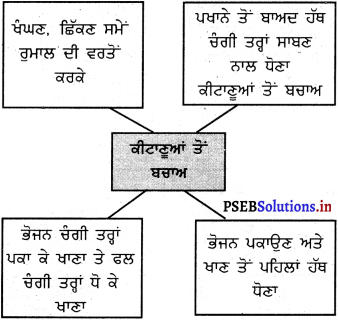
ਮਾਈਂਡ ਮੈਪਿੰਗ :
ਉੱਤਰ :

ਮਿਲਾਨ ਕਰੋ :
1. ਕਰਨਬੀਰ ਸਿੰਘ – (ਉ) ਗੀਤ ਗਾਇਆ
2. ਗੁਰਲੀਨ – (ਅ) ਪੇਂਟਿੰਗ ਕਰ – ਸਕਦਾ ਹੈ।
3. ਸਕੂਲ ਦਾ ਮੈਗਜ਼ੀਨ (ਈ) – ਸੁੰਦਰ ਲਿਖਾਈ
4. ਸ਼ਰਨਜੀਤ ਕੌਰ – (ਸ) ਨਿੱਕੇ ਨਿੱਕੇ ਤਾਰੇ।
ਉੱਤਰ :
1. (ਅ)
2. (ਈ)
3. (ਸ)
4. (ਉ)
ਛੋਟੇ ਉੱਤਰਾਂ ਵਾਲੇ ਪ੍ਰਸ਼ਨ :
ਪ੍ਰਸ਼ਨ 1.
ਭਾਈਚਾਰਕ ਸਾਂਝ ਤੋਂ ਕਿਵੇਂ ਪੈਦਾ ਹੁੰਦੀ ਹੈ ?
ਉੱਤਰ :
ਸਾਡੀਆਂ ਜੀਵਨ ਵਿਚ ਬਹੁਤ ਸਾਰੀਆਂ . ਲੋੜਾਂ ਹਨ, ਜਿਸ ਕਾਰਨ ਅਸੀਂ ਹੋਰਨਾਂ ਨਾਲ ਸੰਬੰਧ ਬਣਾਉਂਦੇ ਹਾਂ ਸਾਡੀਆਂ ਲੋੜਾਂ ਹੀ ਭਾਈਚਾਰਕ ਸਾਂਝ ਪੈਦਾ ਕਰਦੀਆਂ ਹਨ
ਪ੍ਰਸ਼ਨ 2.
ਪਿੰਡ ਪੱਧਰ ‘ਤੇ ਕੱਢੀ ਜਾਣ ਵਾਲੀ ਰੈਲੀ ਵਿੱਚ ਕਿਸ ਤਰ੍ਹਾਂ ਦੇ ਮਾਟੋ ਹੋਣੇ ਸਨ ? :
ਉੱਤਰ :
ਮਨੁੱਖੀ ਕਦਰਾਂ-ਕੀਮਤਾਂ, ਸ਼ੁੱਧ ਹਵਾ, ਖੇਡਾਂ, ਸਾਫ਼-ਸਫ਼ਾਈ, ਪੜ੍ਹਾਈ, ਪਾਣੀ ਦੀ ਬਚਤ ਆਦਿ।
ਪ੍ਰਸ਼ਨ 3.
ਤਾਨੀਆ ਨੇ ਸਕੂਲ ਦੇ ਮੈਗਜ਼ੀਨ ਦਾ ਕੀ ਨਾਂ ਦੱਸਿਆ ?
ਉੱਤਰ :
ਉਸ ਨੇ ਇਸ ਦਾ ਨਾਂ ‘ਸਾਂਝ ਵਧਾਈਏ’ ਦੱਸਿਆ।
ਪ੍ਰਸ਼ਨ 4.
ਤਾਨੀਆ ਅਤੇ ਅਰੁਣ ਦੀਆਂ ਕਵਿਤਾਵਾਂ ਕਿਸ ਬਾਰੇ ਸਨ ?
ਉੱਤਰ :
ਮੰਮੀ, ਫ਼ੌਜੀ ਚਾਚਾ, ਕੁਲਫੀ, ਤਿਤਲੀ ਬਾਰੇ।

ਪ੍ਰਸ਼ਨ 5. ਨਸ਼ਾ ਛੱਡਣ ਬਾਰੇ ਇੱਕ ਮਾਟੋ ਲਿਖੋ।
ਉੱਤਰ :
ਲੋਕੋ ਜਾਗੋ, ਨਸ਼ਾ ਤਿਆਗੋ।
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
























 ਕੀਟਾਣੂ ਚੱਕਰ ਤੋੜੋ !
ਕੀਟਾਣੂ ਚੱਕਰ ਤੋੜੋ !